二氢杨梅素及其酰化衍生物对肝细胞氧化损伤的保护作用
2022-07-08杜宝双陈尚卫
杜宝双 陈尚卫 李 玥 朱 松
(1. 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2. 江南大学食品学院,江苏 无锡 214122)
大部分的肝损伤疾病如肝硬化、肝纤维化等,都伴随着由细胞氧化应激以及脂质过氧化[1]引起的肝细胞氧化损伤。
二氢杨梅素(DHM)是一种苷元类类黄酮化合物,主要来源于药食同源植物显齿蛇葡萄[2],具有抗菌、抗氧化、抗炎、护肝、调节糖代谢等生物功能[3-4]。有研究发现二氢杨梅素可以通过调节抗氧化指标和抗炎因子抑制氧化应激从而减轻小鼠肝脏氧化损伤[5],且在油酸诱导的L02细胞和HepG2细胞肝脂肪变性模型中,二氢杨梅素具有抑制细胞凋亡、脂质积累和氧化应激的作用[6]。但由于二氢杨梅素亲脂性差,在生物体系中不易透过脂质双分子层,使其转运吸收缓慢,限制了其在肝脏中的利用。
目前,可以通过酰化修饰提高DHM的脂溶性,即选择合适的酰基供体取代二氢杨梅素分子上对其活性影响较小的羟基基团,进而降低其极性[7]。其中,酶法酰化是常用的酰化方法,该方法绿色环保、过程简单且选择性高[8]。因此研究拟建立人正常肝细胞氧化损伤模型,通过酶法酰化修饰DHM得到不同亲脂性的DHM衍生物,考察DHM及其衍生物对肝细胞氧化损伤模型的保护机制,以期为二氢杨梅素应用于生物体系提供理论依据。
1 材料与方法
1.1 材料与试剂
二氢杨梅素、槲皮素:纯度>98%,合肥博美生物科技有限公司;
固定化脂肪酶(Lipozyme TL IM):250 U/g,诺维信生物技术有限公司;
丁酸乙烯酯、己酸乙烯酯、辛酸乙烯酯和己酸乙烯酯:东京化成工业株式会社;
30%过氧化氢(H2O2)、甲基叔丁基醚:分析纯,国药集团化学试剂有限公司;
PMSF蛋白酶抑制剂、ROS试剂盒、线粒体膜电位检测试剂盒、RIPA细胞裂解液、Caspase 3活性检测试剂盒:上海碧云天生物技术有限公司;
胎牛血清(FBS)、青霉素—链霉素双抗(100×)、磷酸缓冲液(PBS):Themo Fisher Scientific公司;
MTT试剂盒、LDH检测试剂盒、BCA试剂盒、MDA检测试剂盒、总SOD活性检测试剂盒、CAT检测试剂盒、GSH-PX检测试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
倒置荧光显微镜:ECLISE Ti2型,美国尼康公司;
高速冷冻离心机:Centrifuge 5415R型,德国艾本德公司;
雪花制冰机:FMB40型,无锡沃信有限公司;
全波长酶标仪:Multiskan GO1510型,赛默飞科技有限公司;
磁力搅拌器:RET型,IKA公司。
1.3 试验方法
1.3.1 DHM衍生物制备 在反应瓶中依次加入10 mL甲基叔丁基醚,0.18 mmol DHM和0.4 U/mg DHM的固定化脂肪酶,再分别加入3.6 mmol不同碳链的脂肪酸乙烯酯,上述反应体系在50 ℃、200 r/min下反应72 h。然后分离纯化样品,冷冻干燥后得到5种3-O-酰化二氢杨梅素,分别为3-O-乙酰化二氢杨梅素(C2-DHM)、3-O-丁酰化二氢杨梅素(C4-DHM)、3-O-己酰化二氢杨梅素(C6-DHM)、3-O-辛酰化二氢杨梅素(C8-DHM)和3-O-月桂酰化二氢杨梅素(C12-DHM)。
1.3.2 H2O2损伤浓度确定 在96孔板中培养(7×103个/孔,100 μL)24 h,将细胞分成2组,一组加入100 μL 不完全培养基(含1%双抗但不含FBS),另一组加入100 μL含H2O2(200,300,400,500,600 μmol/L)的培养基。孵育4 h后,按照MTT试剂盒说明书检测细胞增殖情况。选择细胞存活率在50%左右的H2O2浓度构建肝细胞氧化损伤模型。
1.3.3 肝细胞氧化损伤模型建立 将L02细胞分为损伤组、保护组和对照组,置于96孔板中培养(1×104个/孔,100 μL) 24 h。随后往保护组加入100 μL含DHM或DHM衍生物(3.25,7.50,15.00,30.00 μmol/L)的培养基,对照组和损伤组中加入100 μL不完全培养基,孵育24 h。孵育结束后,保护组和损伤组中均加入100 μL含适宜损伤浓度H2O2的培养基,对照组中加入同等体积的不完全培养基,孵育4 h,按照MTT试剂盒说明书检测各组细胞增值情况。选择细胞存活率最高的样品浓度作为最佳保护浓度。同时,选择槲皮素做为阳性对照。
1.3.4 DHM及其衍生物对细胞内氧化损伤相关理化指标的影响
(1) ROS、LDH、MDA、CAT、MDA、SOD和GSH-PX:在6孔板中培养L02细胞(3×105个/孔,2 mL) 24 h,保护组中加入2 mL含最佳浓度样品的培养基,对照组和损伤组加入同等体积的不完全培养基,孵育24 h后,损伤组和保护组加入2 mL含H2O2(400 μmol/L)的培养基,对照组加入同等体积的不完全培养基,再孵育4 h 后吸去上清,PBS清洗两遍。按照相应的试剂盒说明书检测培养基中ROS、LDH、MDA、CAT、MDA、SOD和GSH-PX水平,用倒置荧光显微镜拍照。
(2) 线粒体膜电位:在6孔板中培养L02细胞(3×105个/孔,2 mL) 24 h,保护组中加入2 mL含最佳浓度样品的培养基,损伤组和对照组中加入同等体积的不完全培养基,继续孵育24 h后,保护组和损伤组中加入2 mL 含损伤浓度适宜的H2O2培养基,对照组中加入同等体积的不完全培养基,再孵育4 h后,加入含有1% PMSF的RIPA裂解液处理30 min,用移液枪吸取裂解液至离心管中,离心(15 000 r/min)得上清液。按照线粒体膜电位试剂盒说明书进行检测,使用荧光倒置显微镜进行拍照。
(3) Caspase 3:试验步骤参照1.2.4,并按试剂盒说明书测定Caspase 3相对活性水平。
1.3.5 数据分析 使用Microsoft Excel和Origin 2018处理数据和绘图,并使用IBM SPSS Statistics 22进行显著性分析(P<0.05),所有试验均重复3次。
2 结果与分析
2.1 过氧化氢损伤浓度
由图1可知,在200~600 μmol/L的浓度范围内,相同的孵育时间下,随着H2O2浓度的增大,细胞存活率逐渐下降。一般情况下,选择细胞存活率在50%左右的浓度或者孵育时间构建细胞氧化损伤模型[9],因此,选择浓度400 μmol/L的H2O2建模,在此浓度下孵育4 h细胞存活率约为45%。

小写字母不同表示差异显著(P<0.05)
2.2 DHM及其衍生物浓度对氧化损伤肝细胞的保护作用
由图2可知,在3.25,7.50 μmol/L浓度下,DHM及其衍生物处理组的细胞存活率均低于槲皮素处理组;而在15,30 μmol/L浓度下,C8-DHM处理组的细胞存活率高于槲皮素处理组,而其他衍生物包括DHM处理组的细胞存活率低于槲皮素处理组,这表明,在此浓度下,C8-DHM对肝细胞氧化损伤的保护效果高于槲皮素。在3.25~30.00 μmol/L的浓度范围内,DHM及其衍生物处理组的细胞存活率均高于损伤组,且随着浓度的增大,DHM和C2-DHM处理组的细胞存活率逐渐升高;其他衍生物处理组的细胞存活率则先升高后降低。在15 μmol/L时各组的细胞存活率最高,其中C8-DHM处理组的细胞存活率最高,达到了88.81%,即C8-DHM对细胞氧化损伤的保护效果最为明显。随着亲脂性的提高,DHM衍生物更容易与细胞膜结合并穿过细胞膜,进而参与到细胞内的自由基产生的反应过程中发挥活性,起到保护肝细胞、提高细胞活力的作用;而当取代碳链达到一定长度后,空间位阻增大,阻碍衍生物进入细胞内部且限制其与自由基的接触,从而影响了活性的发挥。

图2 DHM及其衍生物对L02细胞氧化损伤模型的保护作用
2.3 DHM及其衍生物对细胞内ROS水平的影响
采用DCFH-DA荧光探针法检测ROS水平,以DCF荧光图像中绿色强弱作为评判。荧光图像中绿色荧光强度越弱表示ROS水平越低,反之则表示ROS水平越高[10]。荧光结果为对照组的图像中几乎无绿色荧光,而H2O2损伤组的绿色荧光强度明显增强,可见损伤组的细胞被H2O2刺激后产生并累积了过量的ROS;相较于损伤组,DHM及其衍生物处理组的荧光强度明显减弱,表明DHM及其衍生物均能抑制细胞内ROS的产生。当取代碳链长度从C0增加到C8时,细胞内的荧光强度越来越弱,ROS水平逐渐降低;取代碳链长度从C8增加到C12时,细胞内的荧光强度稍有增强,ROS水平提高。
2.4 DHM及其衍生物对细胞LDH释放的影响
由图3可知,与损伤组相比,DHM及其衍生物处理组细胞培养液中的LDH水平明显下降(P<0.05),且随着取代碳链长度的增长,细胞胞外LDH的活性呈先降低后升高的趋势,其中,C8-DHM处理组细胞培养液中LDH的活性最低,降到了384.56 U/L。综上,DHM及其衍生物可以通过保护细胞膜以提高细胞活力,其中,C8-DHM的效果最好。
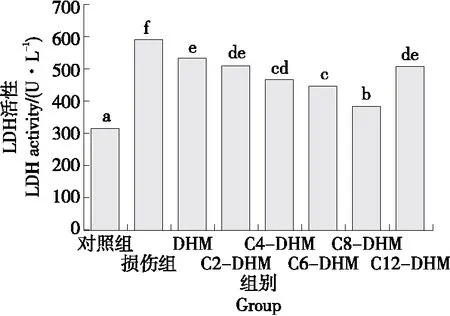
小写字母不同表示差异显著(P<0.05)
2.5 DHM及其衍生物对MDA水平的影响
由图4可知,与损伤组相比,DHM及其衍生物处理组的MDA水平显著降低(P<0.05),除C2-DHM处理组外,其余衍生物处理组的MDA水平均低于DHM处理组,可见,亲脂性的提高可以使DHM更容易进入细胞内阻止过氧化反应的发生,从而避免细胞的损伤,其中C6-DHM和C8-DHM的效果最好。
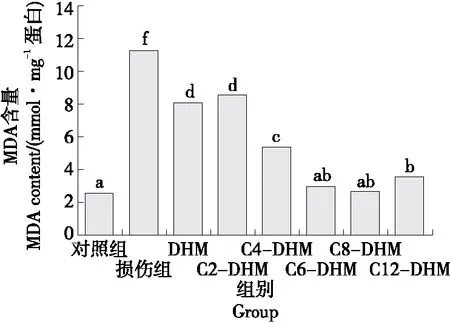
小写字母不同表示差异显著(P<0.05)
2.6 DHM及其衍生物对细胞中抗氧化酶系的影响
由图5可知,相较于H2O2损伤组,DHM及其衍生物处理组的SOD、GSH-PX和CAT活力均有所提高;衍生物处理组中,除C12-DHM外,其余衍生处理组的3种抗氧化酶的活力均高于DHM处理组。总体上看,随着取代碳链的延长,3种抗氧化酶的活力呈先升高后降低的趋势,C8-DHM对3种抗氧化酶活力的提高效果最为明显。因此,DHM及其衍生物对细胞内ROS的清除能力与细胞内的抗氧化酶系有关,而亲脂性一定程度的提高有利于DHM进入细胞上调相关的抗氧化酶活力。

小写字母不同表示差异显著(P<0.05)
2.7 DHM及其衍生物对线粒体膜电位的影响
通过JC-1荧光探针检测的红绿荧光变化可评估线粒体膜电位的下降程度。由荧光结果可知,相比于对照组,损伤组基本上整体呈现绿色荧光,表明其线粒体膜电位显著降低;相较于损伤组,DHM及其衍生物组的红色荧光程度增强,而且衍生物处理组的红色荧光程度高于DHM处理组,表明DHM及其衍生物能够抑制线粒体膜电位的下降,且衍生物组的细胞线粒体膜电位高于DHM处理组,其中,经C8-DHM处理的细胞图像中几乎无绿色荧光,表明其能显著抑制线粒体膜电位的下降,从而阻止早期的细胞凋亡。
2.8 DHM及其衍生物对Caspase 3水平的影响
由图6可知,Caspase活性相对水平依次为对照组≈DHM处理组>C2-DHM处理组>C12-DHM处理组>C4-DHM处理组>C6-DHM处理组≈C8-DHM处理组>空白组,5种衍生物处理组的Caspase 3相对活性水平显著低于DHM处理组,其中C6-DHM和C8-DHM处理组的Caspase 3相对活性水平最低,表明中等链长的亲脂性衍生物可显著增强DHM抑制Caspase 3活性的能力。

小写字母不同表示差异显著(P<0.05)
3 结论
通过构建L02细胞过氧化氢损伤模型,考察了二氢杨梅素及其衍生物对肝细胞损伤的保护效果。除3-O-月桂酰化二氢杨梅素(C12-DHM)外,其余衍生物处理组对L02细胞的保护作用均高于DHM,DHM衍生物能通过调节细胞内的抗氧化通路减少活性氧的产生和积累,其中3-O-辛酰化二氢杨梅素(C8-DHM)对L02细胞氧化损伤的保护效果最为显著。关于二氢杨梅素及其衍生物对细胞氧化损伤的保护作用机制只探讨了线粒体通路中的关键位点,接下来会进一步考察对其他通路如内质网通路、死亡受体通路等的影响。
