高效液相色谱法测定橙汁中酸性大红GR的不确定度评定
2022-07-08杨丽霞崔晓娇吴后吕
袁 圆 曾 辉 肖 艳 杨丽霞 崔晓娇 杨 韵 吴后吕
(1. 长沙市食品药品检验所,湖南 长沙 410036;2. 国家酒类产品质量检验检测中心〔湖南〕,湖南 长沙 410036;3. 湖南国际旅行卫生保健中心〔长沙海关口岸门诊部〕,湖南 长沙 410011)
酸性大红GR又名酸性红73,为黄光红色粉末,属于偶氮类生物染色剂,溶于水、乙醇和乙二醇乙醚,不溶于大多数有机溶剂,主要用于毛丝织物、皮革和纸张的染色,还可用于塑料、木材和水泥等的着色[1-4]。酸性大红GR是一种强致癌物,为食品禁用色素[5-6]。由于酸性大红GR具有水溶性好、颜色鲜艳、固色能力强和价格低廉等优点,有不法经营者为了美化食品的外观,将其充当食用色素添加到食品中。2021年7月28日,国家市场监管总局发布的《食品中酸性大红GR的测定》[7]等4项食品补充检验方法的公告(2021年第28号),为检测食品中违法添加酸性大红GR提供了有力的技术支撑。
不确定度是表征合理赋予被测量值的分散性,与测量结果相联系的参数[8-10]。当检测结果能提供不确定度数值时可以很大程度提高测量结果的准确性[11-12]。研究拟参照BJS 202107《食品中酸性大红GR的测定》中的液相色谱法测定自制阳性橙汁中酸性大红GR含量(定量限为1.5 mg/kg),依据JJF 1059.1—2012《测量不确定度评定与表示》,对检测过程中的不确定度来源进行分析,以期为高效液相色谱法检测橙汁等复杂基质中酸性大红GR含量的测量及结果判定提供依据。
1 材料与方法
1.1 材料与试剂
酸性大红GR标准品:纯度98.8%,北京曼哈格生物科技有限公司;
甲酸:色谱纯,阿拉丁试剂(上海)有限公司;
甲醇:色谱纯,德国默克化工公司;
乙酸铵、无水乙醇、氨水、柠檬酸、乙酸:分析纯,国药集团化学试剂有限公司;
橙汁:市售;
阳性橙汁:实验室制备。
1.2 仪器和设备
高效液相色谱仪:Waters Alliance e2695型,配2998PDA检测器,美国沃特世公司;
超纯水仪:Milli-Q型,美国密理博公司;
电子天平:XS205DU型,梅特勒—托利多国际贸易(上海)有限公司;
离心机:ST16R型,赛默飞世尔科技(中国)有限公司;
氮吹仪:N-ECAP45型,美国Organomation公司;
固相萃取装置:HSE-24B型,天津市恒奥科技发展有限公司。
1.3 试验方法
1.3.1 样品处理 依据BJS 202107《食品中酸性大红GR的测定》进行样品处理。
(1) 样品提取:精确称取2.0 g(精确到0.000 01 g)样品于50 mL离心管中,用移液器移取10 mL无水乙醇—氨水—水(V无水乙醇∶V氨水∶V水=7∶2∶1)溶液加入到样品中,摇匀后超声5 min,以8 000 r/min的速度离心5 min,将上清液转移至50 mL离心管中。重复上述步骤提取2次,合并提取液,于60 ℃水浴下用氮气吹至5 mL以下。用柠檬酸溶液调节pH至3.0~4.0。
(2) 样品净化:加少许水将1 g聚酰胺粉调成糊状,倒入提取液中搅拌均匀后再倒入G3垂熔漏斗中抽滤,依次用60 ℃ pH 4的水、甲醇—甲酸(V甲醇∶V甲酸=6∶4)溶液和水洗涤容器、垂熔漏斗3~5次,直到洗出的水溶液pH为中性后,再用无水乙醇—氨水水(V无水乙醇∶V氨水∶V水=7∶2∶1)溶液洗涤3~5次,至吸附的色素完全解吸后,收集全部解吸液至离心管,用乙酸调节pH直至中性,于60 ℃水浴下氮吹至近干,加入甲醇—水(V甲醇∶V水=6∶4)溶液溶解,定容至5 mL后涡旋混匀,用0.45 μm 尼龙膜过滤,滤液供高效液相色谱分析测定。
1.3.2 色谱条件 色谱柱:Agilent TC-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇—0.01 mol/L乙酸铵(V甲醇∶V乙酸铵=60∶40);流速1.0 mL/min;柱温35 ℃;检测波长512 nm;进样量20 μL。
1.3.3 标准溶液的配制
(1) 标准储备液:精确称取0.025 34 g酸性大红GR标准品溶于水中,定容至25 mL A级容量瓶中,得到1.00 mg/mL标准储备液。
(2) 标准中间液:用移液管(A级)准确移取2.00 mL标准储备液于100 mL容量瓶(A级)中,用水定容,得到20.0 μg/mL标准中间液。
(3) 标准工作液:用移液管(A级)分别准确移取标准中间液0.10,0.25,0.50,2.50,5.00,10.00 mL于10 mL容量瓶(A级)中,用水稀释定容,得到质量浓度分别为0.2,0.5,1.0,5.0,10.0,20.0 μg/mL的标准工作液。
2 结果分析
2.1 数学模型
橙汁中酸性大红GR含量按式(1)计算:
(1)
式中:
X——试样中酸性大红GR含量,mg/kg;
v——试样定容体积,mL;
c——测定试液中酸性大红GR的质量浓度,μg/mL;
c0——空白试液中酸性大红GR的质量浓度,μg/mL;
m——试样质量,g;
1 000——单位换算系数。
2.2 不确定度来源分析
通过对检测过程和数学模型分析得出,高效液相色谱法测定橙汁中酸性大红GR不确定度来源如图1所示。
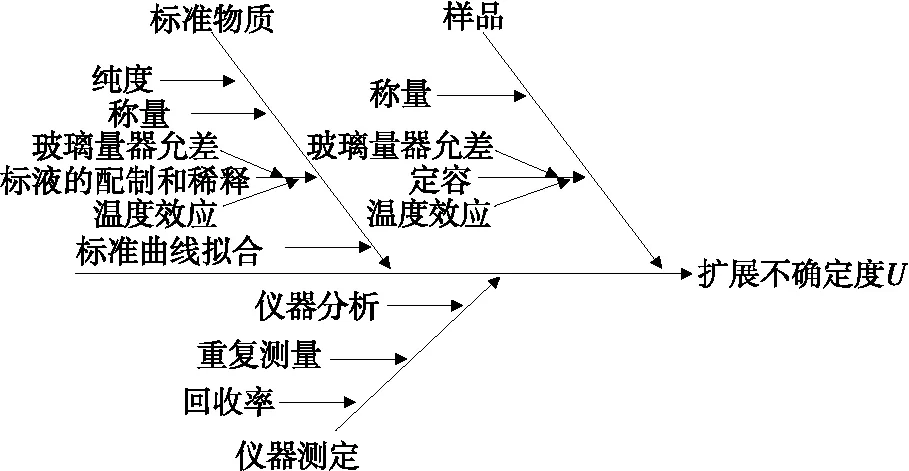
图1 不确定度来源分析图
2.3 不确定度的评定


2.3.3 标准系列溶液配制引入的不确定度urel(std1)

(2) 配制标准系列溶液需使用3支1 mL A级移液管,1支2 mL A级移液管,2支5 mL A级移液管,5个10 mL A级容量瓶,1个100 mL A级容量瓶,计算得出各量具引入的相对不确定度见表1,配置标准系列溶液引入的相对不确定度urel(c)按式(2)计算,结果见表2。
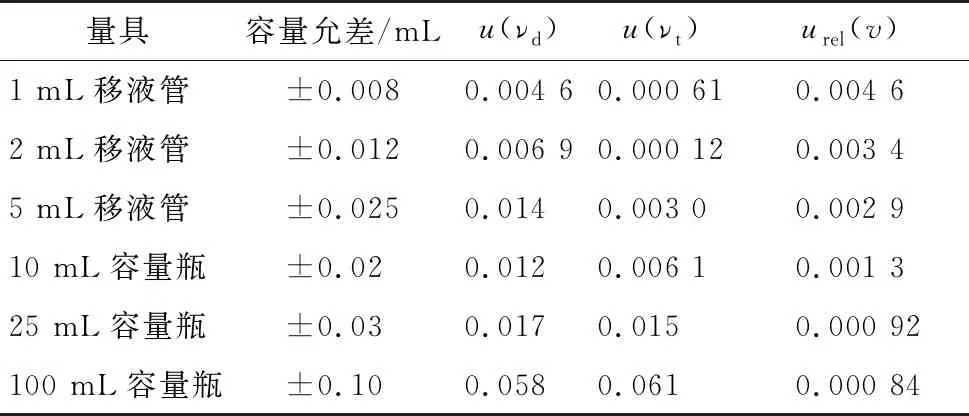
表1 各量具引入的不确定度
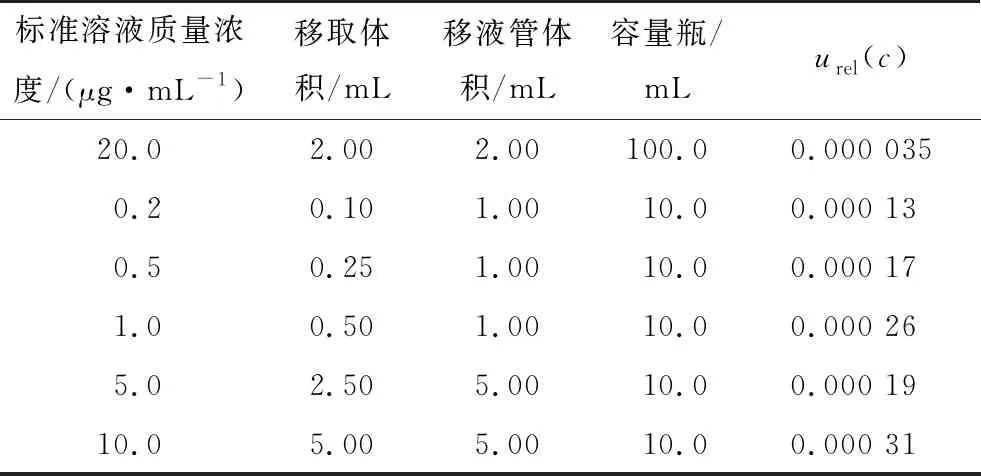
表2 配制标准系列溶液引入的相对不确定度
(2)
式中:
urel(c)——配置标准系列溶液引入的不确定度;
urel(v1)——移液管引入的相对不确定度;
v2——移液管移取的体积,mL;
v3——移液管的体积,μg/mL;
urel(v4)——容量瓶引入的相对不确定度;
10——容量瓶的体积,mL。
通过式(2),可以得出标准系列各浓度引入的不确定度的详细过程。
因此,标准系列溶液配制引入的相对标准不确定度为:
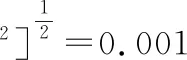
2.3.4 标准曲线拟合引入的不确定度urel(std2) 标准曲线各浓度分别为0.2,0.5,1.0,5.0,10.0,20.0 μg/mL,对标准曲线的每个浓度点重复分析3次,用最小二乘法对标准曲线各浓度与峰面积进行拟合,得到线性回归方程见表3。通过式(3)计算得出残差标准差s为2 274.98。样品平行测定7次,测得样液平均浓度C0=0.586 8,定容体积为5.0 mL,将各数值代入式(1),计算得出试样中酸性红含量为1.46 mg/kg,再由式(4)求得拟合标准曲线得出的标准不确定度为0.021。

表3 线性回归方程
(3)
(4)
式中:
Aj——第i个标准溶液的第j次计数值;
B1——标准曲线的斜率,53 154.78;
B0——截距,1 386.48;
Ci——第i个标准溶液的质量浓度,μg/mL;
C0——样品的平均质量浓度,0.586 7 μg/mL;

S——工作液峰面积残差的标准差,2 274.98;
P——样品的测量次数,7;
n——标准曲线各点的测量次数,18;
urel(std2)——标准曲线引入的标准不确定度。
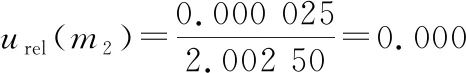
2.3.6 样液的定容引入的相对标准不确定度urel(νd)
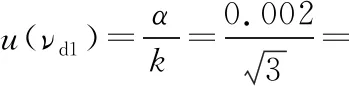

2.3.8 重复测定样品引入的相对不确定度urel(X) 取被测样品重复检测7次(n=7),按式(5)和式(6)计算,得出样品中酸性大红GR含量、重复测定的标准偏差、相对标准不确定度见表4。

表4 重复测定引入的不确定度
(5)
(6)
式中:
Xi——酸性大红GR第i次测量的含量,mg/kg;

n——测量次数,7;
s(X)——重复测定的标准偏差;
urel(X)——重复测定引入的相对不确定度。
2.3.9 样品回收率引入的相对不确定度urel(R) 对空白试样进行添加量为3.0 mg/kg的加标试验(n=7),按式(7)、式(8)和式(9)计算,得出酸性大红GR的回收率引入相对标准不确定度见表5。
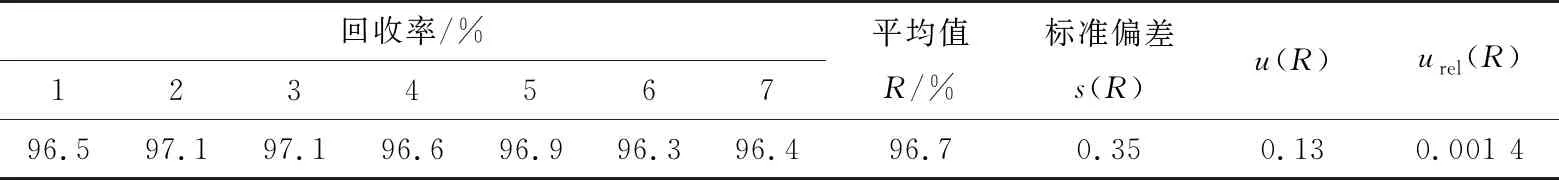
表5 样品回收率引入的不确定度
(7)
(8)
(9)
式中:
Ri——酸性大红GR第i次测量的回收率,%;

n——测量次数,7;
s(R)——回收率的标准偏差;
u(R)——回收率引入的不确定度;
urel(R)——回收率引入的相对不确定度。

2.3.10 合成相对标准不确定度urel根据式(10)合成各分量得到:urel=0.038。
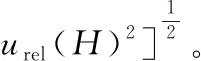
(10)
2.3.11 扩展不确定度 该测量误差的分布类型属正态分布,在置信水平为95%时,取k=2。扩展不确定度U=urel×k×X=0.038×2×1.46=0.11。
2.3.12 不确定度评定结果 采用高效液相色谱法测定橙汁中酸性大红GR含量,检测结果表示为X=(1.46±0.11) mg/kg (k=2)。
3 结论
研究所用自制阳性橙汁样品中酸性大红GR含量的检测结果为X=(1.46±0.11) mg/kg (k=2),通过建立数学模型,对高效液相色谱法测定橙汁中酸性大红GR含量可能引入的不确定度分量进行评定。评定结果表明,标准物质的纯度、标准曲线拟合和高效色谱仪分析引入的不确定度为测定过程中不确定度的主要来源。在实际检测中可以通过提高标准品纯度、控制标准曲线校准过程和定期对仪器进行维护保养,来减小测量结果的不确定度,从而提高检测结果的准确度。
