基于美国FAERS数据库的拉米夫定妊娠相关不良反应信号挖掘研究
2022-07-08杨仁君殷诺雅李丹丹FrancescoFaiola首都医科大学附属北京友谊医院药学部北京00050中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室北京00085中国科学院大学资源与环境学院北京00049
张 杨,杨仁君,殷诺雅,赵 莹,李丹丹,Francesco Faiola(.首都医科大学附属北京友谊医院药学部,北京 00050;2.中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室,北京 00085;.中国科学院大学资源与环境学院,北京 00049)
抗病毒治疗是慢性乙型肝炎(乙肝)病毒(hepatitis B virus,HBV)感染的重要治疗手段,其中,核苷(酸)类似物(nucleoside/nucleotide analogues,NAs)是目前临床最常用的治疗药物,包括拉米夫定、阿德福韦酯、恩替卡韦、替比夫定、替诺福韦酯以及丙酚替诺福韦[1]。慢性HBV感染在中国发病率高,感染者多达9300万人,其中,育龄女性HBV的感染率为6% ~ 8%[2-3]。目前尚未有NAs被批准用于妊娠期女性,然而临床不可回避的问题是育龄期女性在妊娠期可能需要使用NAs抗HBV治疗,使用NAs治疗的女性也可能出现意外怀孕。目前,对于妊娠期乙肝活动期患者,中国、美国和加拿大相关领域权威指南推荐可使用替诺福韦酯、替比夫定或拉米夫定[3-4],然而亚太肝病学会相关指南仅推荐替诺福韦酯和替比夫定,未推荐拉米夫定[5]。
基于真实世界数据库开展药物或疫苗安全性研究为近年来的研究热点[6-9]。笔者拟利用美国FDA不良事件报告系统(FDA adverse event reporting system,FAERS)对拉米夫定妊娠相关不良反应信号进行挖掘研究。为了减少不同疾病因素对目标不良事件可能产生的潜在影响,本研究选择了同属于NAs类药物、具有相同适应证且目前认为妊娠期安全性相对较高的替诺福韦酯作为对照药物[10-12],探索拉米夫定妊娠相关不良反应的风险信号,以期为该药在临床的安全应用提供参考。
1 资料与方法
1.1 资料来源
收集FAERS数据库中2004年第1季度 - 2021年第1季度共69个季度的数据,该数据以美国信息交换标准码(American standard code for information interchange,ASCII)或可扩展标示语言(xtensible markup language,XML)形式存储。包含的内容有:人口统计学资料、药物使用信息(药物名称、剂量、治疗起始时间)、用药原因、不良反应事件、事件结果、报告来源(医务人员、患者、生产厂家等)。
1.2 数据提取与处理
将原始数据导入R软件,以拉米夫定或替诺福韦酯的通用名和商品名为检索词进行查询,按文献[13]报道的方法剔除重复报告,排除含拉米夫定或替诺福韦酯的复方制剂相关报告,得到以拉米夫定或替诺福韦酯单药为首要怀疑药物的不良反应报告。采用国际医学用语词典(medical dictionary for regulatory activities,MedDRA)中药物不良反应术语集的系统器官分类(system organ class,SOC)和首选术语(preferred terms,PT)进行编码,其中SOC为不良事件的分类,PT为不良事件的标准名称。仅纳入SOC分类属于“pregnancy、puerperium and perinatal conditions”的报告,同时剔除哺乳期女性和育龄期男性相关的报告,进而获得妊娠期相关不良反应报告。为了减少药物和不良反应因果关系判断的潜在偏倚,本研究仅纳入医务人员(医师、药师及其他医务人员)上报的报告。
1.3 目标不良事件
根据MedDRA中PT对不良反应报告进行分类,本研究的目标不良事件包括:流产、自然流产、早产、低出生体重、死产和胎儿死亡、胎儿并发症。
1.4 目标药物与对照药物
本研究中,拉米夫定为目标药物,同属于NAs类药物、具有相同适应证且目前认为妊娠期安全性相对较高的替诺福韦酯作为对照药物[11-12],分别从三个方面进行比较。首先,将拉米夫定与替诺福韦的目标不良事件进行总体比较。其次,为了减少不同疾病因素对不良事件可能产生的潜在影响,分别在HBV和人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染人群进行了亚组分析,探索拉米夫定妊娠相关不良反应的风险信号。
1.5 数据统计分析
采用报告比值比(reporting odds ratio,ROR)法挖掘相关不良反应风险信号。ROR及其95%置信区间(confidence interval,CI)的计算均基于比例失衡测量法的四格表[7]。本研究中目标药物相关风险信号的检测阈值设定为:不良反应报告数≥3,ROR > 2且其95%CI下限> 1[7]。ROR数值越大,风险信号越强,提示目标药物与目标不良反应之间的相关性越大[7]。若ROR < 2,表明目标药物和目标不良反应之间的相关性不具有明显的统计学意义。使用R软件和Stata 12.0对相关数据进行统计学处理与分析。
2 结果
2.1 不良事件报告总体情况
2004年第1季度 - 2021年第1季度FAERS数据库中由医务人员上报的妊娠期不良反应报告共1 286 367例。如表1所示,筛选出以拉米夫定为首要怀疑药物的妊娠期不良反应报告4364例;以替诺福韦酯为首要怀疑药物的妊娠期不良反应报告3750例。根据用药适应证的不同,我们进一步在HBV人群和HIV人群进行了亚组分析。在HBV人群中,筛选出以拉米夫定为首要怀疑药物的妊娠期不良反应报告413例,以替诺福韦酯为首要怀疑药物的妊娠期不良反应报告840例。在HIV人群中,筛选出以拉米夫定为首要怀疑药物的妊娠期不良反应报告2659例,以替诺福韦酯为首要怀疑药物的妊娠期不良反应报告1799例。受限于FAERS数据库自发呈报系统的缺点,每一份不良事件报告的完整程度均有差异,部分报告未上报具体适应证。
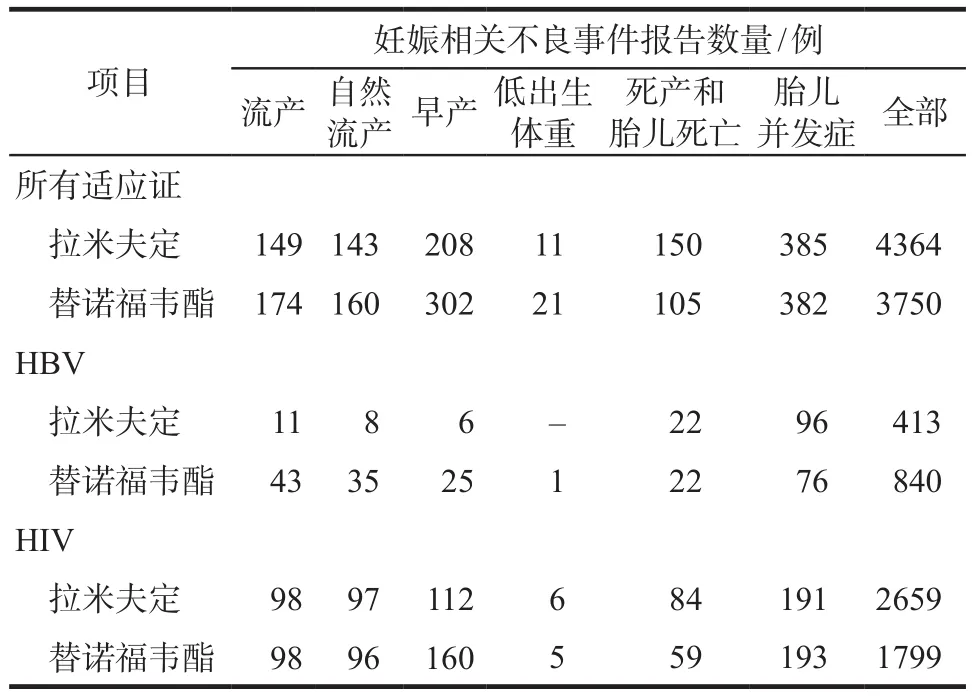
表1 FAERS数据库中拉米夫定和替诺福韦酯妊娠相关不良事件报告Tab 1 Adverse events reports of lamivudine and tenofovir dipivoxil in FAERS database
2.2 不良反应信号分析
2.2.1 所有适应证 与替诺福韦酯相比,拉米夫定妊娠相关不良反应报告的比例并未见明显升高。本研究中目标不良事件(流产、自然流产、早产、低出生体重、死产和胎儿死亡、胎儿并发症)的ROR值见图1。就本研究的目标不良事件风险信号而言,拉米夫定和替诺福韦酯之间未见明显统计学差异。
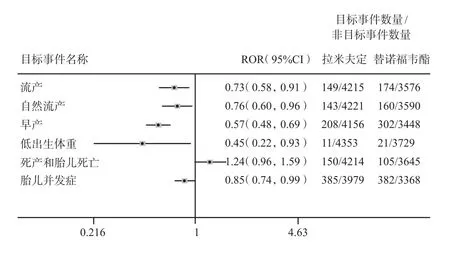
图1 替诺福韦酯和拉米夫定妊娠相关不良反应风险信号Fig 1 Risk signals of adverse reaction of tenofovir dipivoxil and lamivudine
2.2.2 HBV适应证亚组分析 为了减少不同疾病因素对妊娠相关不良事件可能产生的潜在影响,进一步在HBV人群中进行了亚组分析,如图2所示,根据ROR和95%CI结果显示,与替诺福韦酯相比,对于目标不良事件流产、自然流产和早产,拉米夫定未见风险信号增加;对于目标不良事件死产和胎儿死亡、胎儿并发症,相较于替诺福韦酯,拉米夫定的风险信号呈阳性,对应不良事件ROR值分别为2.09(95%CI:1.14 ~ 3.82)和3.04(95%CI:2.19 ~ 4.23)。由此可见,与替诺福韦酯相比,拉米夫定在HBV人群中所致的死产和胎儿死亡、胎儿并发症方面的风险信号显著增加,数据差异具有统计学意义。
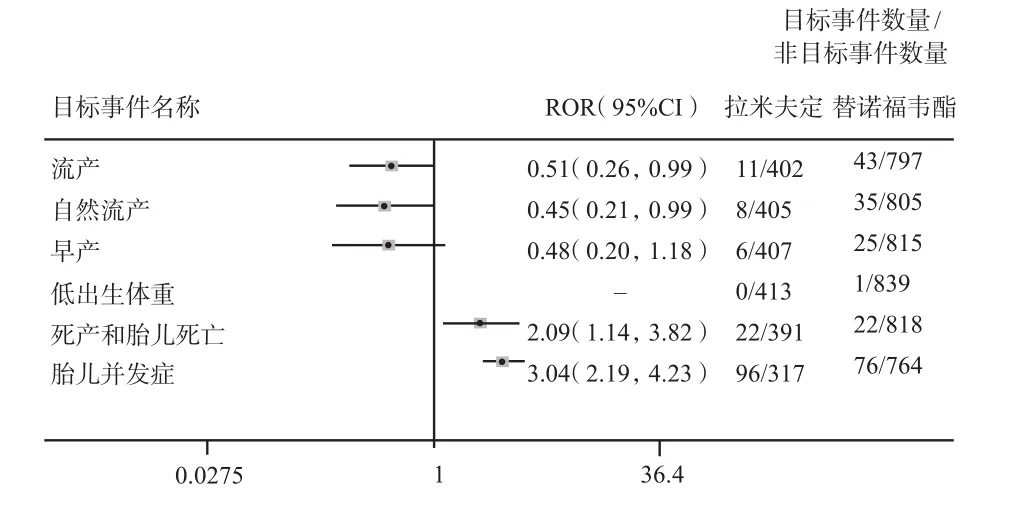
图2 HBV人群中拉米夫定和替诺福韦酯妊娠相关不良反应风险信号Fig 2 Risk signals of adverse reaction of lamivudine and tenofovir dipivoxil in patients with HBV infection
2.2.3 HIV适应证亚组分析 为了减少不同疾病因素对妊娠相关不良事件可能产生的潜在影响,笔者在HIV人群中同样进行了亚组分析,根据ROR和95%CI结果显示,与替诺福韦酯相比,对于目标不良事件流产、自然流产、早产、死产和胎儿死亡、胎儿并发症,拉米夫定并未见风险信号的增加,见图3。因此,就本研究的目标不良事件风险信号而言,在HIV人群中,拉米夫定和替诺福韦酯之间未见明显统计学差异。
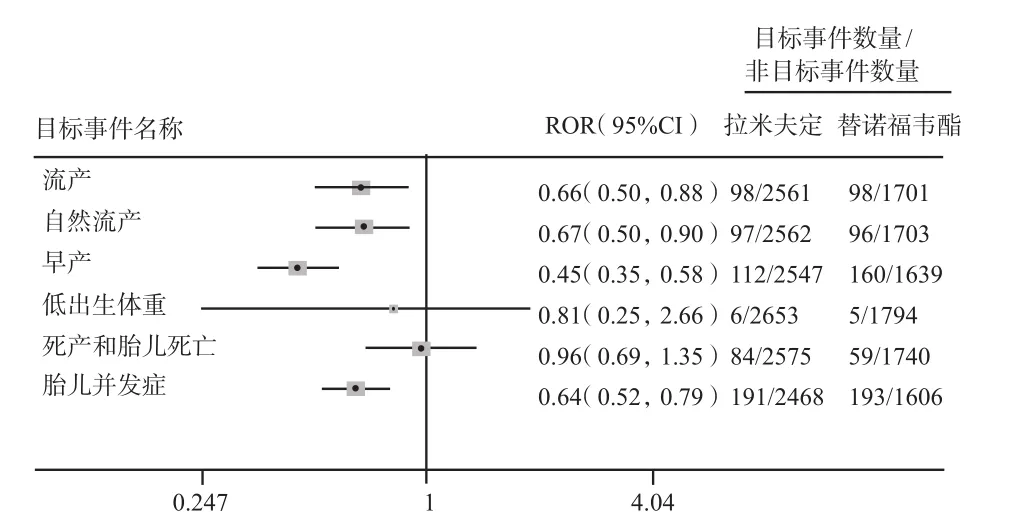
图3 HIV人群中拉米夫定和替诺福韦酯妊娠相关不良反应风险信号Fig 3 Risk signals of adverse reaction of lamivudine and tenofovir dipivoxil in patients with HIV infection
3 讨论
目前,FAERS数据库是全球最大的自发性呈报和公开可用的药物不良事件数据库,医务人员(医师、药师及其他医务人员)和非医疗相关专业人士(患者、生产厂家等)均可上报[7]。基于FAERS的数据分析不仅可用于挖掘药品上市前临床试验中未被发现的不良反应,还可最大程度保护患者免受药物相关性伤害[14-16]。
一般来说,在妊娠期乙肝女性中使用NAs抗病毒治疗须充分权衡药物对母体和胎儿的风险和受益情况。现有研究[17-18]显示,与未用药的对照组相比,孕期乙肝女性使用替诺福韦酯或拉米夫定均不会增加流产、早产、低出生体重、胎儿畸形、胎儿死亡等妊娠不良事件的发生率。然而,小规模临床研究由于样本量太小不足以阐明药物安全性问题。本研究结果显示拉米夫定在HBV人群中所致的死产和胎儿死亡、胎儿并发症方面的风险信号较替诺福韦酯显著增加,但该风险信号还有待于临床研究验证,目前没有明确的队列研究表明拉米夫定在妊娠期乙肝患者中的安全性与替诺福韦酯相比有显著性差异[17-18]。此外,与替诺福韦酯相比,拉米夫定在HBV人群、HIV人群中的风险信号均表现出了一定的差异,这表明疾病因素和临床异质性可能是影响妊娠期用药安全性的潜在混杂因素。
本研究的优势体现在:①纳入了FAERS数据库超过17年的真实世界数据,样本量大且收集的数据来自世界各地,较常规前瞻性临床研究评价药物安全性具有显著优势;②受限于伦理因素,通常无法直接在人体上开展药物妊娠期安全性的大规模临床试验。基于FAERS数据库开展真实世界药物妊娠相关不良反应信号挖掘可以在一定程度上起到弥补作用;③虽然美国妊娠期抗病毒治疗注册中心报告了许多NAs妊娠相关不良事件,但并没有收集“流产”等相关事件[19];而关于NAs妊娠期安全性的部分前瞻性研究中,“早期流产”经常被遗漏,因为女性只在成功怀孕时才能被纳入相关研究,孕早期若出现流产等情况往往会被剔除。而FAERS数据库纳入了包括流产、早期流产、先兆流产和人工流产等诸多流产相关妊娠不良事件,可以更全面评估药物所致流产等不良事件的发生情况。
本研究的局限性在于:①FAERS自身存在诸如数据缺失、数据误报、重复上报、漏报和选择性上报等多种局限性,这可能会影响数据质量[7];②由于缺乏药物使用总量的相关信息,FAERS也不能用于评估某种药物某一特定不良反应在真实世界的发生率;③FAERS并不要求上报病人的疾病严重程度,临床异质性的存在是一个潜在的混杂因素;④无法排除和评估合并症、合并用药的影响;⑤ROR法检测到的不良事件风险信号,只能表明目标药物与目标不良事件信号有统计学相关性,并不能代表两者在临床上有因果联系。
综上所述,本研究结果显示与替诺福韦酯相比,拉米夫定妊娠相关不良反应风险信号未见升高。但在HBV人群中,拉米夫定所致的死产和胎儿死亡、胎儿并发症风险信号较替诺福韦酯显著增加,而上述差异在HIV人群中并未观察到。这提示临床,妊娠期乙肝患者服用拉米夫定仍需加强监测,以避免严重不良反应的发生。虽然上述风险信号还有待于临床研究的验证,鉴于我国庞大的乙肝患者人群以及目前尚缺乏对两药妊娠期安全性的头对头系统性比较研究,基于FAERS的真实世界数据可为妊娠期乙肝患者个体化用药提供一定参考依据。
