生长季不同月份平茬对柠条人工林地土壤细菌群落特性的影响
2022-07-08田英许喆朱丽珍王俊温学飞
田英 ,许喆 ,朱丽珍 ,2,王俊 ,温学飞
(1. 宁夏大学农学院,宁夏 银川 750021;2. 宁夏林业研究院,宁夏 银川 750004;3. 宁夏农林科学院荒漠化治理研究所,宁夏 银川 750002;4. 宁夏防沙治沙与水土保持重点实验室,宁夏 银川 750002)
宁夏东部典型荒漠草原地处干旱与半干旱农牧交错区,生态环境脆弱,是宁夏重要的畜牧业生产基地,也是我国西北地区重要的生态建设区域。柠条(Caragana intermedia)是豆科(Leguminosae)锦鸡儿属(Caragana)植物栽培种的通称,其根系发达、抗逆性强,是荒漠草原地带典型的旱生植物[1-2]。我国实施退耕还林(草)工程以来,西北、华北、东北等地水土保持和固沙造林大面积人工种植柠条,取得了良好的防风固沙、水土保持、植被恢复生态效益[3]。柠条还具有良好的饲用价值。但是,随着林龄的增加,早期种植的柠条出现了不同程度的木质化,甚至死亡现象,必须进行平茬。平茬能够促进植株伐桩基部萌发大量枝条,发挥生殖补偿能力,促进柠条根系生长和更新复壮[4-5],是解决柠条早衰死亡的一项经济而有效的措施。有关柠条平茬的研究报道多集中在平茬措施对柠条的生长、产量、饲料营养成分、土壤水分与理化性质、土壤结构、林下植被多样性与恢复程度的影响,以及平茬复壮更新技术和设施设备等方面,而且平茬对柠条自身生长、土壤环境、植被多样性恢复的有益效果已经得到广泛肯定[6-8]。在土壤微生物方面,研究主要集中在不同立地环境、土壤类型、人工林种植密度对柠条林地土壤细菌、真菌等微生物群落结构和多样性的影响等方面[9-11],未见有关不同时间平茬柠条林地土壤微生物的研究报道。
随着现代分子生物技术的发展,有关土壤微生物群落结构、功能类群、土壤微生物与环境关系等研究越来越多[12-13]。Illumina 扩增测序的16S rRNA 基因技术可以检测出更高的微生物物种和多样性。但在平茬、刈割等措施对土壤微生物的影响方面的研究报道并不多,仅在草地生态系统中刈割与不刈割、不同刈割高度下植物和土壤微生物之间相互关系方面有少数报道[14-17]。土壤微生物群落结构和多样性的差异受到土地类型、养分含量、营造林措施、放牧、地上植被类型及生长等诸多环境因子和人为干扰的影响[18]。植物与环境是相互反馈的循环过程,平茬后柠条植株本身生长的差异会通过根系生长、分泌物释放等反馈于土壤,最为敏感的土壤微生物也必然会对这些变化做出响应[19]。因此,研究不同月份平茬对柠条人工林地土壤细菌的影响,对于评估柠条平茬的生态效果十分必要,同时也对研究人工林营建与管理措施对土壤微生物的影响等土壤微生态学研究有着重要的理论和实际意义。本试验采用Illumina Hiseq 高通量测序法,结合生物信息学技术,分析柠条生长季不同月份(4-10月)平茬对宁夏盐池荒漠草原人工柠条林地土壤细菌群落结构及多样性的影响,同时也为丰富宁夏荒漠草原人工柠条林地土壤微生物生态学研究,以及科学认识平茬对柠条人工林地土壤的影响提供参考依据。
1 材料与方法
1.1 试验区概况
试验区位于宁夏吴忠市盐池县花马池镇柳杨堡村荒漠草原(37°50′ N,107°19′ E)。地处毛乌素沙地南缘,与陕西省、内蒙古自治区接壤,是从沙地到荒漠草原到典型草原的过渡地带,也是鄂尔多斯高原到黄土高原的过渡地带,属典型的中温带大陆性气候,年均气温为7.6 ℃,年均降水量为290 mm,主要分布在7-9月,约占全年降水量的70%,年蒸发量为2132 mm,无霜期约162 d,年均风速2.08 m·s-1。土壤类型主要是灰钙土、黑垆土和风沙土,并伴有黄土和少量的盐土[5]。植被以荒漠草原旱生和中旱生植物为主,主要草本植物有:白草(Pennisetum centrasiaticum)、虫实(Corispermum mongolicum)、赖草(Leymus secalinus)、狗尾草(Setaria viridis)、牛枝子(Lespedeza davurieca)、阿 尔 泰 狗 娃 花(Heteropappus altaicu)、蒺 藜(Tribulus terrestris)、草 木 樨 状 黄 芪(Astragalus melilotoides)、披针叶黄华(Thermopsis lanceolata)等[7]。
1.2 试验设计与样品采集
试验区种植的柠条具体品种是中间锦鸡儿(C. intermedia),林龄25年。2017年选择地势较平坦、土壤、植被和生长状况一致的柠条人工灌木林及其林间草地作为研究样地,样地内的柠条种植方式统一为两行一带,带宽1 m,带间距8 m。于当年4-10月的每月中旬随机选择一带进行人工平茬,平茬方式为间隔平茬,隔一带平一带,留茬高度 5 cm,每个处理 3个重复。4-10月不同月份平茬处理分别对应编号 Y4、Y5、Y6、Y7、Y8、Y9、Y10。于2018年8月中旬,对不同月份平茬后的柠条人工林地土壤进行取样,每个处理重复3 次,各采样点距离50 m 以上,每个样点按照5 点取样法,取距离柠条植株5 cm 范围内0~30 cm 深度的土壤,四分法混合均匀后作为一个土壤样品,共计21个样品。将采集到的新鲜土样分成两份,一份立即去除植物根系、石块等杂质,过2 mm 筛后,用无菌土壤样品分装管进行分装,放入液氮罐带回实验室-80 ℃保存,用于土壤微生物高通量测序总DNA 提取;另一份塑封袋保存,带回实验室阴干,经过去杂过筛后避光保存,用于土壤理化性质测定。
1.3 土壤理化性质测定
参照鲍士旦[20]和鲁如坤的方法[21],略有调整。其中,采用烘干法测定土壤含水量。采用水土比2.5∶1 悬液,pH 计(梅特勒FE28Standard,瑞士)测定pH;采用水土比5∶1 浸提液,电导率仪(梅特勒S30K,瑞士)测定全盐含量;采用K2Cr2O7容量法测定有机质含量;采用凯氏定氮法测定全氮含量;采用NaOH 碱溶-钼锑抗比色法测定全磷含量;采用NaOH 熔融法-火焰光度计测定全钾含量;采用NaOH 碱解法测定速效氮含量;采用NaHCO3浸提-钼锑抗比色法测定速效磷含量;采用醋酸铵浸提液-火焰光度计测定速效钾含量。
1.4 土壤微生物总DNA 提取、测序及处理
采用土壤微生物基因组DNA 提取试剂盒(NucleoSpin 96 Soil Kit,Macherey-Nagel,德国)进行DNA 提取,琼脂糖凝胶电泳检测DNA 的纯度及浓度。利用特异性引物338F:5′-ACTCCTACGGGAGGCAGCA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′对细菌 16S rDNA 基因的 V3~V4 变异区域进行 PCR 扩增。PCR 参考Jia 等[22]的方法,略有改进,反应体系(50 μL)为:模板 DNA(10 ng)2 μL,10×PCR buffer(MG2+Plus)5 μL,DNTP(10 mmol·L-1)5 μL,Bar-PCR 引物 F(5 μmol·L-1)0.5 μL,引物 R(5 μmol·L-1)0.5 μL,Takapa Tap(5 U·μL-1)0.5 μL,灭菌双蒸水 36.5 μL。PCR 反应条件:95 ℃ 5 min、95 ℃ 30 s、50 ℃ 30 s、72 ℃ 40 s,共 30个循环,72 ℃4 min。将纯化质量合格、经过定量和均一化的PCR 产物用于DNA 文库构建,建库和测序,分析委托北京百迈客生物科技有限公司完成。测序完成后,根据Barcode 序列和PCR 扩增引物序列从得到的下机数据拆分出各样品数据,使用 Flash v. 1.2.7 软件对每个样品的reads 进行拼接,得到的拼接序列为原始Tags 数据[23],使用Trimmomatic v. 0.33 软件过滤,使用Uchime v. 4.2 软件鉴定并去除嵌合体序列,得到最终有效数据(effective tags)。使用Qiime v. 1.8.0 软件中的 Uclust 对Tags 在97% 的相似度水平下进行聚类、获得分类操作单元(operational taxonomic unit,OTU),并基于细菌(Silva)分类学数据库对OTU 进行分类学注释[24]。
1.5 数据分析
采用Excel 2010、SPSS 22.0 统计软件进行基本数据整理、采用One-way ANOVA 进行单因素方差分析、采用Duncan 法进行多重比较、α(Alpha)多样性指数与土壤理化因子的皮尔森(Pearson)相关性分析,显著水平为P=0.05。根据物种注释情况计算α 多样性与β(Bate)多样性,揭示不同分组处理下的细菌群落结构特征。α 多样性指标有 Chao1、Ace、香农(Shannon)和辛普森(Simpson)指数,采用 Mothur v.1.30 计算 α 多样性指数[25]。β 多样性是对不同样本的细菌群落构成进行比较。利用OTU 之间的系统发生关系,首先计算Unifrac 距离,再利用OTU 的丰度数据对Unifrac 距离构建Unweighted unifrac 距离,基于非加权Unifrac 距离的非度量多维尺度分析(non-matric multidimensional scaling,NMDS)比较不同样本间的差异。采用R 语言进行不同分组处理之间的细菌群落差异置换多元方差分析(permutational multivariate analysis of variance,Permanova),采用Canaco 5.0 软件进行土壤理化因子与细菌群落组成之间的冗余分析(redundancy analysis,RDA)。
2 结果与分析
2.1 土壤理化性质
不同月份平茬柠条林地土壤含水量、pH、有机质、全氮等10个理化指标具有一定差异(表1)。从土壤含水量来看,8月平茬显著高于5月平茬(P<0.05)。8月平茬的土壤有机质、全氮、全磷、全钾和速效氮的含量均较高,而速效钾含量显著低于4月和7月(P<0.05),速效磷含量显著低于4月(P<0.05),pH 也显著低于其他各月(P<0.05),但全盐含量最高。从土壤含水量来看,9月平茬处理最高,5月最低,达到显著差异水平(P<0.05),其余各月平茬处理之间无显著差异(P>0.05)。从土壤有机质含量来看,8月平茬处理最高,且显著高于4、5 和6月(P<0.05)。综合分析,8月平茬后柠条的恢复生长对土壤理化性质的影响较大。

表1 土壤理化性质比较Table 1 Comparison of soil physical and chemical properties
2.2 土壤细菌群落丰度与α 多样性
通过Illumina HiSeq 2500 高通量测序,所有样本共获得1455139 条序列,经过质控过滤和去除嵌合体后共产生1288309 条有效优质序列,经过聚类获得OTU,测序文库的覆盖度均达到了99.7%以上,说明测序土壤样本中绝大部分细菌序列被测出,测序结果可以表示土壤中细菌的真实存在情况。由表2 可知,不同平茬月份的土壤测序样本中检测到 OTU 数量以 8月最多,为 1869,9月最少,为 1728,其次较少的是 10月,为 1757,8月分别和 9、10月达到了显著差异水平(P<0.05),其他 4、5、6、7、8月各月平茬处理间土壤细菌 OTU 数量差异不显著(P>0.05)。
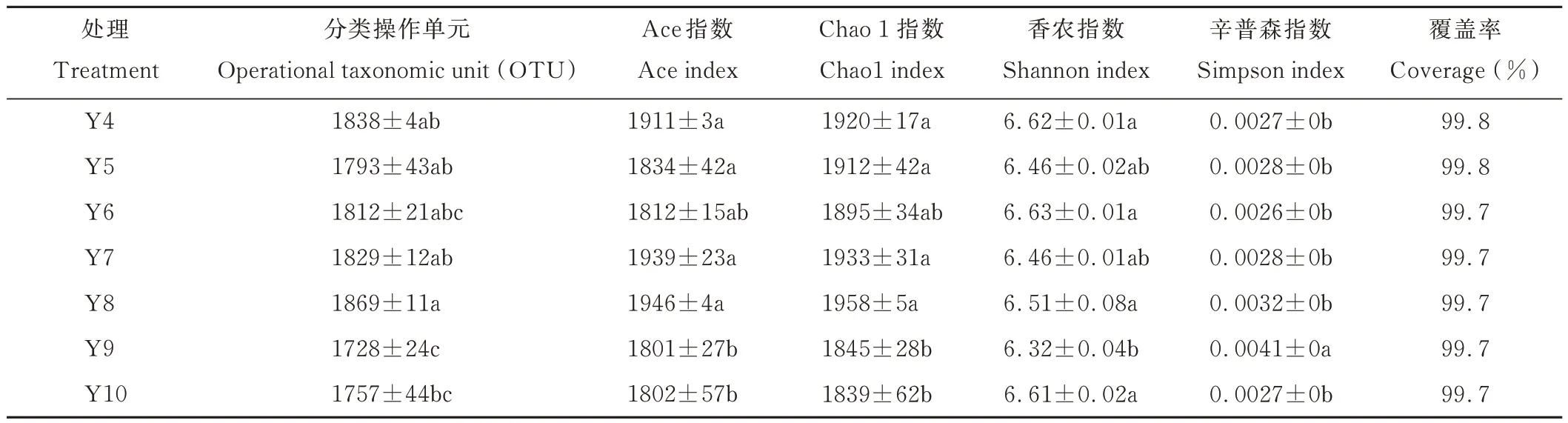
表2 土壤细菌α 多样性Table 2 α diversity of bacteria communities
α 多样性指数在不同月份平茬处理之间具有一定差异。8月平茬的土壤细菌群落的丰富度Chao1 指数和Ace指数最高,其次是7月>4月>5月>6月,但相互之间差异不显著(P>0.05);9 和10月平茬的土壤细菌群落丰富度 Chao1 和 Ace 指数较低,且与4、5、7、8月之间差异显著(P<0.05)。香农(Shannon)指数较高的为 4、6、10月,辛普森(Simpson)指数均较低,说明这3个月份平茬处理的土壤细菌群落多样性较高;9月平茬处理的香农(Shannon)指数显著低于4、6、8 和10月(P<0.05),且辛普森(Simpson)指数最高,显著高于其他各月(P<0.05),说明9月平茬处理的土壤细菌群落多样性最低。
土壤细菌α 多样性指数与理化因子Pearson 相关性分析结果表明,细菌OTU 与土壤全钾呈显著正相关关系(P<0.05),Ace 和Chao 1 指数与土壤全钾呈极显著正相关关系(P<0.01)。细菌 OTU、Ace、Chao 1、Simpson、Shannon 指数与其他指标间均无显著相关关系(表3)。
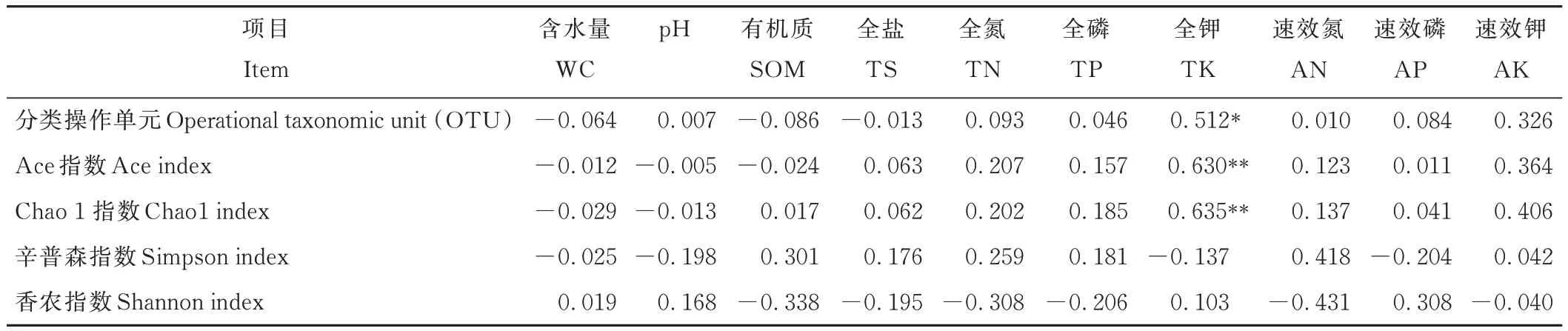
表3 土壤细菌α 多样性与土壤性质的相关性Table 3 Correlation between soil bacteria α diversity and soil properties
2.3 土壤细菌群落结构特征
通过OTU 物种注释,7个不同月份平茬柠条林地土壤共获得2028个OTU。如图1 所示,不同平茬月份下,相对丰度排名前十的优势细菌所占比例均达到96%以上。各个细菌门相对丰度排序也相同,相对丰度≥1%排序前十的主要细菌门类及平均丰度值由高到低分别是:变形菌门(Proteobacteria)26.8%、放线菌门(Actinobacteria)23.44%、酸杆菌门(Acidobacteria)19.16%、绿弯菌门(Chloroflexi)11.39%、芽单胞菌门(Gemmatimonadetes)7.08%、拟杆菌门(Bacteroidetes)3.24%、己科河菌门(Rokubacteria)1.96%、疣微菌门(Verrucomicrobia)1.61%、硝化螺旋菌门(Nitrospirae)1.13%、厚壁菌门(Firmicutes)1.02%,共占细菌总数的96.83%,其余门类及未检出的细菌门仅占细菌总数的3.17%,其中其他细菌门类占3.16%,未检出的仅占0.01%。

图1 门水平的细菌群落相对丰度(前十)Fig.1 The relative abundance of bacterial communities at the phylum level(top ten)
对相对丰度排序前十的细菌门物种差异显著性分析可知(表4),除绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)在 7个不同平茬月份分组之间无显著差异(P>0.05)外,其他优势细菌门在不同平茬月份分组之间具有一定的差异。其中,相对丰度大于10%的前四大细菌门是变细菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi),是平茬处理的人工柠条林地中的优势细菌门。 9月平茬的柠条人工林地土壤第一优势菌群变形菌门(Proteobacteria)丰度最高,为 29.74%,且显著高于10月(P<0.05),其他各月之间差异不显著(P>0.05),7个处理变形菌门(Proteobacteria)相对丰度由高到低排序为:Y9>Y8>Y4>Y5>Y7>Y6>Y10。放线菌门(Actinobacteria)相对丰度以 5月平茬最高,且显著高于 4、6、7、8、9月(P<0.05)。6、7月平茬土壤中的酸杆菌门(Acidobacteria)显著高于 4、5、8、9月(P<0.05),9月份平茬柠条林地土壤中的酸杆菌门(Acidobacteria)丰度最低。芽单胞菌门(Gemmatimonadetes)8月平茬的土壤中相对丰度显著高于其他各月(P<0.05),其次是9月,10月最低。己科河菌门(Rokubacteria)和硝化螺旋菌门(Nitrospirae)相对丰度分别是6 和10月最高,9月最低,均达到显著差异水平(P<0.05)。

表4 门水平下的细菌群落组成差异(相对丰度排序前十)Table 4 Difference of bacterial community composition(top ten)of relative abundance at phylum level
2.4 细菌β 多样性分析
基于非加权Unifrac 距离的非度量多维尺度分析表明,不同平茬月份下柠条林地土壤细菌群落组成存在差异。不同平茬月份组间距离、组内距离大小不一致,主要表现为9月与其他各月组间的距离较大,其他各月组间距离小,8、9、10月的组内距离大,4、5、6、7月的组内距离相对较小,说明 9、10月与其他各月的细菌群落组成差异较大。不同月份平茬影响了柠条林地土壤细菌群落结构(图2)。进一步结合置换多元方差分析对不同分组的样品之间β 多样性是否存在显著差异进行检验,结果如表5 所示,由不同分组两两之间的细菌群落组成差异P值可知,9月分别与 4、5、6、7、8月之间差异极显著(P<0.01),10月分别和 4、7月 之 间差异极显 著(P<0.01),和5、6、8月之间差异显著(P<0.05)。

表5 不同分组之间的细菌群落差异Permanova 分析P 值Table 5 Bacterial community difference P value between different treats(Permanova)

图2 细菌群落组成的非度量多维尺度分析Fig. 2 Non-matric multidimensional scaling analysis(NMDS)of bacterial community composition
2.5 土壤细菌群落与理化因子的关系
由于本试验中7个分组排序前十且相对丰度大于10%的优势细菌门只有4个,而优势细菌属又在10 种以上,所以选择排序前十的优势细菌纲与环境因子进行冗余分析,以便更好地寻找细菌与环境因子的相关性。结果表明细菌群落受土壤理化因子影响的程度不同,筛选出影响细菌群落的6个主要环境因子(土壤有机质、全磷、全钾、速效氮、pH 和含水量)对群落物种分布的影响具有显著性(P=0.004),6个主要土壤环境因子对物种分布的累计解释率为96.59%,其中RDA 前两个排序轴的特征值分别解释了62.21%和19.69%的细菌群落变化(图3)。土壤全磷、速效氮、有机质与第一排序轴正相关,pH、含水量、全钾与第一排序轴负相关。土壤全磷、速效氮、有机质是贡献率较大的环境因子,贡献率分布为35.4%、21.0%、17.1%,说明各处理土壤细菌群落主要受到该3个土壤因子的影响。土壤理化因子对优势细菌群落的影响主要表现在放线菌纲(Actinobacteria)、酸微菌纲(Acidimicrobiia)与土壤pH 呈显著正相关,与全磷、速效氮、有机质含量、含水量呈显著负相关;变形菌纲中α 变形菌纲(Alphaproteobacteria)与土壤有机质呈显著正相关,与含水量、全钾呈显著负相关;δ-变形菌纲(Deltaproteobacteria)与含水量、全钾呈显著正相关,与有机质呈显著负相关;γ-变形菌纲(Gammaproteobacteria)、芽单胞菌纲(Gemmatimonadetes)与有机质、速效氮、全磷呈显著正相关,与pH、全钾呈显著负相关。

图3 细菌群落(排序前十细菌纲)和土壤理化因子的冗余分析Fig. 3 Redundancy analysis for bacterial community(top ten bacteria at class level) and soil physical and chemical factors
3 讨论
土壤微生物多样性是反映微生物群落稳定性的重要指标,也能够反映土壤环境改变对微生物群落特征的影响[26]。因此,土壤微生物群落组成及其多样性对人为干扰条件下土壤生态功能的恢复以及稳定性的维持具有重要意义,通常作为指示土壤健康最灵敏的指标[27]。平茬是干旱地区提高人工柠条林生产力的重要方式之一,目的是通过控制灌木生长,减少干旱地区人工植被对水分的过度利用,促进柠条根系和灌木林下草本植物的生长,提高生物多样性[28-29]。植被的地上地下部分生长均会对土壤性质、酶活性、微生物等产生影响[30-31],从而改善林地土壤生态环境。郑佳华等[17]对内蒙古锡林浩特典型大针茅(Stipa grandis)草原刈割研究表明,刈割改变了大针茅草原土壤细菌和真菌优势类群。Chen 等[16]研究发现在温带草原刈割后氨氧化菌的丰度发生了显著变化,分析原因认为刈割可能是导致参与氮循环的微生物群落组成发生变化的主要因素。本试验结果表明:柠条生长季节的4-10月不同月份平茬后柠条人工林地土壤细菌群落组成类群没有差异,但对变形菌门、放线菌门、芽单胞菌门等优势细菌类群相对丰度产生了影响,生长旺盛季节的4、6月平茬的柠条林地土壤细菌Alpha 多样性指数较高,而生长季末的9 和10月偏低,土壤细菌物种相对较少,说明从时间上分析,春夏季平茬由于柠条恢复生长期长,柠条灌丛的生长发育引起土壤资源空间异质性,土壤养分聚集[7,27],有利于形成更佳的微生物生长环境,从而有利于土壤微生物活动[32]。前人研究表明,平茬后恢复生长的柠条林地植物多样性更高,这也会增加土壤有机质含量,并调节土壤含水量[33-34],使得土壤微生物的生存环境得到改善。9月后宁夏荒漠草原区的气温较低、柠条平茬生长期较短、恢复生长能力相对低于其他时间,对土壤性质和微生物势必产生影响。植物与土壤环境相互作用,平茬移除了植株地上残枝或部分植株,减少了土壤中C 和N 的输入,对C 和N 源敏感的细菌类群,如变形菌、放线菌就会产生影响[17]。为了更好地利用柠条资源,生长季平茬优于冬季平茬已得到广泛认可[35],但合理的平茬时间应依据区域气候条件、立地土壤状况、柠条长势和生产用途等具体情况而定。
不同月份平茬的柠条人工林地土壤细菌第一优势类群都是变形菌门,已有研究普遍认为变形菌门是世界上最普遍的菌门,与碳源的利用紧密相关[36]。4-9月平茬的柠条林地变形菌门相对丰度均显著高于10月平茬,而与碳源有关的土壤有机质含量却是6月最小,说明平茬各月土壤碳源对变形菌门产生了不同影响。土壤氮素与α变形菌纲、芽单胞菌纲存在正相关关系,这也验证了孙怀博[37]的研究结果,而Cruz-Martinez 等[38]研究则认为放线菌门与土壤碳、氮含量没有直接相关性。牛宋芳[10]对宁夏荒漠草原不同土壤类型人工柠条林根际细菌群落的研究也发现,土壤碳、氮同变形菌门、放线菌门没有显著的相关关系。放线菌门是仅次于变形菌门的第二优势类群,这可能与荒漠草原柠条林地环境恶劣、气候干旱等气候条件适合于放线菌的生存与繁殖有关。放线菌能产生抗生素、促进动植物残体在土壤中快速分解、参与土壤碳、氮、磷等养分循环[17],也反映出试验区荒漠草原柠条林地土壤中富含广泛的抗生素产生菌资源,可以进一步挖掘利用。酸杆菌门主要生长在营养贫瘠的土壤环境中[39],其丰度与氮的可用性呈负相关关系[40],这可能与氮导致土壤pH 下降有关[41]。本研究中酸杆菌门的相对丰度排序第三,说明荒漠草原柠条人工林地的土壤养分贫乏,需要通过平茬措施加快柠条林的恢复生长,从而改善土壤结构和养分状况,6 和7月平茬的酸杆菌门相对丰度较高,也说明了这两个月平茬对土壤酸杆菌门有利。
在荒漠地区构建锦鸡儿(Caragana)人工林能够显著提高土壤养分,相对于未平茬处理,对锦鸡儿人工林进行平茬可提高其邻居草本群落的养分,降低土壤pH,提高地上植被群落的物种多样性等[7],而土壤养分含量的变化导致了土壤细菌的组成及群落结构的变化[42]。土壤可利用性氮、有机质等养分状况对细菌群落结构有着重要影响[43]。罗旦等[44]研究认为全氮、速效氮、全磷和速效钾是影响陕北沙区柠条、沙柳(Salix cheilophila)、沙蒿(Artemisia desertorum)等3 种植物根际土壤细菌丰富度的主要因素。8月平茬的柠条林地全氮和速效氮的含量均显著高于其他各月平茬处理,说明8月平茬有利于柠条根部积累更多的根瘤菌固定空气中的游离态氮,增加土壤含氮量。平茬的人为干扰使得土壤微生物群落结构发生了改变[17]。在土壤碳、氮库十分贫乏,气候条件较为恶劣的干旱、半干旱荒漠草原地区,特定区域的微生物群落组成受到特定环境因素的直接或间接调控与影响。本试验仅研究了细菌,也没有考虑未平茬的影响,对于平茬后植被恢复生长程度的差异对土壤特殊功能类群菌种响应机制的研究还有待于进一步深入。
4 结论
平茬对柠条林地土壤细菌群落分布产生了影响,不同月份平茬间土壤优势细菌类群组成存在一定差异。排在前五的主要优势细菌门的相对丰度大小排序均为:变形菌门(Proteobacteria)>放线菌门(Actinobacteria)>酸杆菌门(Acidobacteria)>绿弯菌门(Chloroflexi)>芽单胞菌门(Gemmatimonadetes)。9月平茬的柠条林地土壤变形菌门(Proteobacteria)丰度最高,5月平茬的放线菌门(Actinobacteria)的丰度最高,7月平茬的酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)的丰度较高,8月平茬的芽单胞菌门(Gemmatimonadetes)丰度最高。不同月份平茬对柠条林地土壤细菌多样性具有一定影响。8月平茬的土壤细菌群落的丰富度Chao1 和Ace 指数较高,9月平茬的土壤细菌群落多样性最低。不同月份平茬细菌群落受土壤环境因子的影响不一致。土壤全磷、速效氮、有机质是主要影响因素。生长季节的4-8月平茬优于9 和10月。
