基于全肿瘤MRI筛选胰腺导管腺癌SMAD4表达影像-生物学标志物
2022-07-08罗荣奎周建军曾蒙苏
梁 亮 ,董 行 ,罗荣奎,丁 莺 ,周建军 ,曾蒙苏 *
1.复旦大学附属中山医院厦门医院放射科,厦门 361015
2.复旦大学附属中山医院放射科,上海 200032
3.上海市影像医学研究所,上海 200032
4.复旦大学附属中山医院病理科,上海 200032
作为消化系统常见恶性肿瘤,胰腺癌2018年全球新发病例达458 918例[1],胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)是其最常见的病理类型,恶性程度较高。由于缺乏有效的治疗手段,患者预后大多较差,5年总生存率仅约7%[2]。目前,胰腺癌治疗前的影像学评估主要基于病变形态、周围结构侵犯和远处转移等,无法充分反映胰腺癌的生物学特性,因此对治疗方案的选择、疗效和患者生存质量造成影响[3]。
研究生物学标志物是了解胰腺癌生物学行为的有效手段[4]。SMAD4基因是PDAC最重要的抑癌基因之一,其缺失导致肿瘤更具侵袭性,与肿瘤的发展及疗效、预后不佳密切相关[5-7]。不同SMAD4基因表达患者的复发模式不同,SMAD4缺失者更易发生远处转移,而表达SMAD4者多为局部侵犯[8-9]。因此,明确PDAC患者SMAD4基因表达对胰腺癌个体化精准诊治具有重要的临床价值。
临床发现病变时,仅10%~30%的胰腺癌符合可手术切除条件[10-12]。而非手术活检常难以获得满意的胰腺癌组织标本,且无法完整反映肿瘤的生物学特性和异质性。近年来兴起的影像组学技术能挖掘常规医学影像中蕴含的深层数据,从中提取并定量分析高通量数据,在肿瘤生物学行为评估方面更有优势[13],且可以发现肉眼无法识别的肿瘤特征[14]。以往研究[15-17]基于CT图像和纹理分析,发现影像组学特征与胰腺癌患者生存情况及组织病理学等有一定相关性。但基于MRI的胰腺癌全肿瘤影像组学研究目前较少,且未见胰腺导管腺癌SMAD4基因表达相关影像-生物学标志物研究报道。
本研究应用MRI和影像组学分析方法对PDAC进行全肿瘤影像学评价,结合组织病理学和SMAD4表达情况,寻找PDAC SMAD4表达的影像-生物学标志物。
1 资料与方法
1.1 一般资料选择2012年1月至2017年9月于复旦大学附属中山医院接受Magnetom Aera 1.5T MRI行腹部增强检查且疑似胰腺恶性肿瘤的患者326例,其中经本院手术病理学证实为PDAC,且符合入选排除标准的患者60例。本研究经复旦大学附属中山医院伦理委员会批准(B2018-266),并免除书面知情同意。
纳入标准:(1)在本院接受同一台1.5T MRI腹部增强检查,图像质量不影响全肿瘤评价;(2)手术后病理检查证实为PDAC;(3)MRI检查后1个月内进行术前实验室检查及手术;(4)患者临床资料完整,包括基本信息、实验室检查、手术经过、病理检查等;(5)有SMAD4表达检测结果。排除标准:MRI检查前行经皮肝穿刺胆道引流(PTCD)、放置胆管支架或抗肿瘤治疗,以及其他不宜参加研究的因素。
1.2 MRI检查采用Magnetom Aera 1.5T MRI 成像仪(Siemens Healthcare公司)及相阵控体线圈,序列参数见表1。动态增强扫描采用自动监测触发扫描,监测层面为腹主动脉。信号值达90时触发并延迟10 s开始动脉期扫描,30 s后行门脉期扫描,80~120 s后行延迟期扫描。对比剂:钆喷酸葡胺,以0.1 mmol/kg注射,注射速率为1~2 mL/s。

表1 磁共振成像参数
1.3 全肿瘤影像组学特征提取
1.3.1 病灶分割由1名放射诊断医师(具有11年腹部影像诊断经验)利用影像组学分析软件(Radiomics, Siemens Healthcare公司),基于工作流中3D域的通用自动分割算法进行半自动肿瘤分割,覆盖肿瘤整体,分割序列包括T1WI (VIBE)、T2WI、ADC图、动脉期、门脉期和延迟期,当分割轮廓不正确时由研究者手动编辑轮廓。所有分割图像均由另一名放射诊断医师(具有13年腹部影像诊断经验)检查确认。
基于工作流中3D域的通用自动分割算法进行半自动分割,分析软件自动识别全肿瘤轮廓(黄线勾画),见图1。研究者于横断位(左上图)、矢状位(右上图)和冠状位(左下图)连续层面确认轮廓是否准确,当分割轮廓不正确时由研究者手动编辑轮廓,勾画完成后提取整体全肿瘤(右下图黄色标识)进行分析。

图1 Radiomics病灶分割
1.3.2 特征提取病灶分割完成后,软件基于Pyradiomics library算法[18]自动提取病灶全肿瘤影像组学特征。每个序列获得影像组学特征1 214个,其中包括一阶统计(19个)、基于形状(16个)、GLCM(24个)、GLRLM(16个)、GLSZM(16个)、NGTDM(5个)、GLDM(14个)七大类共110个,每个特征同时经平方、平方根、对数、指数和小波等多个滤波器计算变换额外特征。
1.4 图像分析
1.4.1 主观评价由上述2名放射诊断医师共同对PDAC影像学征象进行评价,由争议时经讨论取得一致。评价利用PACS系统完成,指标包括病灶MRI信号、形态、境界、强化方式、有无坏死囊变、是否浸润胰周组织、是否侵犯周围血管、远端胰管是否扩张、远端胰腺是否萎缩、是否伴随潴留囊肿形成等。
1.4.2 全肿瘤影像学定量评价对病灶短径、长径、全肿瘤ADC值、动脉期强化率、门脉期强化率、延迟期强化率、门脉期与动脉期强化差异、延迟期与动脉期强化差异及延迟期与门脉期强化差异等进行定量评价。原始定量数据利用影像组学一阶统计指标获得。平扫T1WI (VIBE)、T2WI、动脉期、门脉期及延迟期5个序列共6 070个征象进入影像基因组学特征筛选。
1.5 病理学评价SMAD4表达采用EnVision两步法进行免疫组织化学染色检测。组织蜡块以4 μm厚度切片,经常规脱蜡、水化及抗原修复后,使用抗SMAD4抗体(小鼠单克隆抗体B-8,sc-7966;Santa Cruz公司;1∶300稀释),应用全自动免疫组化染色系统(Bond Max,Leica Biosystems Melbourne Pty)及其配套聚合物优化检测试剂系统(DS9800,含过氧化物酶封闭剂、一抗后试剂、二抗试剂、DAB显色液及苏木精复染液,Leica Biosystems Newcastle)对切片进行染色。由我院一名病理科医师(具有8年病理诊断经验)对患者病理组织切片重新阅片评价,确认病理类型及分化情况,并分析SMAD4表达情况[19]。SMAD4染色阳性区域小于10%者判定为SMAD4阴性表达(基因缺失)。根据免疫组化染色结果将患者分为SMAD4阳性表达组(图2A)和阴性表达组(图2B)。
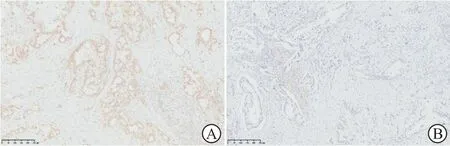
图2 PDAC组织SMAD4表达
1.6 统计学处理采用SPSS 19.0软件进行统计学分析。分类变量以n(%)表示,组间比较采用Fisher确切概率法;连续性变量以x±s或M(P25,P75)表示,组间比较采用Mann-WhitneyU检验。检验水准(α)为0.05。
通过最大相关最小冗余(maximum relevance minimum redundancy,mRMR)算法评估影像基因组学特征的冗余度和相关性,评估依据为互信息(mutual information,MI),校正P值阈值设定为0.10。多因素融合最佳模型通过最佳子集正向选择获得:从最佳特征开始,迭代所有剩余特征,将该特征添加到模型中,从而优化所选标准;重复此过程,直到达到预定义的最大特征数。最佳子集依据贝叶斯信息准则(Bayesian information criterion,BIC)选择,BIC值最小者为最佳子集。确定最佳子集后,采用ROC曲线检测其诊断效能。
2 结 果
2.1 临床资料及病理学评价60例PDAC患者中,SMAD4阳性表达者11例(18.3%),SMAD4阴性表达者49例(81.7%)。结果(表2)显示:2组性别分布差异有统计学意义(P=0.012),SMAD4阳性组以女性居多;2组年龄、CEA、CA19-9、病灶位置及分化程度差异均无统计学意义。
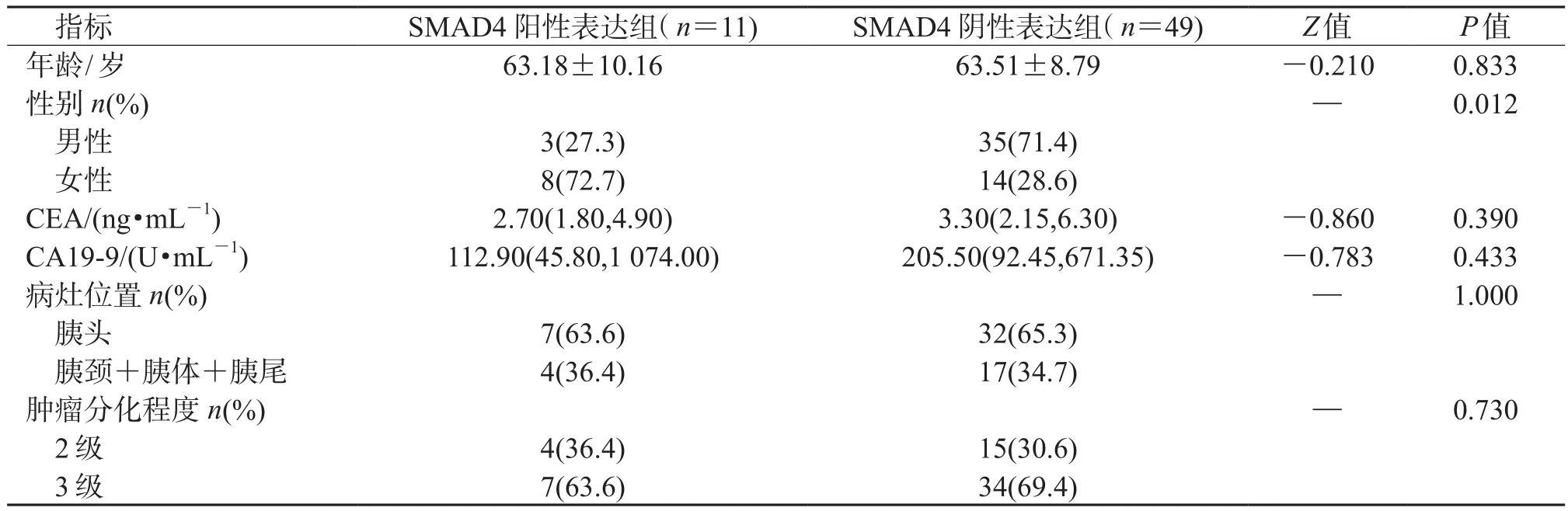
表2 临床资料及病理学评价
2.2 影像学主观评价结果(表3、图3)显示:2组间T1WI、T2WI信号,增强后延迟强化,病变侵犯等情况差异均无统计学意义。
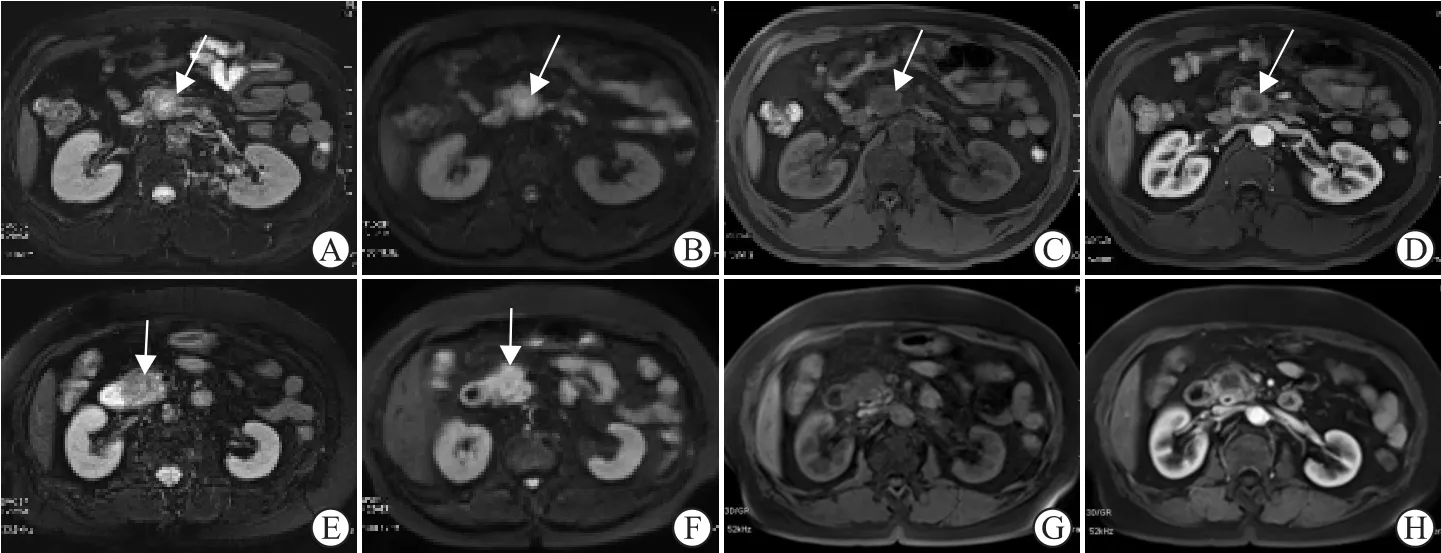
图3 不同SMAD4表达组PDAC影像学表现
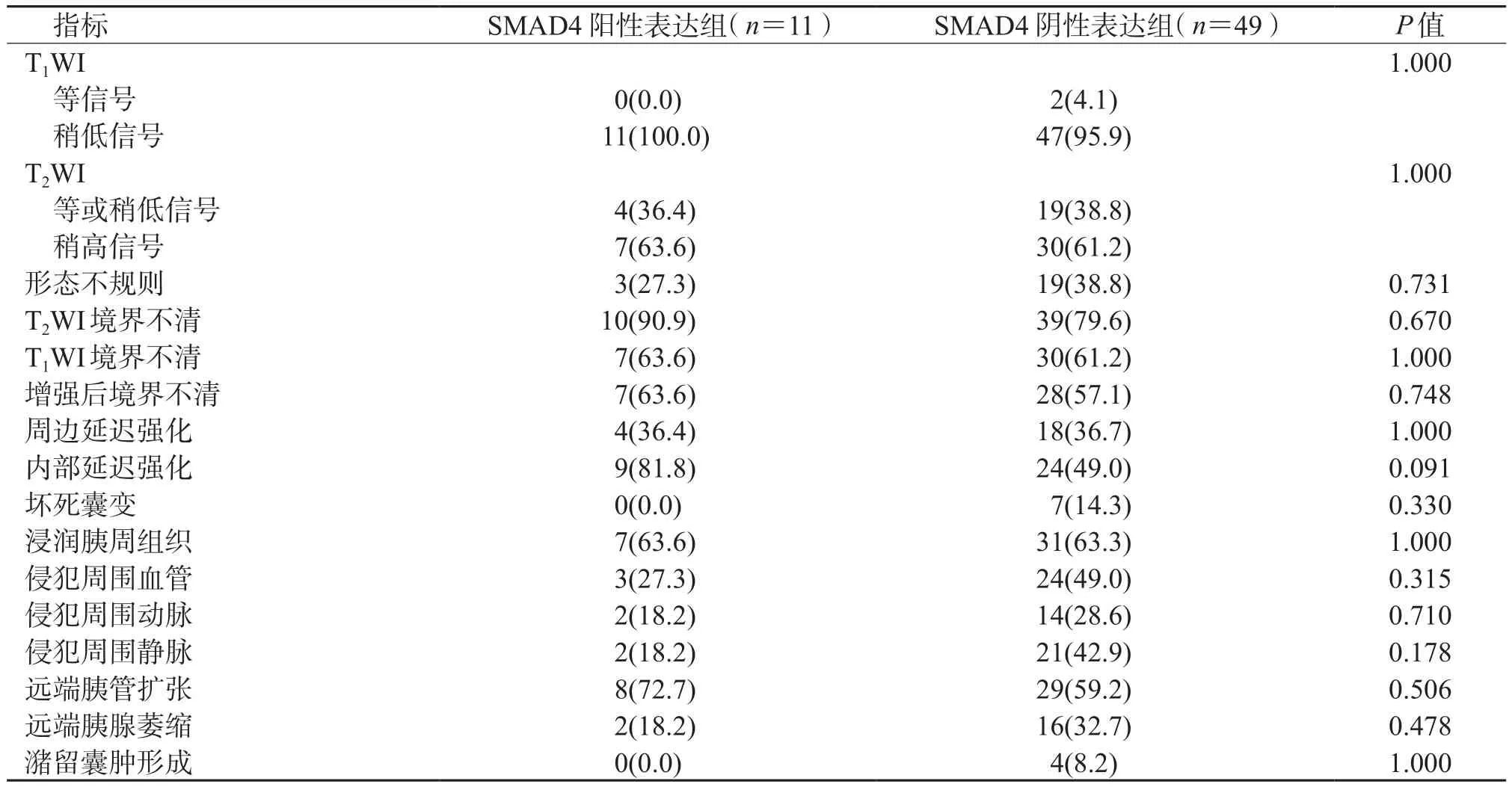
表3 2组间影像学主观评价比较
2.3 全肿瘤影像学定量评价结果(表4)显示:2组病灶大小、ADC、不同时相强化率及强化差异 的差异均无统计学意义。

表4 2组间全肿瘤影像学定量评价比较
2.4 全肿瘤影像组学分析经基于SMAD4表达的PDAC全肿瘤影像组学特征筛选,共获得6个影像组学特征(表5、图4),用于多因素影像基因组学特征融合建模。建模所得最佳特征子集为门脉期_wavelet-HHL_NGTDM_Contrast+T1WI_wavelet-HHL_GLDM_HighGrayLevelEmphasis(表6),BIC为33.4;ROC分析(图5)显示:该子集预测PDAC患者SMAD4表达的曲线下面积(AUC)为0.92(P<0.001),预测灵敏度为90.9%、特异度为81.6%,组内预测准确度为83.3%。

表5 基于SMAD4表达的PDAC全肿瘤影像组学特征单因素筛选结果
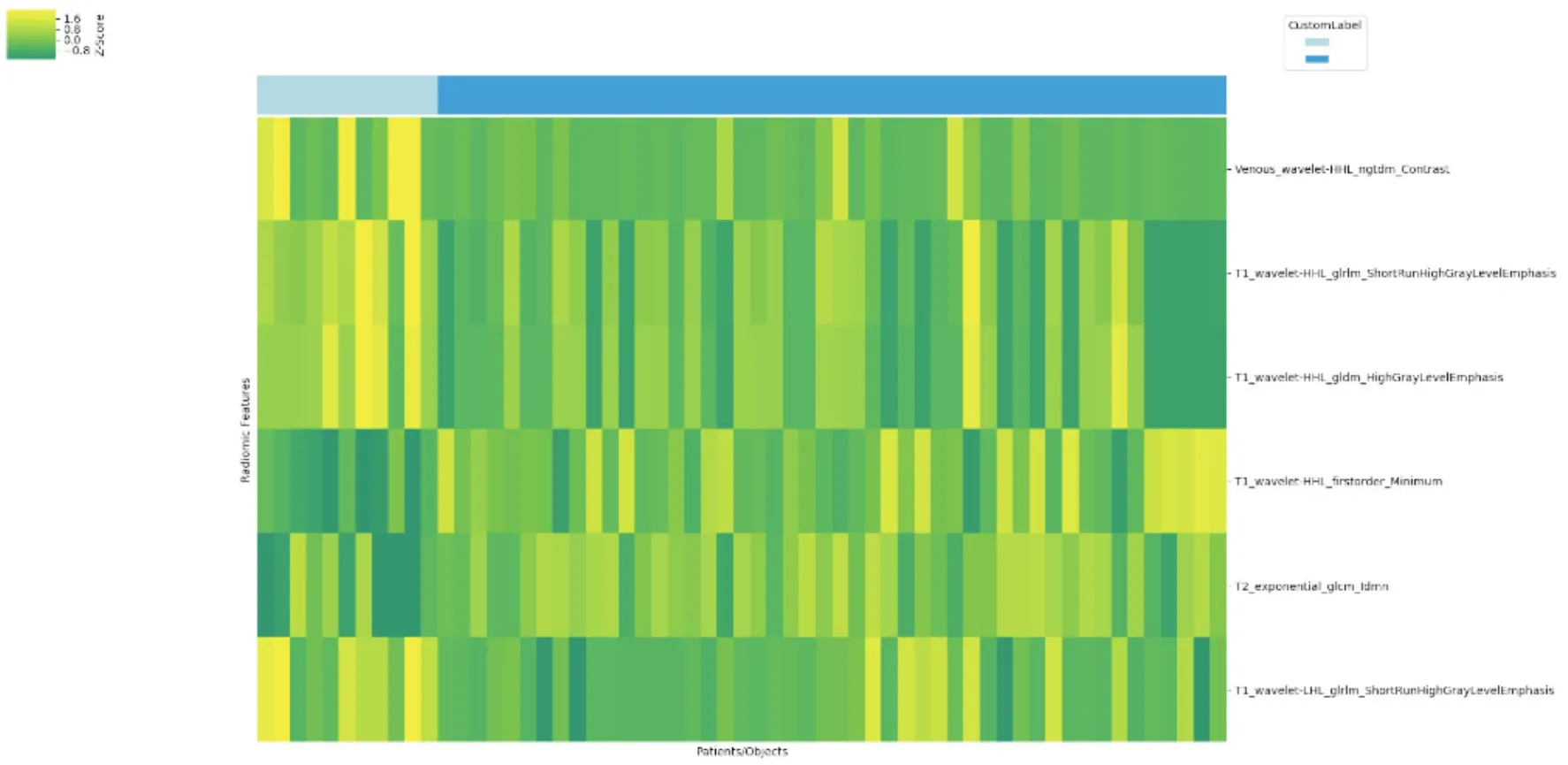
图4 基于SMAD4表达的PDAC全肿瘤影像组学特征单因素筛选热图

表6 SMAD4表达的PDAC全肿瘤影像基因组学特征最佳子集
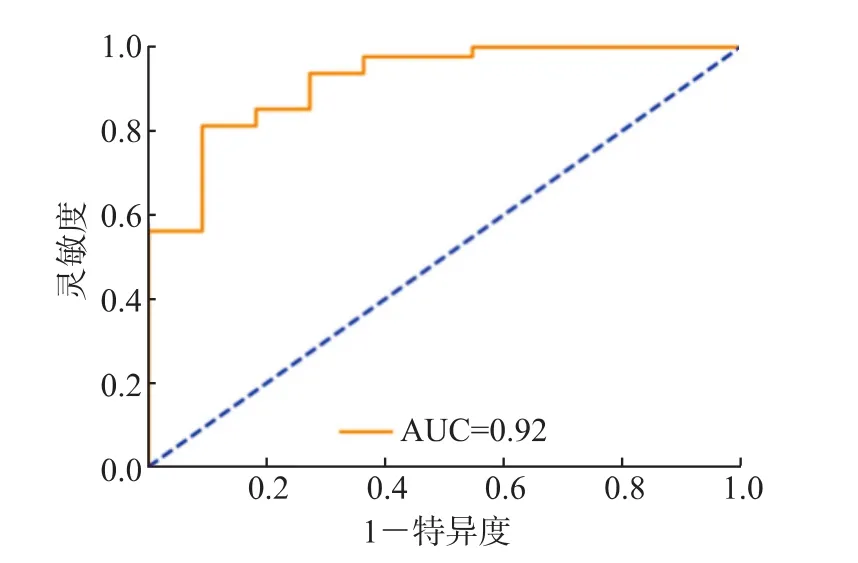
图5 全肿瘤影像基因组学特征最佳子集预测SMAD4表达的ROC曲线
用颜色表示筛选所得6个特征的分布情况,绿色代表低值、黄色代表高值、黄绿色代表中间值;每行表示1个影像组学特征,列对应所有研究对象,上方浅蓝色对应SMAD4阳性表达者11例,上方深蓝色对应SMAD4阴性表达者49例。
3 讨 论
全球胰腺癌发病率占癌症的第11位,2018年所导致的死亡占癌症的第7位[1]。由于其缺乏有效治疗手段,患者预后多较差,且致死率不断上升。有研究[20]认为,2030年,胰腺癌将成为癌症相关死亡的第二大原因。对胰腺癌生物学行为的深入了解,将胰腺癌的影像学评估由单纯的形态学评价向影像-生物学评价模式转变,作为组织病理学标志物的补充,有利于胰腺癌诊治手段的发展。
SMAD4基因是重要的PDAC生物学标志物,是其最重要的抑癌基因之一。在PDAC患者中,SMAD4的缺失比例为55%~81.6%[7,19],本研究中SMAD4基因缺失比例与此相符。SMAD4基因与细胞基因转录相关,功能包括抑制肿瘤生长、介导细胞周期停滞以及诱导细胞凋亡等[21-22],缺失将导致肿瘤更具侵袭性。
本研究中,SMAD4阳性表达组与阴性表达组间性别分布差异有统计学意义,SMAD4阴性表达组中男性比例高于SMAD4阳性表达组(P=0.012),这可能是男性PDAC患者死亡率高于女性的原因之一。
本研究中,2组影像学主观评价及定量评价指标差异均无统计学意义。以往研究[23]对PDAC的CT表现进行分析,发现表达SMAD4的PDAC境界更清楚、胰周组织浸润较SMAD4表达阴性者少,但组间差异不大。本研究的主观评价指标中,SMAD4阳性表达组的形态不规则(27.3%vs38.8%)、坏死囊变(0vs14.3%)和侵犯周围血管(27.3%vs49.0%)比例均低于阴性表达组,但差异无统计学意义,有待扩大样本量进一步研究。
本研究中,影像组学技术一定程度上弥补了上述影像学常规评价未能发现SMAD4基因相关影像-生物学标志物的不足,并初步建立了PDAC影像基因组学模型。作为发展于影像组学的技术,影像基因组学将影像与基因相关特征相互关联[24],从而深入了解肿瘤生物学行为、发掘肿瘤内在的异质性,是个体化精准医学发展的重要方向之一[25]。影像基因组学的研究与应用,有望实现在体全肿瘤基因分析,预测个体治疗的疗效、可能的不良反应,从而选择最优治疗方案、改善预后[26]。
此外,本研究对PDAC病灶进行了全肿瘤影像学评价。与仅选取最大横截面进行分析相比,全肿瘤影像学分析更能体现肿瘤的内在生物学特征,并避免研究过程中选取最大横截面时发生的选择偏倚,结果更可靠[27]。因此,包括影像组学特征在内的全肿瘤影像学分析有望无创获取PDAC的影像-生物学标志物,且无需增加额外的检查和医疗费用。
本研究仅探讨了PDAC单一基因相关的影像基因组学特征,但筛选所得的最佳特征子集具有较好的诊断效能(AUC为0.92,组内预测准确度为83.3%),子集内的特征代表了病灶体素灰度的分布、变化和差异等图像深层信息,反映了肿瘤的异质性等生物学特征[13]。目前,PDAC相关影像-生物学标志物及影像基因组学研究仍然较少,本研究可作为后续研究的基础。
本研究也存在一定的局限性:(1)由于病例数相对较少,未对影像基因组学结果进一步验证,而在特征筛选过程中通过mRMR算法和校正P值确保了组内特征筛选的可靠性;(2)仅对SMAD4基因表达进行了研究,今后希望能在扩大样本量的基础上,通过多种检测方法实施PDAC多基因融合的影像基因组学研究。
利益冲突:所有作者声明不存在利益冲突。
