腊花组培快繁体系研究
2022-07-08白艳荣蒋亚莲王进英
白艳荣,蒋亚莲,王进英
(1昆明学院,昆明 650213;2云南省农业科学院花卉研究所,昆明 650214)
0 引言
腊花(Chamelaucium uncinatum)为桃金娘科(Mycinatum)植物,即淘金彩梅,又名杰拉尔顿腊花或风腊花。腊花可作高档鲜切花、绿化景观树、盆景、香精萃取等,具有较高的观花、观叶及经济价值。由于蜡花雄蕊较长伸出花外、雌蕊隐蔽于花心之内导致不结实。目前,主要繁殖方式为扦插繁殖。扦插繁殖慢且生根率低,难以满足生产需求。有关风腊花组培的研究,钱仲秀等[4]以3年生当年长出的半木质化嫩枝作为外植体,初代培养并获得了成功;娄丽华等[5]采用半木质化嫩茎顶芽作为外植体,成功建立了无菌体系;汤桂军等[6]以春季抽伸的半木质化嫩茎茎段作为外植体,生根率可达80%;但尚未解决生根率低的问题,不能满足生产上的需要。笔者以腊花的嫩芽嫩茎为繁殖材料,研究和完善腊花的组培快繁技术体系,旨在为腊花种苗工厂化生产提供技术参考。
1 材料与方法
1.1 实验材料
选取腊花半木质化嫩枝顶芽做外植体。
1.2 主要试剂
试剂包括蔗糖、琼脂、HCl、NaOH、75%酒精、2%次氯酸,激素KT、6-BA、IBA、NAA,MS、1/2MS培养基母液。
1.3 实验设计
1.3.1 初代培养 以MS为基本培养基,添加3%的蔗糖和0.62%的琼脂,培养基pH 5.8~6.0。设置KT(0、2、3、4 mg/L)、NAA(0、0.1、0.2、0.3 mg/L)浓度梯度组合的诱导培养基。选取腊花半木质化嫩枝顶芽做好消毒处理后接种到诱导培养基上,设置9个处理、1个对照,每个处理接种3瓶,3次重复,每瓶接种2个外植体,每个处理接种18个芽(>0.5 cm的芽),30天后分别统计不同激素浓度组合对腊花诱导培养的影响,进行数据统计,筛选最佳激素浓度配比的培养基。

1.3.2 增殖培养 以MS为基础培养基,添加3%的蔗糖和0.62%的琼脂,培养基pH 5.8~6.0。设置6-BA(0、0.5、1.0、1.5 mg/L)、NAA(0、0.1、0.2、0.3 mg/L)浓度梯度组合的增殖培养基。选取生长健壮的、长势一致的腊花无菌苗接种到增殖培养基上,设置9个处理、1个对照,每个处理接种3瓶,重复3次,每瓶处理接种3株,每个处理接种27个芽,培养45天后,分别统计组培苗的增殖情况,研究不同浓度激素梯度组合对试管苗增殖的影响,筛选最佳的增殖培养基。

1.3.3 生根培养 以1/2MS培养基为基础培养基,将无菌芽接种到不同浓度IBA(0、0.2、0.4、0.6、0.8 mg/L)的生根培养基上,添加3%的蔗糖、0.62%的琼脂和0.1%的活性炭,pH 5.8~6.0,设置6个处理、1个对照,每个处理转接3瓶,每瓶接种3株,重复3次,每个处理接种27株无菌苗,培养60天后进行数据统计,研究不同浓度的IBA对组培苗生根的影响,筛选最佳的培养基配方。
随机每个处理取10株长势一致的腊花组培苗,将组培苗取出,用清水对根系进行清洗,测量每株的根长,平均值即为根长。以组培苗根基0.5 cm处的直径作为根粗。

1.4 实验方法
1.4.1 培养基的配制 每个处理配制500 mL的培养基,装9瓶,按上述实验设计量取母液。在制备MS培养基时,母液量取应是大量元素和微量元素各5 mL/L;在制备1/2MS培养基时,母液量取应是按大量元素2.5 mL/L、微量元素5 mL/L和植物生长调节剂加入烧杯中,加入15 g蔗糖,再加入琼脂搅拌均匀后定容,用HCl或NaOH调节至pH 5.8~6.0,之后分装到培养瓶中,每瓶装55~60 mL的培养基,盖上盖子密封,添加到培养基中的激素或营养物质都需提前灭菌,置于灭菌架上放到高压蒸汽灭菌锅中,在温度为121℃下灭菌2 min,等温度和压力下降后取出培养基备用。
1.4.2 灭菌与接种 剪去相对幼嫩的半木质化枝条顶芽作为外植体,长度为1~2 cm,剪好后的材料用洗洁精浸泡2 min,用自来水清洗干净后用自来水流动冲洗2 h,之后到接种室用75%酒精清洗30 s后用无菌水清洗3次,每次清洗时间为25~30 s。用4%氯酸钠溶液浸泡15 min后,用无菌水清洗5遍,每次30 s,清洗好的外植体放到无菌接种盘用无菌纸把水分吸干,把无菌外植体接种到腊花诱导培养基中。
将接种后的腊花外植体在培养架中进行培养,其培养的温度为(23±2)℃,光强为1500~2000 lx,光照时间为12~14 h/d。在培养的过程中每隔7天观察一次培养瓶中苗的生长状况,诱导培养30天后对数据进行统计分析,增殖培养45天后对实验结果进行统计分析,生根培养60天后对实验数据作统计分析,筛选出最适宜腊花生长的诱导、增殖和生根培养基。
1.5 实验数据统计
实验数据统计结果采用单因素方差分析和Duncan’s多重比较分析不同处理之间的差异,差异显著性水平为P=0.05。所有的统计分析均在SPSS 24中完成。
2 结果与分析
2.1 不同激素(KT、NAA)浓度组合对腊花诱导培养的影响
由表1可见,不同浓度的激素(KT、NAA)浓度组合对诱导培养的影响有差异。当KT 3 mg/L、NAA 0.2 mg/L(A5处理)时,在此浓度组合下诱导效果是最理想的,发生个数达到16个,发生率达到88.83%,植株生长健壮,叶色为深绿色;A5与A1、A4、A6对比,虽然A1、A4、A6植株生长健壮,但是发生数和发生率不理想;A2、A3植株生长较为缓慢,但是苗生长健壮,有一定的利用价值;A7、A8虽然发生率不低,但是苗生长缓慢,且植株矮小细弱;A9、A10、A11苗生长缓慢且矮小细弱,出现玻璃化苗的情况,3个处理诱导出的苗基本无利用价值。
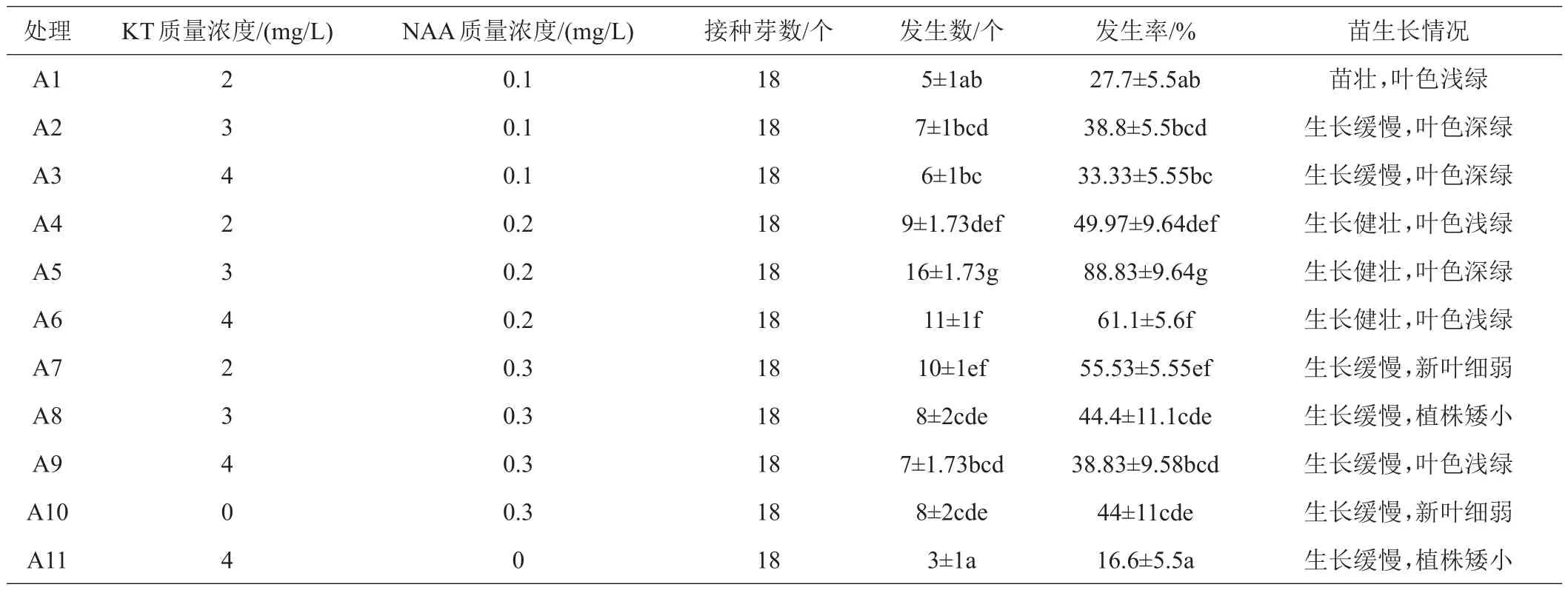
表1 风蜡花诱导培养基(KT和NAA浓度配比)研究结果
激素KT、NAA在中等水平对腊花诱导培养效果最有利。处理A1~A3 KT浓度不断上升,但是NAA浓度较低,腊花诱导效果都不理想;A4、A6、A7浓度梯度比较接近中等水平,诱导率处于中等水平;A8、A9处理,随着激素浓度梯度不断增大,发生率下降;A10、A11培养基中不添加KT、NAA,诱导率最低。激素浓度过高或过低都不利于腊花的诱导培养,在激素KT浓度 2、3、4 mg/L,NAA 浓度 0.1、0.2、0.3 mg/L,KT:NAA为3:1时,腊花诱导培养效果最好。
2.2 不同激素(6-BA、NAA)浓度组合对腊花增殖培养效果的影响
由表2可得,不同激素(6-BA、NAA)浓度组合对腊花增殖效果有显著不同。6-BA 1.0 mg/L、NAA 0.1 mg/L(B2处理)时,增殖效果最为理想,增殖系数达到3.6倍,增殖倍数达到4.17倍,植株生长健壮,芽较多,叶色深绿色;B3、B4处理虽然增殖系数和增殖倍数较高,但是植株生长细弱、叶色浅绿,不是特别理想;B1、B7处理植株生长健壮、叶色深绿,表现为中等水平,增殖系数和倍数较B2处理低,但增殖的苗可以利用,其中,B1有一部分苗生长欠佳,但是B7的苗相对于B1来看生长健壮、叶色深绿,则B7比B1增殖效果稍好;B5、B6、B10处理增殖系数、增殖倍数都较低,但是增殖苗生长健壮,叶色深绿、营养充足,增殖苗可利用;B3、B4处理虽然增殖系数以及增殖倍数都较高,但是增殖苗长势较弱,叶色不正,增殖苗营养不良;增殖效果最差的是B8、B9、B11处理,增殖系数比较低,而且苗几乎不生长,45天增殖苗已经开始老化,B11增殖倍数在所有处理中最高,但是增殖苗植株微型化、玻璃花,培育的苗无利用价值。
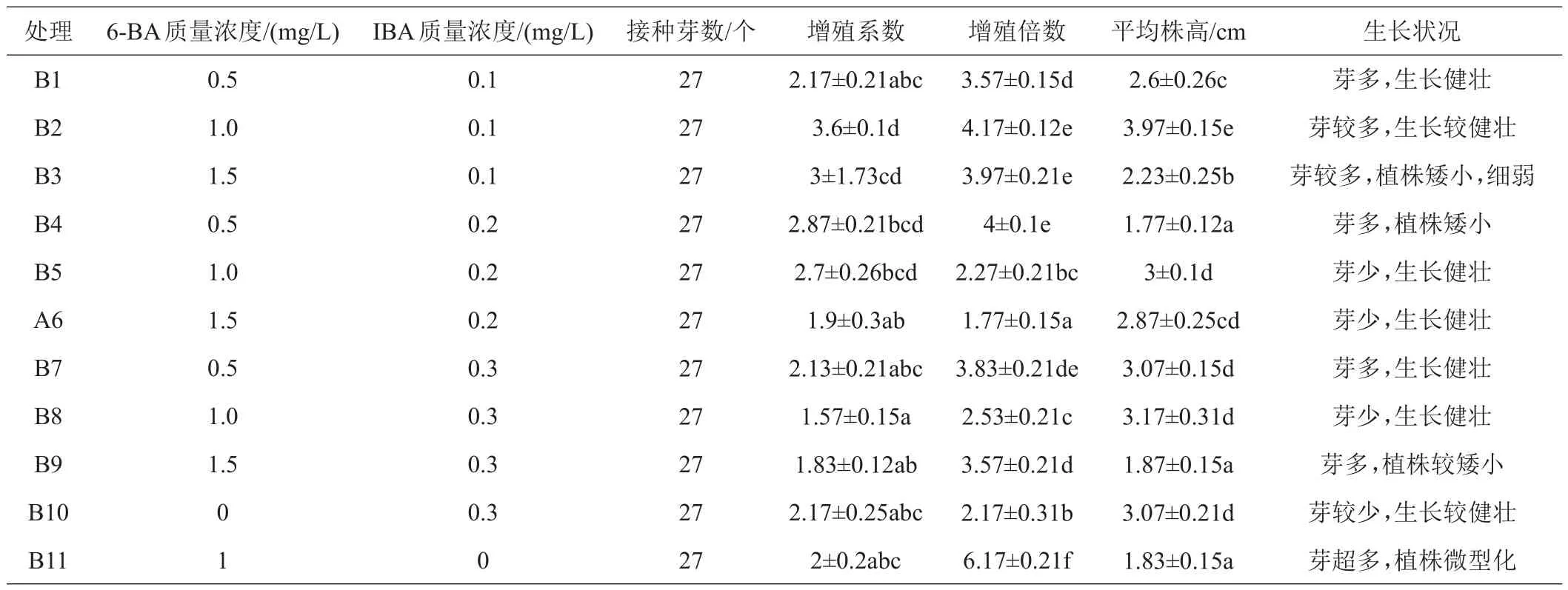
表2 腊花丛生芽增殖培养基(6-BA和NAA不同浓度配比)研究结果
当6-BA浓度过高、NAA浓度低有利于芽的分化,但不利于芽的生长;当6-BA浓度过低、NAA浓度过高不利于芽的分化,但能促进芽的生长。只有6-BA:NAA=10:1时,既能促进芽的分化又有利于幼芽的生长,获得好的增殖苗。
2.3 不同浓度的IBA对腊花生根效果的影响
由表3可知,激素IBA浓度为0.6 mg/L(C3处理)时,腊花生根培养效果最佳,接种的无菌苗生根率100%,平均每株生根条数为6.84条,平均根长为6.86 cm,植株生根时间最早,且生长健壮、叶色深绿。C2、C4处理生根数中等,植株生长健壮,但是C4比C2生根时间晚,且长势稍弱。较为一般的是C1处理,植株生长健壮,叶色深绿,但是生根时间较晚,且单株生根数较少。处理CK生根时间较晚,且平均每株生根数较少,此处理不适合生根培养。激素IBA浓度为0.6 mg/L最适宜腊花的生根培养,IBA浓度过高或过低都达不到最佳的生根效果。从表中可以看出,不添加植物生长调节剂无菌苗也能生根,但是根系细小,植株矮小,营养不良,不利于生根培养。
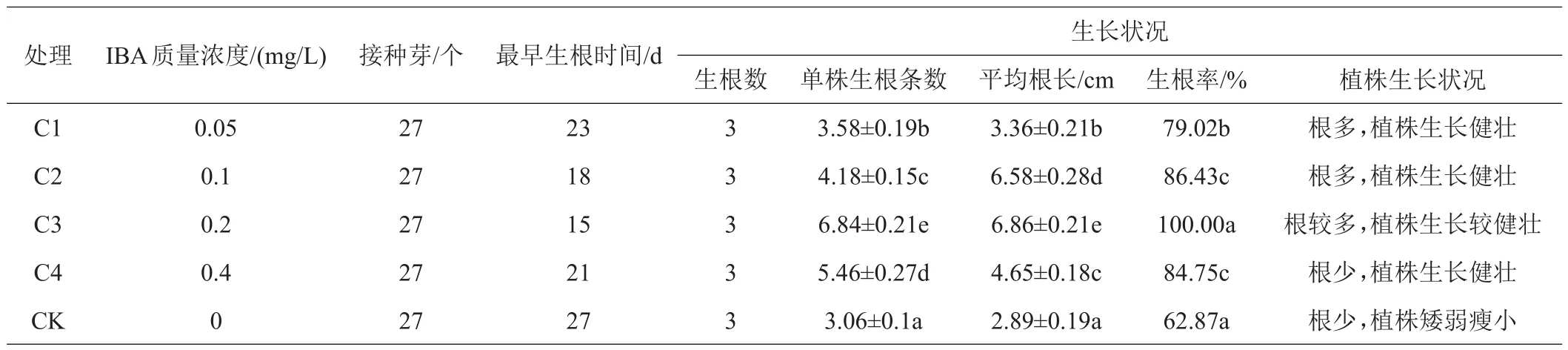
表3 不同浓度的IBA对腊花生根效果的研究结果
3 结论
(1)在腊花诱导实验中,最适宜腊花诱导的培养基配方为MS+KT 3 mg/L+NAA 0.2 mg/L+琼脂6.2 g/L+蔗糖30 g/L,pH 5.8,发生率达到88.8%,苗生长健壮,长势良好,叶色深绿。
(2)在腊花增殖培养实验中,最适宜腊花增殖培养基配方为MS+6-BA 1.0 mg/L+NAA 0.1 mg/L+蔗糖30 g/L+琼脂6.2 g/L,pH 5.8,增殖系数达到3.6倍,增殖倍数达到4.2倍,植株生长健壮,叶色深绿。
(3)在腊花生根培养实验中,最适宜腊花生根培养的生根培养基配方为1/2MS+IBA0.6 mg/L+琼脂6.2 g/L+蔗糖30 g/L+活性炭0.1 g/L,pH 5.8,最早生根时间为15天,平均每株生根数为6.8条,平均根长为6.9 cm,,生根率100%,植株生长健壮,叶色深绿。
4 讨论
腊花组织培养常用的外植体有茎尖、芽、茎段、叶片、花粉。一般幼嫩的组织材料褐变相对于较老化的组织材料来说较轻;另外,减小组织切口面积以及缩短组织暴露在空气中的时间有利于减轻褐化。在培养基中加入抗氧化剂和活性炭等都可以有效预防褐化的发生。有效的预防组织褐化方法有5种。(1)选择适宜的外植体,一般以腊花的嫩茎、顶芽最为理想;(2)加入抗氧化剂或吸附剂,能有效减少褐化;(3)连续转移外植体,对于新接种的外植体,将其快速转移到新鲜培养基上2~3次,在某些情况下可以减轻褐化,这段时间外植体的切口愈合,外渗停止;(4)对外植体进行消毒预处理;(5)给接种后的外植体适宜的暗处理。
钱仲秀等[4]以嫩茎为外植体,加入0.7%的PVP(聚乙烯聚吡氯烷酮)能有效防止褐变,平均发生率高达80%,最佳生根培养基配方为1/2MS+IBA 0.5 mg/L,平均每株生根数4~5条,生根率为77.8%。本实验加入了0.1 g/L的活性炭,增强了培养基的吸附能力,更有利于腊花植株的生长。根据本次实验结果可知,IBA浓度过高或过低对腊花生根培养都无优势,IBA0.6 mg/L最适宜腊花的生根培养。
