前视超声内镜治疗食管-胃底静脉曲张的初步研究*
2022-07-07刘靓曹新广王文佳代楠郭长青
刘靓,曹新广,王文佳,代楠,郭长青
(郑州大学第一附属医院 消化内科,河南 郑州 450052)
食管-胃底静脉曲张(esophageal and gastric varices,EGV)是肝硬化失代偿期最严重的并发症之一,约有近一半的肝硬化患者合并有EGV,并且在还未发生EGV的患者中,也在以每年约5.00%的速度增长[1],若未及时治疗,再出血发生率高达60.00%,一旦发生急性大出血,将严重威胁患者生命安全[2]。随着内镜设备的更新,及内镜治疗技术的成熟,内镜下治疗已成为门静脉高压所致EGV 的首选治疗方式。
超声内镜在观察EGV 时,曲张静脉血管呈圆形无回声区,可清晰显示。尤其是在观察胃底静脉曲张时,由于胃底皱襞粗大,通过超声内镜扫查,可避免与胃底黏膜皱襞混淆,并可通过超声视图测量曲张静脉直径。根据内镜下观察到的曲张静脉分型及内镜医师预测的静脉曲张容积可估计组织胶用量[3]。目前,临床上使用的几种超声内镜均不适用于EGV的治疗。微探头超声内镜小巧,操作风险小,但其无法观察血流情况,治疗时不易检出穿支静脉,也无法作为治疗镜使用,应用价值较小。环扫超声内镜的镜头粗且硬,对中重度EGV 患者进行扫查时,有较高的医源性出血风险,扫查胃底病变时需倒镜操作,执行困难,且因探头难以接近并垂直于病变部位,常无法获得满意的扫查图像。前视超声内镜进镜方向与白光内镜所视方向相同,可全面观察消化道管腔内情况,且其前端硬质段更短,弯曲角度更大,倒镜方便,与斜视超声内镜相比,可垂直接近胃底曲张静脉。本研究旨在比较普通内镜与前视超声内镜引导下治疗EGV的效果,以评估前视超声内镜的临床价值。
1 资料与方法
1.1 一般资料
回顾性分析2019年5月-2021年5月本院收治的40 例EGV 患者的临床资料,所有患者行套扎和组织胶注射治疗。采用前视超声内镜引导下治疗的19 例患者为观察组,普通内镜下治疗的21 例患者为对照组。两组患者年龄、性别、发病原因、静脉曲张严重程度和Child-Pugh分级等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。本研究经郑州大学第一附属医院伦理委员会批准,所有患者均签署知情同意书。
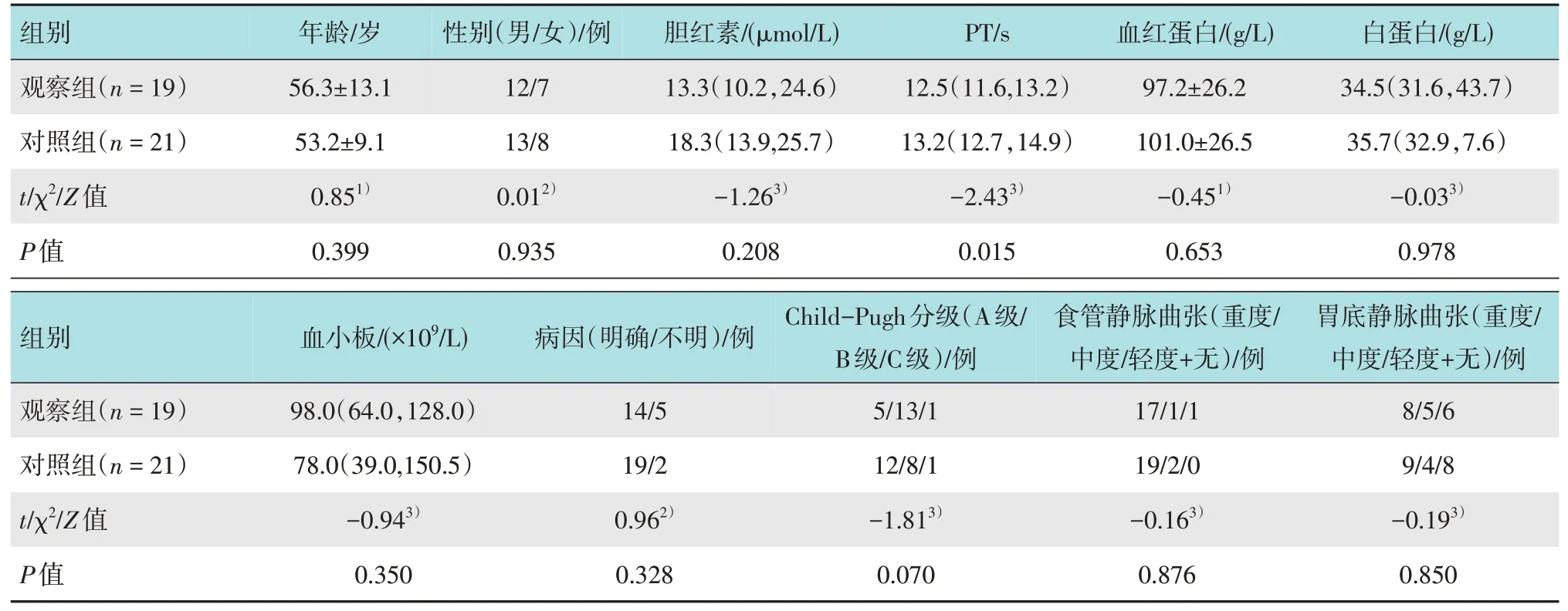
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
纳入标准:①经影像学诊断为肝硬化门脉高压的患者;②经影像学或消化内镜证实为中重度食管和(或)胃底静脉曲张的患者;③GOV1、GOV2和IGV1型EGV[4]。排除标准:①已发生肝癌或肝性脑病者;②严重的心肺功能和(或)凝血功能异常者;③已行经颈静脉肝内门体静脉分流术、脾栓塞、脾切除和脾切除+断流术等门脉高压干预治疗的患者;④临床资料不完善,依从性差,数据严重缺失者[5]。
1.2 术前准备
术前所有患者行门脉计算机体层摄影血管造影(computed tomography angiography,CTA),禁食水8 h,生命体征稳定,符合全身麻醉要求。
1.3 内镜治疗
所有操作均由同一位消化内镜医师完成,并由同一医师分别通过白光内镜及超声内镜评估血管直径。
1.3.1 观察组先在前视型线阵超声电子胃镜(TGF-UC260 J)(图1)白光内镜及超声视图下扫查。彩色多普勒探查下,具有丰富血流信号的壁内外管状区域即为曲张静脉,记录曲张静脉分级及分型。再根据胃部特殊结构,胃底曲张静脉治疗采用改良的“三明治夹心法”,于超声内镜引导下全面观察消化道壁内外血管,寻找血管来源支,将血管来源支作为靶静脉,根据静脉曲张分型及血管容积估计组织胶用量,制定个体化治疗方案。注射针准确穿刺血管后,注射聚桂醇(陕西天宇制药)2至3 mL(图2),再注射预估量组织胶(德国贝朗)并记录用量,推注聚桂醇2至3 mL 后拔针。注射时,血管内可见散在点状高回声点,注射后,彩色多普勒示注射部位无血流信号。若存在残腔血流,可继续进行组织胶注射,消除血管残腔。换镜治疗:更换胃镜(GIF-Q260J),食管静脉曲张采用套扎治疗(7 环套扎器,美国COOK 公司),从食管下段曲张静脉起始段开始螺旋向上套扎。

图1 前视超声内镜结构特征Fig.1 The structural features of forward-viewing echoendoscope
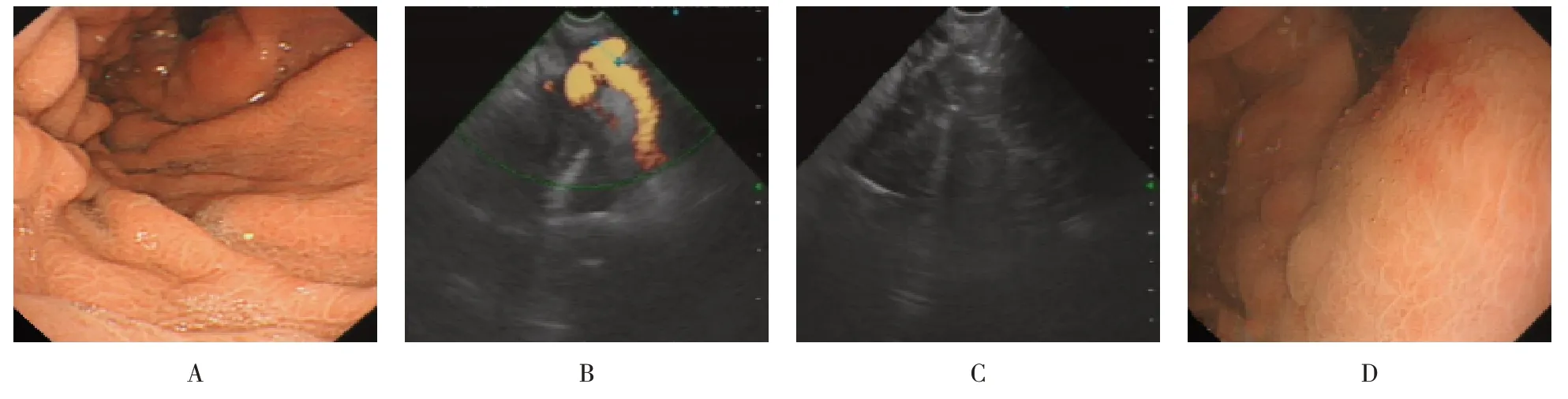
图2 前视超声内镜引导下治疗胃底曲张静脉Fig.2 The treatment of the varices in gastric fundus under the guidance of forward-viewing echoendoscope
1.3.2 对照组直接用胃镜(GIF-Q260J)治疗。胃部治疗采用改良的“三明治夹心法”,白光内镜下选择胃底最明显的曲张静脉作为靶静脉,并结合术前门脉CTA 估计组织胶用量后,注射聚桂醇+组织胶+聚桂醇(步骤同观察组)。EGV 采用套扎治疗,从食管下段曲张静脉起始段开始螺旋向上套扎。
1.4 术后处理
所有患者术后禁食水72 h,密切关注患者生命体征变化,积极给予对症和支持治疗,老年患者及合并基础疾病较多者给予心电监护。出院后逐一行电话随访,详细记录院外情况,必要时再次入院治疗。督促患者治疗后1个月来院复查。根据相关指南[6]及经验[7]评估治疗效果:①显著:曲张静脉减少50%以上;②一般:曲张静脉缩小25%~50%;③无效:曲张静脉缩小不足25%。
1.5 统计学方法
选用SPSS 21.0 统计软件分析数据。满足正态分布的计量资料以均数±标准差(±s)表示,组间比较行两独立样本t检验;不满足正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,组间比较采用两独立样本的非参数检验(Mann-WhitneyU秩和检验)和配对样本的Wilcoxon 符号秩和检验。计数资料以例表示,行χ2检验或χ2校正检验,有序分类资料采用两独立样本的非参数检验(Mann-WhitneyU秩和检验)。P<0.05 为差异有统计学意义。
2 结果
观察组通过超声内镜及白光内镜两种方式评估血管直径,超声内镜观察曲张静脉血管直径为7.5(6.0,7.8)mm,白光内镜观察曲张静脉血管直径为8.0(5.0,10.0)mm,两种方式差值约3 mm 的患者有3 例,差值超过5 mm 的有1 例,差异无统计学意义(Z=-0.81,P>0.05)。观察组组织胶注射次数及用量均明显少于对照组,两组患者比较,差异有统计学意义(P<0.05)。术后主要并发症有发热和胸痛等,给予相应对症治疗后均好转,两组患者总并发症发生率比较,差异无统计学意义(P>0.05)。术后72 h~3 个月,观察组总出血率为10.52%,与对照组的19.05%比较,差异无统计学意义(P>0.05)。术后1 个月所有患者复查胃镜,观察组中治疗效果显著、一般和无效的占比分别为63.16%、31.58% 和5.26%,与对照组的33.33%、38.10% 和28.57% 比较,差异有统计学意义(P<0.05)。见表2。
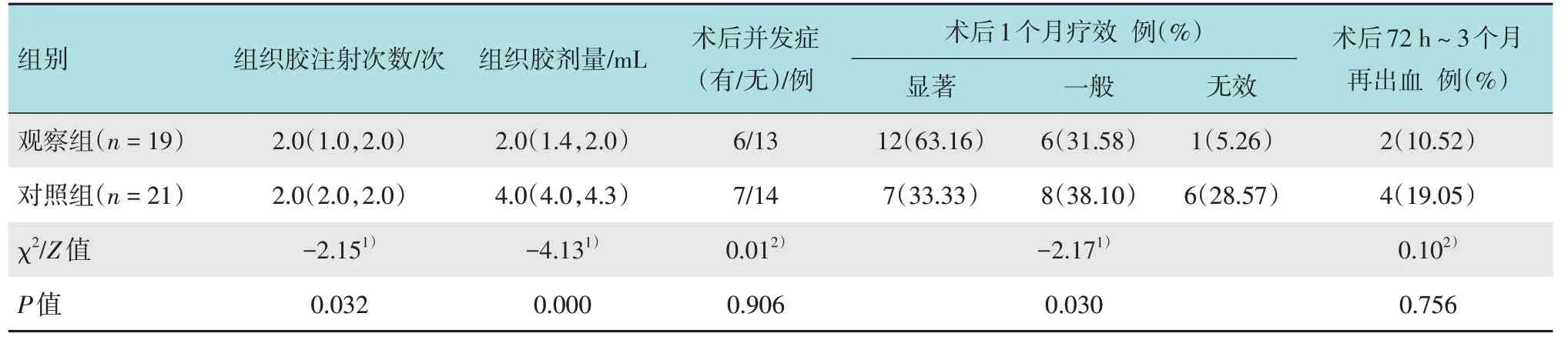
表2 两组患者术中及术后情况比较Table 2 Comparison of intraoperative and postoperative conditions between the two groups
3 讨论
随着诊疗技术的提高,EGV 破裂出血的死亡率较之前降低,但1年内再出血发生率仍为60.00%,死亡率高达33.00%[8]。不同类型及分级的EGV,选择的治疗点及组织胶用量不同。因此,对每位患者行超声内镜引导下EGV 程度评估,并制定个体化精准治疗方案,在临床工作中尤为重要。本研究比较了两组患者组织胶使用情况、术后并发症、治疗效果和再出血发生情况,结果显示:前视超声内镜治疗EGV可准确测量曲张静脉直经,估计组织胶用量,并将穿刺针精准刺入靶血管,与普通内镜相比,可提高治疗效果,临床应用价值高,值得进一步研究。本研究纳入的患者中,对照组PT 较观察组明显延长(P<0.05),因Child-Pugh 分级评分中包含PT,两组患者Child-Pugh分级无明显差异(P>0.05),所以认为:两组患者整体肝功能差异不大,具有可比性。
普通内镜在进行曲张静脉扫查时,存在一定的漏诊和误诊风险,若胃底黏膜粗大,轻度胃底曲张静脉难以与胃底黏膜皱襞区别[9];在EGV合并黏膜下肿物时,若未经超声内镜扫查而经验性地行黏膜组织活检,可能导致医源性大出血,这些都可通过超声内镜避免。对于内镜下多次治疗的患者来说,当存在溃疡或瘢痕时,选择最合适的治疗点也很困难,并且难以明确静脉曲张是否完全闭塞[10]。在超声内镜引导下进行组织胶注射时,可及时消除组织胶注射后的血管残腔,降低再出血率,减少不良反应的发生[11]。以往笔者在进行胃静脉曲张注射组织胶治疗时,选择从内镜下可见的较大曲张血管团开始注射,此时需要较多的组织胶行多点注射,增加了患者的经济负担,也提高了异位栓塞和术后排胶溃疡的发生风险。
据报道[10],穿支静脉是EGV 复发性出血的危险因素之一。穿支静脉可作为传入静脉,食管周围侧支静脉和食管旁侧支静脉通过穿支静脉参与黏膜下EGV 的形成。对门静脉高压EGV 患者行超声内镜扫查发现:食管周围静脉交通丰富的患者行套扎治疗后复发率较高[12]。因此,可对超声内镜扫查发现存在穿支静脉的食管静脉曲张患者,进一步行穿支静脉闭塞治疗。
内镜下食管胃静脉曲张精准断流术(endoscopic selective varices devascularization,ESVD)广受推崇,此法是用透明穿刺针,在贲门胃疑似曲张静脉处穿刺,寻找曲张静脉,见明显出血或回血时,再行曲张静脉内注射治疗[13]。注射完毕后,多点穿刺判断曲张静脉是否完全阻断,若穿刺点出血不止,则需再次选择穿刺点进行注射,但该方法在临床上推广应用较为困难。首先,穿刺曲张静脉选择注射点易引起医源性大出血,也易造成治疗后迟发性出血,危险性较大,对内镜中心综合治疗水平及内镜医师技术要求较高;其次,由于不能明确血管腔内组织胶填充情况,先要估计血管硬化程度,还要明确拔针后出血情况,以便进行胶量补充,可能存在残腔血流导致消除不全,后期出现排胶大出血。ESVD实行的最大困难是寻找血管来源支,其管径一般较小,位置深在,穿壁扭曲,并易被其他曲张静脉覆盖。超声内镜引导下食管胃曲张静脉精准断流术(EUS guided-selective varices devascularization,EUS-SVD)是超声内镜与ESVD 的有机结合,在超声内镜的实时引导下,对EGV 血管来源支进行准确穿刺和注射,实时观察血管腔及血流变化,精准治疗。前视超声内镜则以其独特的前端结构使EUS-SVD由理论走向实践。
综上所述,因胃底的特殊形态结构和超声内镜的弯曲度所限,部分患者行前视超声内镜引导下直接组织胶注射会存在盲区,中途需换用普通内镜完成胃底组织胶注射。故此,有待在今后不断升级和改进中,实现全程前视超声内镜下精准可视化治疗。
