不同生育期襄麦冬内生细菌的分布及产甾体皂苷菌株的初步筛选
2022-07-07余海忠王海燕殷幼平王中康
余海忠,程 旭,王海燕,殷幼平,王中康
1湖北文理学院食品科学技术学院,襄阳 441053;2重庆大学生命科学学院,重庆 405200;3襄阳市农业科学院,襄阳 441057
襄麦冬,即湖北麦冬Liriopespicatavar.proliferaY.T.Ma,为《中华人民共和国药典》(2010年版)山麦冬基源植物之一[1],甾体皂苷是其主要活性成分,它的皂苷元基本骨架属于螺甾烷(spirostane,共有27个碳原子组成)的衍生物,依照螺甾烷结构中C25的构型和F环的环合状态,可将其分为以下四种主要类型:螺甾烷醇类(C25为S构型)、异螺甾烷醇类(C25为R构型)、呋甾烷醇类(F环为开链衍生物)、变形螺甾烷醇类(F环为五元四氢呋喃环)。现已从襄麦冬中分离出14种甾体皂苷[2-4],其主要苷元是薯蓣苷元(diosgenin)和鲁斯可苷元(ruscogenin),均为C25(S)异构体,其中以山麦冬皂苷C(Ls-S3)含量较高[5]。甾体皂苷具有多重药理学活性[6,7],除了极少的能化学全合成,主要还是通过化学萃取中药材直接获得[8],襄麦冬甾体皂苷也不例外。但是由于存在生产周期长、大田连作障碍、皂苷含量低、提取成本高、环境污染大等问题[9],襄麦冬甾体皂苷的可持续生产和供应受到制约,因此,非常有必要寻找大量制备皂苷的新途径。
此前,有研究报道从滇重楼、华重楼中分离得到可产生甾体皂苷的内生细菌[10-13],受此启发,本课题组尝试从襄麦冬中分离和发掘代谢产生甾体皂苷的内生细菌菌株:利用纯培方法和16S rDNA-PCR-DGGE技术[14],分析和鉴定襄麦冬始见期、迅速膨大期、成熟采收期的样品(块根或须根)中内生细菌的分布。同时,采用颜色反应、TLC、HPLC方法,对获得的纯培菌株进行初步的产皂苷能力评价,以期获得目的菌株为实现甾体皂苷的“工厂化、规模化、快速化”生产提供理论支撑。
1 材料与方法
1.1 样品处理与表面消毒
襄麦冬样品分三次采集:2013年9月20日(块根始见期)、2013年11月28日(块根迅速膨大期)和2014年3月22日(块根成熟采收期),地点位于湖北襄阳欧庙襄麦冬GAP基地。选择茁壮植株的新鲜块根或须根,采集后立即带回实验室冲洗处理,在无菌条件下,将待处理样品(块根、须根)放入75%(V/V)乙醇浸泡2 min,用无菌水漂洗3次;有效氯含量4%~6%的次氯酸钠溶液浸泡2 min,用大量无菌水连续漂洗4次,并分别设置环境、漂洗和印记对照试验以检测表面消毒是否彻底。处理后的样品用无菌滤纸吸干水分,取一部分在3天之内完成可纯培内生细菌的分离操作,另取一部分置-80 ℃保存用于后续16S rDNA PCR-DGGE分析。
1.2 试剂与设备
主要试剂:有效氯含量4%~6%的次氯酸钠、正丁醇、乙醚、氯仿、浓硫酸、乙酸酐、AlCl3、75%乙醇、无水乙醇、二氨基乙基四乙胺、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、N,N,N′,N′-四甲基二乙胺、色谱纯乙腈(上海国药集团公司);薄层层析用硅胶G(青岛海洋化工厂分厂);CTAB、SDS、EDTA、TRIS碱、PVP、β-巯基乙醇、葡萄糖、琼脂、(上海生工)。PCR扩增试剂盒、标准分子量、琼脂糖、氨卞青霉素、PCR产物纯化试剂盒、引物、pMD-19T克隆载体(大连宝生物公司);细菌基因组DNA小量制备试剂盒、凝胶纯化回收试剂盒(Axygen公司)。
主要设备:YSQ-LS-30SII立式压力蒸汽灭菌器(上海博讯);HZ-9211K恒温振荡器(华利达);ChemiDoc XPS自动凝胶成像仪(Bio-Rad);AL204电子分析天平(梅特勒-托利多);GXP-9160MBE隔水式培养箱(上海博讯);GZX-9030MBE鼓风干燥箱(上海博讯);Mastercycler pro梯度PCR仪(Eppendorf);SIGMA 3K15低温冷冻离心机(Sigma);Power Pac HCTM电泳仪(Bio-Rad);FreeZone 12小型冷冻干燥机(Labconco);超低温冰箱(Thermo electron);MiliQ纯水机(Millipore);RE-52AA旋转蒸发仪(上海亚荣);核酸蛋白检测仪(Beckman);Shimadzu LC-20AT高效液相色谱仪(岛津)。
1.3 可纯培内生细菌的鉴定
1.3.1 菌株的分离与纯化
在无菌条件下,称取表面消毒样品组织1.0 g左右,加5 mL无菌水于研钵中充分研磨,将匀浆液按1×10-3倍数稀释之后,分别吸取0.2 mL涂布于牛肉膏蛋白胨培养基、PDA培养基、LB培养基平板,每个处理设置3个重复,37 ℃避光培养。随时观察平板,挑取生长良好的菌落,在牛肉膏蛋白胨培养基平板上作“Z”形划线,并根据菌落的颜色及形态,分别取呈现不同表形特征的菌落进行多次划线纯化,直至得到单菌落。菌株编号,转入PDA斜面37 ℃培养,待菌落长满试管后于4 ℃保藏、待用。
1.3.2 菌株DNA的提取
挑取上述单菌落接种于LB液体培养基中,根据不同菌落生长的特点,在37 ℃下180 r/min分别震荡培养7~12 h后取菌液2 mL,10 000 r/min离心5 min,去上清收集菌体。采用酶解法[15]提取内生细菌的基因组总DNA,DNA样品-20 ℃保存、待用。
1.3.3 16S rRNA基因的扩增与克隆
取上述提取的细菌总DNA为模板,以细菌16S rRNA基因通用引物进行PCR扩增[16]。PCR扩增产物用1%(W/V)的琼脂糖凝胶进行电泳分析,用凝胶成像仪检测。采用pMDTM19-T Vector作为克隆载体,按照KIT提供的操作步骤完成上述PCR扩增产物的连接、转化和阳性克隆的鉴定。阳性克隆转接于LB液体培养基,震荡培养12~16 h后将菌液送出测序。
1.4 内生细菌16S rDNA-DGGE分析
1.4.1 菌株基因组DNA提取
取上述-80 ℃保存的表面消毒样品,进行内生细菌基因组DNA的提取[16],洗脱得到的DNA溶解于TE,分装后-20 ℃保存待用。
1.4.2 菌株16S rDNA V6~V8区的扩增
为了避免植物样本中线粒体DNA与叶绿体DNA的干扰,本实验在进行内生细菌16S rDNA序列扩增时分为两个流程:先按照“1.3.3”项下方法扩增出细菌16S rDNA中的V5~V9高变区;再以V5~V9高变区的扩增产物为模板,采用Nested-PCR[17]来扩增16S rDNA的V6~V8区。扩增结束以后,取一定量的PCR产物进行2%琼脂糖凝胶电泳,检测是否为目的DNA片段,若有,用此PCR产物进行DGGE分析。
1.4.3 PCR-DGGE分离及条带分析
对上述PCR产物进行浓缩,采用DGGE系统进行电泳分离及条带分析[16],依次完成电泳分离、银染、拍照,使用QuantityOne-1-D软件标出图谱中较清晰的条带,并切下对应的条带,分别捣碎后加入20 μL ddH2O于-20 ℃过夜,最后以上清液为模板进行PCR扩增和电泳检测,切割并回收目的DNA条带,送出测序。
1.5 序列比对
将上述菌株16S rDNA的V5~V9区、V6~V8区序列测序结果,在NCBI数据库上进行BLAST比对分析,寻找同源性最高的序列进行种属鉴定。
1.6 产甾体皂苷内生菌株的筛选
1.6.1 菌株发酵液总皂苷提取物的制备
按照“1.3.2”项下方法完成菌株的液体震荡培养,将发酵液-80 ℃急冻后进行低温冷冻干燥,再按以下步骤完成菌株发酵液总皂苷的提取:冷冻干燥的发酵产物研成粉末,加入75%乙醇在60 ℃下抽提3 h,重复抽提两次,合并提取液,旋转蒸发得浸膏。浸膏加水溶解后,加入乙醚进行萃取,保留水层部分,再加入水饱和正丁醇萃取4次(15、10、5、5 mL),保留并合并正丁醇层部分。减压浓缩去除正丁醇后获得浸膏,即菌株发酵液总皂苷提取物。浸膏根据后续不同的检测需要,选择不同的溶剂进行溶解,分装后于-20 ℃保存待用。
1.6.2 发酵液总皂苷提取物的颜色反应
分别取上述菌株发酵液总皂苷提取物进行颜色反应,初步检测所提取的菌株发酵产物中是否含有皂苷。如果有,再判断其是属于甾体皂苷还是三萜皂苷(见表1)。

表1 内生菌株发酵液总皂苷提取物的颜色反应
1.6.3 发酵液总皂苷提取物的TLC检测
阳性对照的制备:称取襄麦冬块根粉末10 g,加入100 mL甲醇,80 ℃索氏提取3 h至无色,对提取液进行减压浓缩,得浸膏,后续提取步骤与“1.6.1”项下方法相同,最终获得襄麦冬总皂苷提取物,用2 mL甲醇溶解,即获得阳性对照。
TLC检测:将上述提取的菌株发酵液总皂苷提取物配成甲醇溶液,取10 μL点样于G型硅胶板上,设置阳性对照。层析液为氯仿-甲醇(100∶1),显色液为15%硫酸乙醇溶液,105 ℃烘3 min,直至显出清晰红色斑点为止。
1.6.4 发酵液总皂苷提取物的HPLC检测
色谱条件:检测器:SPD-20A;柱温箱:CTU-10AS 并配有在线脱气机DGU-20A;色谱柱:Inert Sustain C18(250 mm×4.6 mm,5 μm)。流动相:A水,B乙腈;梯度洗脱(0~25 min,5%B→30%B;25~35 min,30%B→55%B;35~45 min,55%B→65%B;45~55 min,65%B→85%B;55~70 min,85%B→100%B;70~75 min,100%B;75~75.5 min,100%B→5%B;75.5~80 min,5%B)。流速1 mL/min,检测波长为210 nm,进样量10 μL,记录80 min数据,信号强度单位为μV。
2 结果与分析
2.1 可纯培襄麦冬内生细菌的分离及鉴定
通过传统的细菌分离纯化方法,本实验完成对不同生育期襄麦冬块根和须根的初步分离,获得50株可纯培的内生细菌,其中28株来自须根,22株来自块根。观察记录它们的菌落形态特征,并对其16s rRNA基因进行扩增、测序、BLASTn比对,具体结果见表2。根据菌落形态,并结合序列比对结果,初步表明:上述50株内生细菌分属15个属22个种。其中,芽孢杆菌属Bacillus、葡萄球菌属Staphylococcus各分离出4种菌,假单胞菌属Pseudomonas分离出2种菌,其余的12个属,包括沙门氏菌属Salmonella、肠杆菌属Enterobacter、假黄单胞菌属Pseudoxanthomonas、摩根菌属Morganella、农杆菌属Agrobacterium、微杆菌属Microbacterium、产卟啉杆菌属Porphyrobacter、不动杆菌属Acinetobacter、赖氨酸芽孢杆菌属Lysinibacillus、鞘氨醇单胞菌属Sphingomonas、鞘氨醇杆菌属Sphingobacterium、短小杆菌属Curtobacterium,每个属只有1种菌。
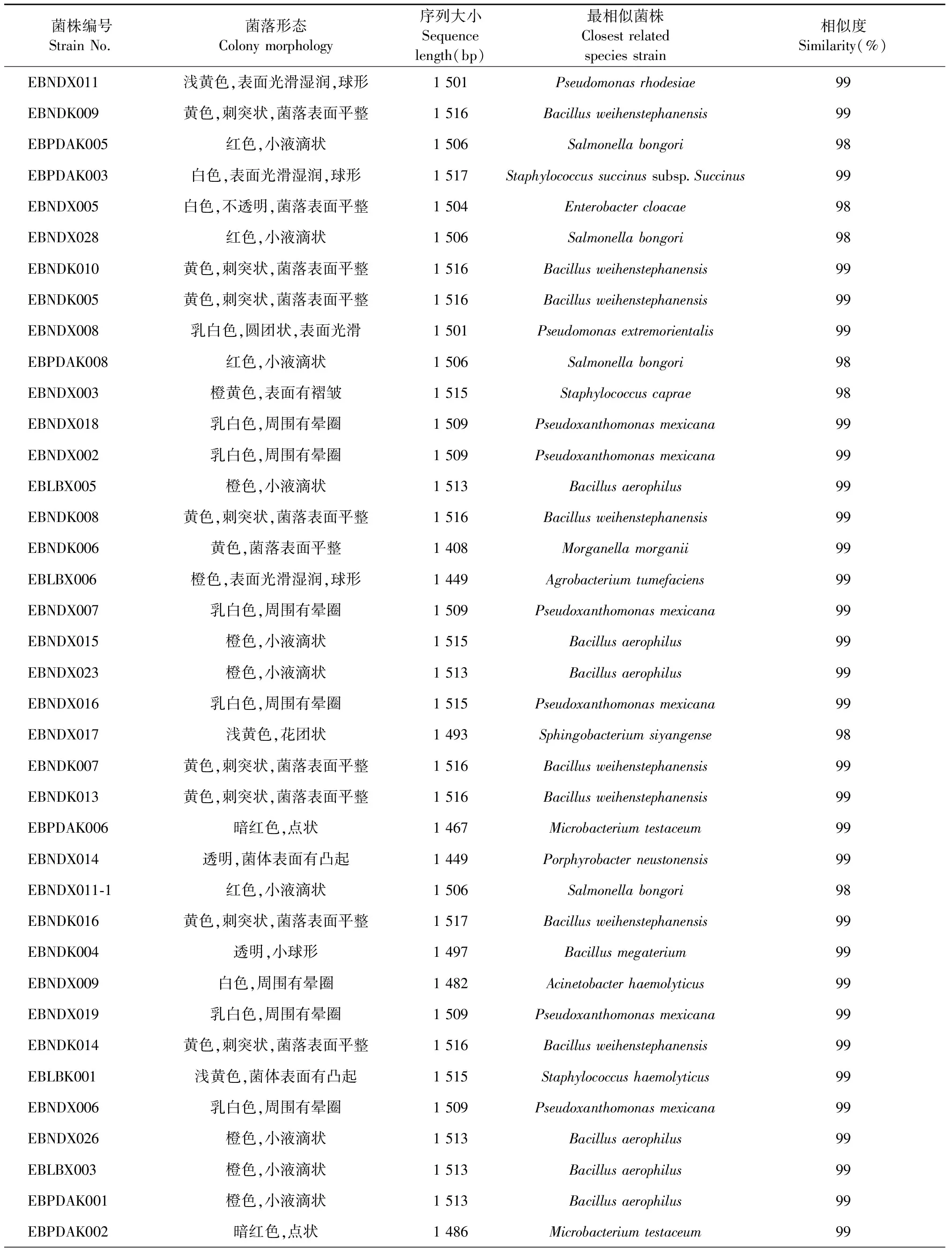
表2 襄麦冬可纯培内生细菌的形态特征及其16s RNA基因序列比对结果
上述完成鉴定的22种内生细菌分别为:韦氏芽胞杆菌Bacillusweihenstephanensis(Accession登记号:KC329820),嗜气杆菌Bacillusaerophilus(Accession登记号:KC329821),巨大芽孢杆菌Bacillusmegaterium(Accession登记号:KC329822),尼尔森杆菌Bacillusnealsonii(Accession登记号:KC329823),琥珀葡萄球菌琥珀亚种Staphylococcussuccinussubsp.Succinus(Accession登记号:KC329824),山羊葡萄球菌Staphylococcuscaprae(Accession登记号:KC329825),溶血性葡萄球菌Staphylococcushaemolyticus(Accession登记号:KC329826),表皮葡萄球菌Staphylococcusepidermidis(Accession登记号:KC329827),罗氏假单胞菌Pseudomonasrhodesiae(Accession登记号:KC329817),极端东方化假单胞菌Pseudomonasextremorientalis(Accession登记号:KC329818),邦戈尔沙门氏菌Salmonellabongori(Accession登记号:KC329819),墨西哥假黄单胞菌PseudoxanthomonasMexicana(Accession登记号:KC329828),根癌土壤杆菌Agrobacteriumtumefaciens(Accession登记号:KC329829),柠檬色短小杆菌Curtobacteriumcitreum(Accession登记号:KC329830),纺锤形赖氨酸芽孢杆菌Lysinibacillusfusiformis(Accession登记号:KC329831),溶血不动杆菌Acinetobacterhaemolyticus(Accession登记号:KC329832),浮游产卟啉杆菌Porphyrobacterneustonensis(Accession登记号:KC329833),砖红色微杆菌Microbacteriumtestaceum(Accession登记号:KC329834),阴沟肠杆菌Enterobactercloacae(Accession登记号:KC329835),韩国鞘氨醇单胞菌Sphingomonaskoreensis(Accession登记号:KC329836),泗阳鞘氨醇杆菌Sphingobacteriumsiyangense(Accession登记号:KC329837),摩氏摩根菌Morganellamorganii(Accession登记号:KC329838)。
2.2 内生细菌16S rDNA-DGGE图谱分析
2.2.1 内生细菌 16S rDNA的V5~V9、V6~V8片段的扩增
用通用引物扩增襄麦冬块根内生细菌16S rDNA V5~V9的4个高变区,得到两条条带,分别为730 bp和840 bp(见图1A),其中730 bp的条带为目的片段,进行切胶回收。以上述回收DNA片段为PCR扩增模板,用带GC夹的968F和1378R,扩增出大小为450 bp的V6~V8的目的片段(见图1B)。

图1 襄麦冬内生细菌16S rDNA高变区电泳图
2.2.2 内生细菌16S rDNA-DGGE图谱分析
对不同生育期的襄麦冬块根内生细菌进行DGGE图谱分析(见图2),结果表明:襄麦冬块根始见期、块根迅速膨大期和块根采收期这3个生育期采集的块根样品中,内生菌群结构基本相同,细菌类群差异很小。分别将分离的21个区分明显的条带割胶回收、测序比对,发现这21个序列分属15个属,共计21种不同细菌(见表3)。其中,芽孢杆菌属Bacillus、葡萄菌属Staphylococcus各有3种细菌,沙雷氏菌属Serratia、假黄单胞菌属Pseudomonas各有2种,其余的11个属,包括假单孢属Pseudomonas、果胶杆菌属Pectobacterium、鲍特氏菌属Bordetella、寡养单胞菌属Stenotrophomonas、产卟啉杆菌属Porphyrobacter、短小杆菌属Curtobacterium、肠杆菌属Enterobacter、甲基杆菌属Methylobacterium、固氮菌属Azotobacter、微杆菌属Microbacterium、假棍状杆菌属Pseudoclavibacter,均只有1种菌。DGGE所测结果与上述分离得到的22种可纯培内生细菌菌株相比,又增加了7个属:沙雷氏菌属Serratia、果胶杆菌属Pectobacterium、鲍特氏菌属Bordetella、寡养单胞菌属Stenotrophomonas、甲基杆菌属Methylobacterium、固氮菌属Azotobacter、假棍状杆菌属Pseudoclavibacter。

表3 DGGE条带序列比对结果

图2 襄麦冬内生细菌16S rRNA V6~V8高变区DGGE图谱
2.3 产甾体皂苷内生菌株的筛选
2.3.1 颜色反应筛选结果
根据Liebermann反应、Liebermann-Burchard反应、三氯乙酸反应以及氯仿-浓硫酸反应的需要,分别将上述制备的22株可纯培内生细菌发酵液总皂苷提取物,配制成不同溶剂的样品溶液。颜色反应结果表明:有3株细菌初步具有产甾体皂苷的特征,分别是砖红色微杆菌Microbacteriumtestaceum(EBPDAK002)、墨西哥假黄单胞菌Pseudoxanthomonasmexicana(EBNDX002)、山羊葡萄球菌Staphylococcuscaprae(EBNDX003),具体反应结果见表4。

表4 菌株发酵液提取物甾体皂苷颜色反应结果
2.3.2 TLC筛选结果
分别取上述3株内生细菌发酵液总皂苷提取物和襄麦冬总皂苷提取物的甲醇溶液,进行薄层层析分析。在展开剂的作用下,襄麦冬总皂苷最终跑出7个条带(目前,已从襄麦冬中分离出14种甾体皂苷分子[3],这表明本实验中襄麦冬甾体皂苷的提取条件以及TLC展开条件均有待继续优化),菌株 EBPDAK002、EBNDX002、EBNDX003分别跑出3、2、6个条带,TLC图谱表明(见图3),3个样品与襄麦冬总皂苷提取物均有相对应的条带,对应的迁移率Rf值也大致相同(见表5):与襄麦冬总皂苷提取物TLC条带相比,EBPDAK002有4个条带的迁移距离与其相近,EBNDX002、EBNDX003则各有1个条带相近。以上结果进一步证明了3株内生细菌具有产甾体皂苷特征。

表5 内生细菌发酵液总皂苷提取物TLC结果

图3 内生细菌发酵液总皂苷提取物TLC图谱
2.3.3 HPLC筛选结果
以提取的襄麦冬块根总甾体皂苷为阳性对照,对上述3株内生菌发酵液总皂苷提取物进行HPLC梯度检测,结果进一步证明上述3种内生细菌具有自主代谢产生甾体皂苷的能力。由图4A可知,墨西哥假黄单胞菌的发酵液总皂苷,其样品过柱子以后,分别在3.15、15.98、54.85、57.64、75.19 min等时间点出现了与阳性对照对应的特征峰,表明该菌株能产生的甾体皂苷至少有5种与寄主植物的一样。由图4B可知,来自山羊葡萄球菌的样品,在4.42、15.98、20.73、57.64、75.19 min时间点也出现了5个特征峰与阳性对照一致;图4C则显示了砖红色微杆菌提取物样品在三个时间点即15.98、57.64、75.19 min出现了三个与阳性对照对应的特征峰。有趣的是,2种内生菌株均在15.98、57.64、75.19 min时间点出现了特征峰,这表明在它们代谢产生的甾体皂苷中,至少有3种是相同的种类。
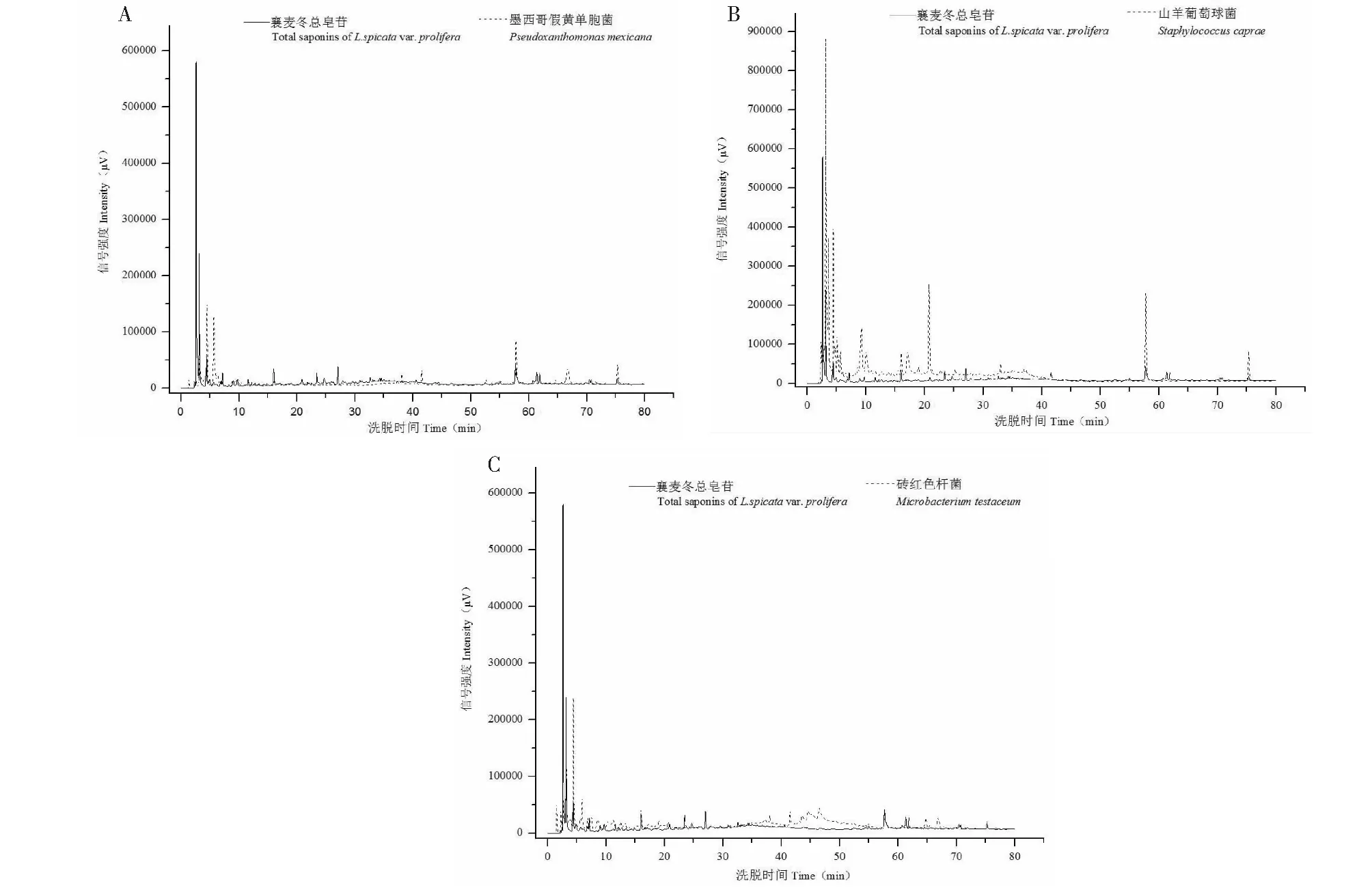
图4 内生细菌发酵产物总皂苷提取物的HPLC色谱图
3 讨论与结论
利用传统微生物纯培方法,本研究从不同生育期襄麦冬块根和须根中分离获得15属22种的内生细菌,其中芽孢杆菌属、葡萄球菌属各有4种菌,假单胞菌属有2种菌,其余的12个属,包括沙门氏菌属Salmonella、肠杆菌属Enterobacter、假黄单胞菌属Pseudoxanthomonas、摩根菌属Morganella、农杆菌属Agrobacterium、微杆菌属Microbacterium、产卟啉杆菌属Porphyrobacter、不动杆菌属Acinetobacter、赖氨酸芽孢杆菌属Lysinibacillus、鞘氨醇单胞菌属Sphingomonas、鞘氨醇杆菌属Sphingobacterium、短小杆菌属Curtobacterium,均只有1种菌。
通过16S rDNA-PCR-DGGE鉴定,本研究发现在襄麦冬的块根始见期、迅速膨大期、成熟采收期,其内生细菌群落结构基本相同,菌株类群差异很小。通过序列比对,从分离序列中鉴定出15属21种的细菌类群,其中芽孢杆菌属Bacillus、葡萄菌属Staphylococcus各有3种细菌,沙雷氏菌属Serratia、假黄单胞菌属Pseudomonas各有2种,其余的11个属,包括假单孢属Pseudomonas、果胶杆菌属Pectobacterium、鲍特氏菌属Bordetella、寡养单胞菌属Stenotrophomonas、产卟啉杆菌属Porphyrobacter、短小杆菌属Curtobacterium、肠杆菌属Enterobacter、甲基杆菌属Methylobacterium、固氮菌属Azotobacter、微杆菌属Microbacterium、假棍状杆菌属Pseudoclavibacter,均只有1种菌株。相比上述22株可纯培内生细菌,DGGE又新鉴定出7个属:沙雷氏菌属Serratia、果胶杆菌属Pectobacterium、鲍特氏菌属Bordetella、寡养单胞菌属Stenotrophomonas、甲基杆菌属Methylobacterium、固氮菌属Azotobacter、假棍状杆菌属Pseudoclavibacter。
本研究对可纯培内生菌株的产皂苷能力进行了评估,初步鉴定墨西哥假黄单胞菌Pseudoxanthomonasmexicana、山羊葡萄球菌Staphylococcuscaprae、砖红色微杆菌Microbacteriumtestaceum3株细菌具有明显产甾体皂苷特征。根据HPLC检测结果,这三株内生细菌均在15.98、57.64、75.19min时间点出现了特征峰,表明它们的发酵物中至少可能有3种皂苷是相同结构,这有待后续实验进一步证明。目前,对甾体皂苷类化合物的检测有两种主要策略:一种是直接检测,另一种是通过对裂解的皂苷元进行定性、定量分析来间接检测。有学者采用HPLC法先后对穿山龙[18]、箭根薯[19]、剑麻[20]、百合珠芽[21]中的薯蓣皂苷元进行了测定。本实验由于未获得襄麦冬甾体皂苷标准品和分离的纯品,暂用制备的襄麦冬块根甾体皂苷(混合物)作为阳性对照,通过比对相同检测条件下能否出现相同时间点特征峰的方式,初步鉴定了内生细菌的产苷特性,后续本实验室将进一步对发酵产物皂苷提取物进行分离纯化,采用质谱、核磁共振等手段进行更精确地表征。
根据16S rDNA V6~V8高变区DGGE分析结果,并结合可产甾体皂苷的可纯培内生细菌的筛选结果,本实验发现一个现象:在襄麦冬块根迅速膨大期和成熟采收期,均能从其块根中检测到墨西哥假黄单胞菌P.mexicana的存在,而始见期块根中却未能检测出。已经证实襄麦冬块根的生物量以及甾体皂苷的含量是从始见期开始逐步升高,会在迅速膨大期和成熟期采收达到顶点[22,23]。这种现象是不是意味着,墨西哥假黄单胞菌在襄麦冬块根甾体皂苷的累积中发挥着正相关的作用?这同样有待后续实验进一步证明。
