土壤来源链霉菌Streptomyces sp.CPCC 203679的次生代谢产物研究
2022-07-07张冰源柏菁璘余利岩戴胜军张德武
张冰源,汤 艳,郭 哲,柏菁璘,余利岩,戴胜军,张德武*
1烟台大学药学院,烟台 264005;2中国医学科学院&北京协和医学院 医药生物技术研究所,北京 100050
放线菌是发现新抗生素的重要资源,它可以产生结构类型多样的活性天然产物[1]。链霉菌属Streptomyces为放线菌的优势属,是放线菌中已报道有效发表种最多的属,其广泛分布于土壤、淡水、海洋以及一些生物体内。链霉菌以能够产生结构类型丰富多样的活性次级代谢产物而著称,是临床常用抗生素的重要来源,目前临床上应用的抗生素约三分之二是由该属微生物产生[2]。近年来,从链霉菌属中源源不断的报道了大量的结构骨架新颖和生物活性显著的次生代谢产物[3-6],表明从该属中发掘新的先导化合物仍具有巨大潜力。本课题组在前期生物活性筛选中发现了一株来源于土壤的链霉菌Streptomycessp.CPCC 203679,其发酵液粗提物具有良好的抗菌活性,本文采用多种现代色谱和波谱技术对该菌株的次生代谢产物进行了初步的分离纯化和结构鉴定,得到了9个化合物(见图1),并对化合物1~8进行了体外抗菌活性和细胞毒活性评价。

图1 化合物1~9的化学结构
1 材料与方法
1.1 仪器与试剂
Bruker ARX-600 MHz核磁共振波谱仪(瑞士Bruker公司);Thermo LTQ质谱仪(美国Themo公司);Agilent 1290高效液相色谱仪(美国Agilent公司);Agilent 1100高效液相色谱仪(美国Agilent公司);Waters 2535制备液相色谱仪(美国Waters公司);Combiflash Rf200快速纯化制备液相色谱(美国Teledyne Isco公司);步琦R210型旋转蒸发仪(瑞士Buchi公司);ZSD-1160生化培养箱(上海智城分析仪器制造有限公司);ZORBAX SB-C18分析型色谱柱(250 mm × 4.6 mm,5 μm);ZORBAX SB-C18半制备型色谱柱(250 mm × 10 mm,5 μm);甲醇、二氯甲烷、石油醚、乙酸乙酯、正己烷、正丁醇、无水乙醇、色谱乙腈、色谱甲醇(北京通广精细化工公司);反相C18硅胶(日本YMC公司);200~300目柱层析硅胶(青岛海洋化工厂)。
1.2 菌株来源
菌株Streptomycessp.CPCC 203679分离自浙江省杭州西溪湿地的土壤,通过对其16S rRNA基因测序发现其序列与菌株StreptomycesrocheiNRRLB 2410(T)、StreptomycesenissocaesilisNRRLB-16365(T)、StreptomycesplicatusNBRC 13071(T)的序列相似度均为99.86%,该菌株现保藏于中国药学微生物菌种保藏管理中心。
1.3 发酵培养
PYG培养基:蛋白胨3 g、酵母膏5 g、甘油10 g、琼脂14 g、甜菜碱1.25 g、丙酮酸钠1.25 g,加水定容至1 L。
种子及发酵培养基:葡萄糖10 g、可溶性淀粉30 g、棉籽粉20 g、酵母膏3 g、(NH4)2SO43 g、MgSO41 g、K2HPO41 g、NaCl 1g、CaCO31 g,加水定容至1 L。
将菌株CPCC 203679从其保藏的甘油管中接种于PYG斜面培养基,置于28 ℃恒温箱培养7~10天。选择生长状态良好的斜面继续在相同斜面培养基中复壮,待其生长状态良好时接种于种子培养基(100 mL培养基/500 mL三角瓶)中,28 ℃振荡培养48 h得到种子液。然后以10%浓度(V/V)接入5 L三角瓶(含2 L发酵培养基)中,于28 ℃培养5天收获。共发酵120 L。
1.4 提取分离
收集120 L发酵液,离心后分别收集菌体和发酵液上清。菌体用甲醇超声提取三次,浓缩后得菌体甲醇提取部分,然后均匀分散于水中,用乙酸乙酯萃取四次,得菌丝乙酸乙酯部分;发酵液上清用大孔吸附树脂HP-20吸附后,首先用去离子水冲洗,再用甲醇进行洗脱,减压浓缩后得到发酵液上清部分,然后用乙酸乙酯萃取四次,得菌液乙酸乙酯部分。将菌丝和菌液的乙酸乙酯部分合并,浓缩后得浸膏33.7 g。
将所得浸膏(33.7 g)用60~100目硅胶拌样,进一步进行正相硅胶柱(200~300目)层析,二氯甲烷-甲醇(100∶0→50∶50)梯度洗脱得15个流分(Fr.1~Fr.15)。流分Fr.4(10.8 g)经反相中压制备柱层析,乙腈-水(10%→100%)梯度洗脱,得34个流分(Fr.4.1~Fr.4.34);流分Fr.4.8(112.9 mg)经过半制备HPLC(乙腈-水,10∶90)纯化,得到化合物4(9.2 mg);流分Fr.4.10(204.6 mg)经过半制备HPLC(乙腈-水,10∶90)纯化,得到化合物8(13.4 mg);流分Fr.4.12(169.2 mg)经过半制备HPLC(乙腈-水,15∶85)纯化,得到化合物7(6.7 mg);流分Fr.4.15-16(248 mg)经过半制备HPLC(乙腈-水,15∶85)纯化,得到化合物1(43.8 mg);流分Fr.4.29(88.6 mg)经过半制备HPLC(乙腈-水,50∶50)纯化,得到化合物9(5.5 mg)。流分Fr.5(2.2 g)经反相中压制备柱层析,乙腈-水(10%→100%)梯度洗脱,得23个流分(Fr.5.1~Fr.5.23);流分Fr.5.5(56.2 mg)经过半制备HPLC(乙腈-水,5∶95)纯化,得到化合物2(18.9 mg);流分Fr.5.6(179 mg)经过半制备HPLC(乙腈-水,5∶95)纯化,得到化合物6(80.1 mg);流分Fr.5.16(17.7 mg)经过半制备HPLC(乙腈-水,30∶70)纯化,得到化合物3(2.9 mg)。流分Fr.10(0.97 g)经反相中压制备柱层析,乙腈-水(10%→100%)梯度洗脱,得化合物5(7.1 mg)。
1.5 抗菌活性测试[7]
采用微稀释法对所得到的化合物分别进行抗金黄色葡萄球菌(StaphylococcusaureusATCC 29213)和大肠埃希菌(EscherichiacoliATCC 25922)体外活性测定:将测试菌从冻存管中划线接种于营养琼脂平板活化,37 ℃培养,挑取其中3~5个单菌落至营养肉汤培养基,37 ℃培养6~8 h,将菌悬液调整至0.5 McF浓度(约为1 × 108CFU/mL),再使用MHB液体培养基进行20倍稀释,制成浓度约为5 × 106CFU/mL的菌悬液。在96孔板中,第1列不接种菌悬液仅加入MHB培养基作为空白对照。待测化合物使用MHB液体培养基根据二倍稀释法稀释至相应浓度后加入96孔板。第12列加入MHB培养基和菌悬液作为菌株阳性对照。样品终浓度分别为:64、32、16、8、4、2、1、0.5 μg/mL,96孔板置于37 ℃静置培养16~18 h后,未见菌株生长(肉眼未见浑浊)的孔板内所含化合物最小的浓度即为最低抑菌浓度(minimal inhibitory concentration,MIC)。
1.6 细胞毒活性测试[8]
采用MTT法对所得到的化合物进行细胞毒活性测试。人胰腺癌细胞系(MIA PaCa-2)细胞株体外培养于DMEM培基(含10%胎牛血清),在37 ℃、5% CO2及饱和湿度条件下培养;取等量细胞培养于96孔板中,24 h加药,将培养板置于37 ℃、5% CO2及饱和湿度条件的 CO2培养箱中,培养48 h后,每孔加入100 μL 1∶4倍稀释的MTT溶液,37 ℃继续孵育3.5~4 h,弃去上清液,每孔加入150 μL DMSO充分溶解甲臜,轻度震荡后,用酶标仪测定各孔490 nm条件下的吸光度,计算IC50值。
2 结果与分析
2.1 结构鉴定

根据HR-ESI-MS结果推测该化合物的分子式为C10H18O4。其13C NMR和DEPT谱显示,该化合物有10个碳信号,包括1个酮羰基δC209.4(C-5),1个酯羰基δC172.6(C-1),2个次甲基δC64.0(C-3)和27.0(C-8),4个亚甲基δC49.5(C-4)、42.3(C-2)、40.8(C-6)和31.8(C-7),2个甲基δC22.3(C-9,C-10)。通过1H NMR、13C NMR、DEPT和HSQC等波谱数据对所有的H和C进行了归属。在HMBC谱中(见图2),H-3和C-1、C-2、C-4、C-5相关,H-6和C-5、C-7、C-8相关,H-7和C-5、C-6、C-8、C-9、C-10相关;在1H-1H COSY谱中显示了H-2/H-3/H-4,H-6/H-7/H-8/H-9等相关信号。综合以上谱图信息,确定化合物1为3-羟基-8-甲基-5-氧壬酸,为新化合物,其结构如图1所示。化合物结构中仅含有一个叔醇(C-3),可以通过Rh2(OCOCF3)4-络合的CD谱来确定其绝对构型[9],在Rh2(OCOCF3)4-络合的CD谱中,350 nm处显示正的Cotton效应,确定其C-3的绝对构型为S。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。

图2 化合物1的COSY和HMBC相关
化合物2白色粉末;可溶于甲醇、二氯甲烷、氯仿等溶剂;ESI-MS:m/z180[M+H]+;1H NMR(600 MHz,DMSO-d6)δ:9.16(1H,s,9-OH),7.85(1H,t,J=6.0 Hz,NH),6.98(2H,d,J=8.4 Hz,H-7,H-11),6.67(2H,d,J=8.4 Hz,H-8,H-10),3.17(2H,m,H-4),2.56(2H,t,J=7.8 Hz,H-5),1.77(3H,s,H-1);13C NMR(150 MHz,DMSO-d6)δ:22.6(C-1),168.9(C-2),40.5(C-4),34.4(C-5),129.5(C-6),129.4(C-7),115.1(C-8),155.6(C-9),115.1(C-10),129.4(C-11)。以上数据与文献[10]中报道一致,故确定该化合物为N-[2-(4-对羟基苯酚)乙基]乙酰胺。
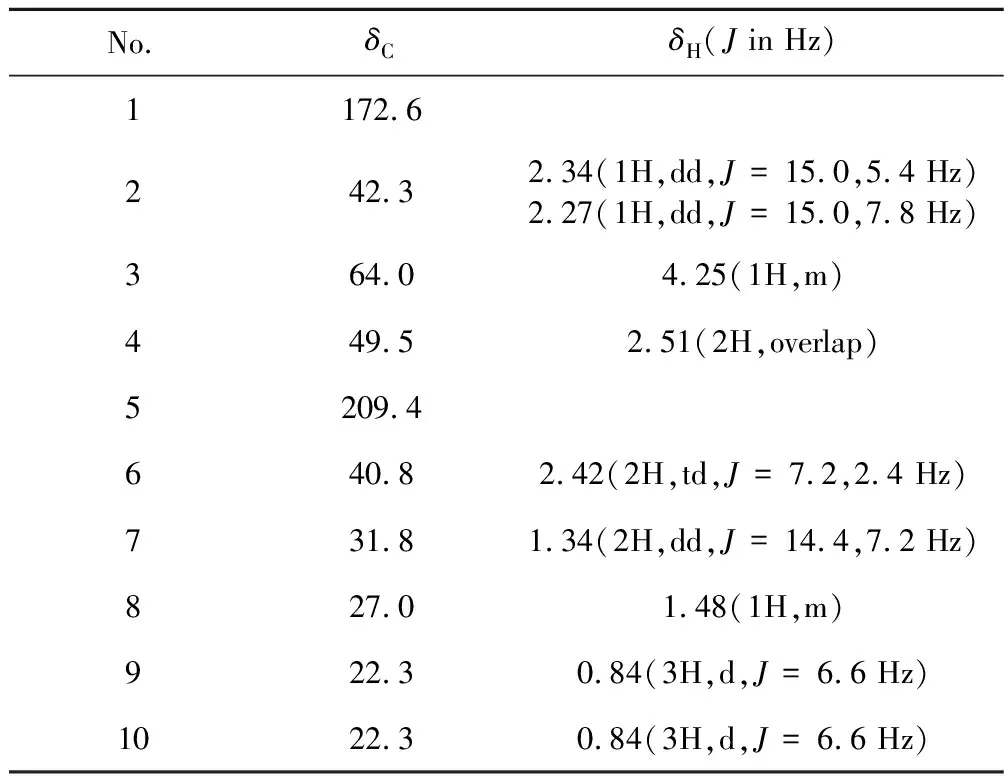
表1 化合物1的1H NMR(600 MHz)和13C NMR(150 MHz)数据(DMSO-d6)






化合物9无色油状;可溶于二氯甲烷、氯仿等溶剂;ESI-MS:m/z369[M+H]+;1H NMR(600 MHz,DMSO-d6)δ:7.18(1H,dd,J=15.6,9.6 Hz,H-11),6.27(1H,dd,J=21.6,9.6 Hz,H-10),6.24(1H,m,H-9),6.10(1H,d,J=15.6 Hz,H-12),4.03(1H,dd,J=11.4,4.2 Hz,H-1′a),3.89(1H,dd,J=11.4,6.6 Hz,H-1′b),3.62(1H,m,H-2′),3.34(1H,overlap,H-3′),2.54(2H,t,J=7.2 Hz,H-14),2.28(2H,t,J=7.2 Hz,H-2),2.17(2H,m,H-8),1.52~1.22(16H,m,H-3~H-7,H-15~H-17),0.85(3H,t,J=7.2 Hz,H-18);13C NMR(150 MHz,DMSO-d6)δ:172.9(C-1),33.4(C-2),24.4(C-3),28.5(C-4),28.4(C-5),28.3(C-6),28.1(C-7),32.4(C-8),145.3(C-9),129.0(C-10),142.7(C-11),128.1(C-12),200.2(C-13),40.0(C-14),23.5(C-15),30.9(C-16),21.9(C-17),13.8(C-18),65.5(C-1′),69.3(C-2′),62.6(C-3′)。以上数据与文献[18]中报道一致,故确定该化合物为2,3-dihydroxypropyl(9E,11E)-13-oxooctadeca-9,11-dienoate。
2.2 活性结果
化合物9为长链不饱和脂肪酸类化合物,据已有文献报道,脂肪酸类化合物在结构以及抗菌、抗肿瘤活性上无较大研究价值,故未对其进行活性测定。本文仅对分离得到的化合物1~8进行了抗金黄色葡萄球菌(StaphylococcusaureusATCC 29213)和大肠埃希菌(EscherichiacoliATCC 25922)的体外活性测试(见表2)。结果表明,所有化合物对这两株测试菌株均无明显的抑制活性(MIC > 64 μg/mL)。采用MTT法评价了本实验分离得到的化合物1~8对人胰腺癌细胞(MIA PaCa-2)增殖的影响,在50 μmol/L测试浓度下,所有化合物均未表现出明显的活性(抑制率低于50%)。

表2 化合物1~8的抗菌和细胞毒活性评价
3 讨论与结论
从土壤来源的链霉菌Streptomycessp.CPCC 203679的发酵物中分离得到了9个化合物,其结构类型包括脂肪酸、生物碱和环二肽等。化合物1为新的脂肪酸类化合物,化合物3为首次从土壤来源的链霉菌中分离得到。药理活性评价结果显示,化合物1~8未显示明显的抗菌和抗肿瘤活性。化合物2属于生物碱类化合物,该化合物广泛存在于放线菌、细菌、真菌等微生物中,如:Streptomyces[19]、Bacillus[20]、Aspergillus[21]、Alternaria[22]。化合物3属于吲哚生物碱类化合物,于1965年首次被报道,该化合物在Bacillus、Balansia、Edwardsiella等属中也有报道[12,23,24]。据文献报道,化合物3具有防污染的作用,对纹藤壶的幼虫具有一定的抑制作用,其ED50为18.6 μmol/L[25]。环二肽是自然界中最小的环肽,其广泛存在于植物、动物以及微生物的代谢产物中,具有抗菌、抗肿瘤、神经保护、抗血栓等方面活性[26]。本研究并未分离得到具有明显生物活性的次生代谢产物,可能是由于在当前的培养条件下,活性代谢产物的生物合成基因簇并没有被激活,或是因为活性代谢产物的产量太低而没有分离得到。后续我们将尝试优化培养条件来增加次生代谢产物的结构多样性,并进一步结合抗菌活性评价,获得结构新颖、活性显著的次生代谢产物。
