氧化沉降条件下草甘膦对福寿螺的急性毒性效应
2022-07-07梁冬霞李银诗李烁宇龚茂健钱久李黎华寿
梁冬霞,李银诗,李烁宇,龚茂健,钱久李,黎华寿
(1 广东省生态循环农业重点实验室/广东省现代生态农业与循环农业工程技术研究中心/农业部热带农业环境重点开放实验室/华南农业大学 资源环境学院, 广东 广州 510642; 2 广东工程职业技术学院, 广东 广州 510520)
福寿螺Pomacea canaliculata为原产于南美洲亚马逊河流域的一种大型淡水螺类,是隶属腹足纲Gastropoda瓶螺科Ampullariidae福寿螺属Pomacea的软体动物[1]。福寿螺生态适应性强,繁殖迅速,是一种耐污性强、分布广泛的入侵物种,直接危害农作物并严重威胁本地物种,影响湿地生物多样性,被列为我国重大危险性农业外来入侵生物之一,也是危害东南亚湿地河网地区农业的一种主要有害生物,对我国水稻等作物生产造成了严重威胁[2]。福寿螺还是后圆线虫、卷棘口吸虫Echinostoma revolutum和广州管圆线虫Angiostrongylus cantonensis的中间宿主和其他病菌、寄生虫的载体,对人体健康构成危害。因此,加强福寿螺入侵机制和有效防控技术的研究,保障农业生产、生态安全和人体健康,是业界和社会关注的热点课题。
草甘膦(Glyphosate)是孟山都公司在20世纪70年代初研发成功并问世的一种内吸传导型广谱灭生性有机磷类除草剂[3-4];当前全球范围内草甘膦用于大田作物的数量增加了约100倍[5],而导致草甘膦的生产和使用不断增加的一个重要原因是抗草甘膦除草剂的转基因作物及其种植面积不断增加[6]。草甘膦使用量的不断增加,对动植物、土壤、水体等都造成了不同程度的污染及影响。此外,草甘膦的不同配方对许多水生生物均有剧毒[7-9]。Sánchez等[10]研究发现,暴露在草甘膦配方下96 h后,草甘膦转运蛋白(RT)能够抑制多齿跳甲Jenynsia multidentata大脑和肌肉中的乙酰胆碱酶。廖艺钰等[11]研究草甘膦对斑马鱼Daniorerio的急性毒性和慢性毒性,结果表明草甘膦对斑马鱼为高毒且会显著抑制其乙酰胆碱酶的活性。Santadino等[12]研究发现,草甘膦在农业中的常规使用会显著抑制蚯蚓的生长与繁殖。此外,也有许多学者就草甘膦对生物的代际毒性进行了研究。Le Du-Carrée等[13]研究了环境相关浓度草甘膦及其协同制剂对暴露虹鳟鱼Oncorhynchus mykiss世代的影响,结果表明暴露于草甘膦一代诱导虹鳟鱼的发育毒性并增加病毒感染性。Wee等[14]采用多代试验方法,将跳尾龙Allonychiurus kimi暴露于草甘膦中,评估其F0、F1和F2三代的长期毒性效应,结果显示其半最大效应浓度(Concentration for 50% of maximal effect, EC50)分别为572.5、274.8和59.8 mg·kg-1。然而,我们前期研究发现,农田环境浓度的草甘膦对福寿螺的生长不仅没有产生毒害抑制,反而起到一定程度的生长促进作用,表现出草甘膦对福寿螺螺卵的孵化、幼螺的急性毒性以及对福寿螺生长的影响存在“低促高抑”的剂量效应现象,其中环境浓度的草甘膦能够促进福寿螺卵提前孵化;环境浓度甚至稍高浓度的草甘膦暴露处理福寿螺幼螺,5 d后发现其体内纤维素酶活性差异不明显,脂肪酶活性显著下降,淀粉酶活性有所提高,在155 mg·L-1的草甘膦条件下,淀粉酶的活性比对照高52.79%,对消化酶起到互补的作用,有利于福寿螺对草甘膦胁迫的适应[15]。由此可见,草甘膦对生物具有不同的影响效应。我们推测,福寿螺在响应环境压力和免疫时采用了能量补偿策略是其中的可能机制和原因,福寿螺可能利用神经激素调节机制刺激食欲并增进能量转化,以补偿对抗压力时的能量损耗;此外,在类似报道中提到福寿螺肠道微生物可能在苯环类物质的解毒和纤维素消化方面起到辅助作用,增强了福寿螺耐污、能量及营养吸收转化能力[16]。
当前,全球气候变化、大气氧化性污染有增加趋势[17],中国科学院王跃思和北京大学张远航院士团队基于对大气氧化能力(Atmospheric oxidation capacity,AOC)定量表征的方法,发现将气相化学和非均相化学结合起来能够更好地评估AOC,提出了现有大气化学机制的评估方法严重低估AOC的重要创新性结论,并指出氧化性污染已成为大气污染的重要方面[18]。大气氧化性物质沉降普遍存在、成因复杂、来源多样、浓度不同、影响复杂,并以过氧化氢等活性氧物质最具代表性。近十年来,我国逐步推行严格的大气污染排放管控“蓝天保卫战”措施,SO2和NOx的排放得到较有效的控制,PM2.5浓度下降,但我国东部近地面的O3浓度快速增加,尤其是夏季,东部地区呈现强的大气氧化能力,成为空气污染最突出的污染因子,并导致干湿沉降的氧化性加强[19]。大气圈和天然水体中,H2O2的浓度较单线态氮、羟基自由基等活性氧高且较稳定。前期有研究发现,地表水和大气降水中都存在一定量的H2O2[20-24]。活性物质H2O2与天然水中发生的光化学反应、氧化还原反应关系密切,是影响化学物质在水环境中迁移、转化归宿和生态效应的重要因素[25]。而在除草剂使用量增加、污染日益普遍的今天,探究氧化性沉降与除草剂双重氧化胁迫对福寿螺生长与扩张的效应及其机制,对认识福寿螺的入侵生物适应机理与扩张机制,丰富污染生态学与入侵生物学机制,具有理论和实际意义。
1 材料与方法
1.1 动物的收集与饲养
福寿螺(生长大小相对均匀的成年福寿螺,平均质量约10.09 g)于2020年11月采自华南农业大学增城基地 (23°14′26″N,113°37′48″E),采回后暂养于华南农业大学生态农场中,备用,以番薯Ipomoea batatas新鲜嫩叶作为饲养原料。
试验在54 cm ×41 cm ×24 cm蓝色塑料盒中进行,顶部白天自然光,夜晚用黑色遮阳网罩住顶部,试验用水为曝气后的市政引用自来水,曝气除氯自来水为空白对照(CK),pH 5.2~9.5,氧化还原电位(Oxidation-reduction potential,ORP)为 330~550 mV,试验温度为(24.5±1)℃,溶解氧(Dissolved oxygen, DO)质量浓度≥5 mg·L-1。为防止摄食对试验造成影响,试验过程不投食,不换液。
试验所用仪器有:UV-7 504型单光束紫外可见分光光度计,购自上海欣茂仪器有限公司;酶标仪(Multiskan Mk3型),购自赛默飞世尔(上海)仪器有限公司;Ultra Pure UF型和泰凯弗隆实验室纯水系统,购自上海和泰仪器有限公司;TGL-16M型高速离心机,购自长沙平凡仪器仪表有限公司;CU420型电热恒温水箱,购自上海一恒科技有限公司;SX-620笔式pH计,产自上海三信仪表厂。
1.2 样品的配制
草甘膦(Glyphosate,质量分数为98%,购于上海安谱科技有限公司),使用前先配制1 g·L-1的草甘膦水溶液作为母液,用棕色瓶置于4 ℃冰箱中避光保存。过氧化氢(H2O2,体积分数为30%),使用前先配制母液,H2O2母液的浓度为 5 000 μmol·L-1(吸取1.3 mL H2O2溶于水,并定容至250 mL)。
1.3 测定方法
1.3.1 半致死浓度(LC50)的测定 在预试验基础上,设定草甘膦质量浓度梯度为20、40、80和100 mg·L-1;基于前期研究[26],按静水式生物测试法,在广州地区水稻生育期对降水中H2O2连续监测,其平均浓度为 39.7 μmol·L-1,本研究中 H2O2浓度则固定为50 μmol·L-1。每处理组设置3个重复盒,每盒投放试验福寿螺10只。每个盒中的水体体积为3 L,每24 h测定水体中pH、氧化还原电位、溶解氧的变化,并观察福寿螺中毒症状。中毒后若经多次刺激无反应则判定为死亡螺,并将其从盒中移出,记录24、48、72和96 h螺的死亡数,求出半致死浓度(LC50)。死亡鉴定:用解剖针轻刺静止不动的福寿螺的腹足,若腹足对刺激没有反应,则认为螺已死亡。
1.3.2 酶活性测定 试验96 h后,各浓度组和对照组分别随机取3只福寿螺,用解剖刀解剖福寿螺使其肉体与壳分离,将解剖的肉体样品称质量,随后放入离心管中,组织样本用预冷的生理盐水清洗,冰浴匀浆,匀浆液在4 ℃条件下、9 000~10 000 r·min-1离心30 min,取上清液备用。过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、脂肪酶(LPS)、淀粉酶(AMS)采用南京建成生物工程研究所试剂盒法测定活性。
1.4 数据处理
试验结果用Excel 2013进行处理,利用SPSS19.0软件分析数据并计算LC50。
2 结果与分析
2.1 氧化沉降条件下草甘膦对福寿螺水体环境的影响
2.1.1 氧化沉降条件下草甘膦对福寿螺水体中氧化还原电位的影响 不同暴露时间下水体氧化还原电位(ORP)变化如表1所示。单独草甘膦(无添加H2O2)作用下,氧化还原电位随着暴露时间的增加而上升;当添加H2O2时,氧化还原电位仍然随暴露时间的增加而上升。对比同一时间不同处理下氧化还原电位的变化:单独添加H2O2在24、48、72和96 h时氧化还原电位显著高于对照组(CK);当草甘膦浓度相同时,24 和48 h时有或无H2O2处理组的氧化还原电位无显著差异;72 h时各浓度处理组的氧化还原电位均存在显著差异,且有H2O2组高于相应单独草甘膦处理组;96 h、草甘膦质量浓度为100 mg·L-1时有或无H2O2处理组存在显著差异,其余质量浓度组无显著差异。
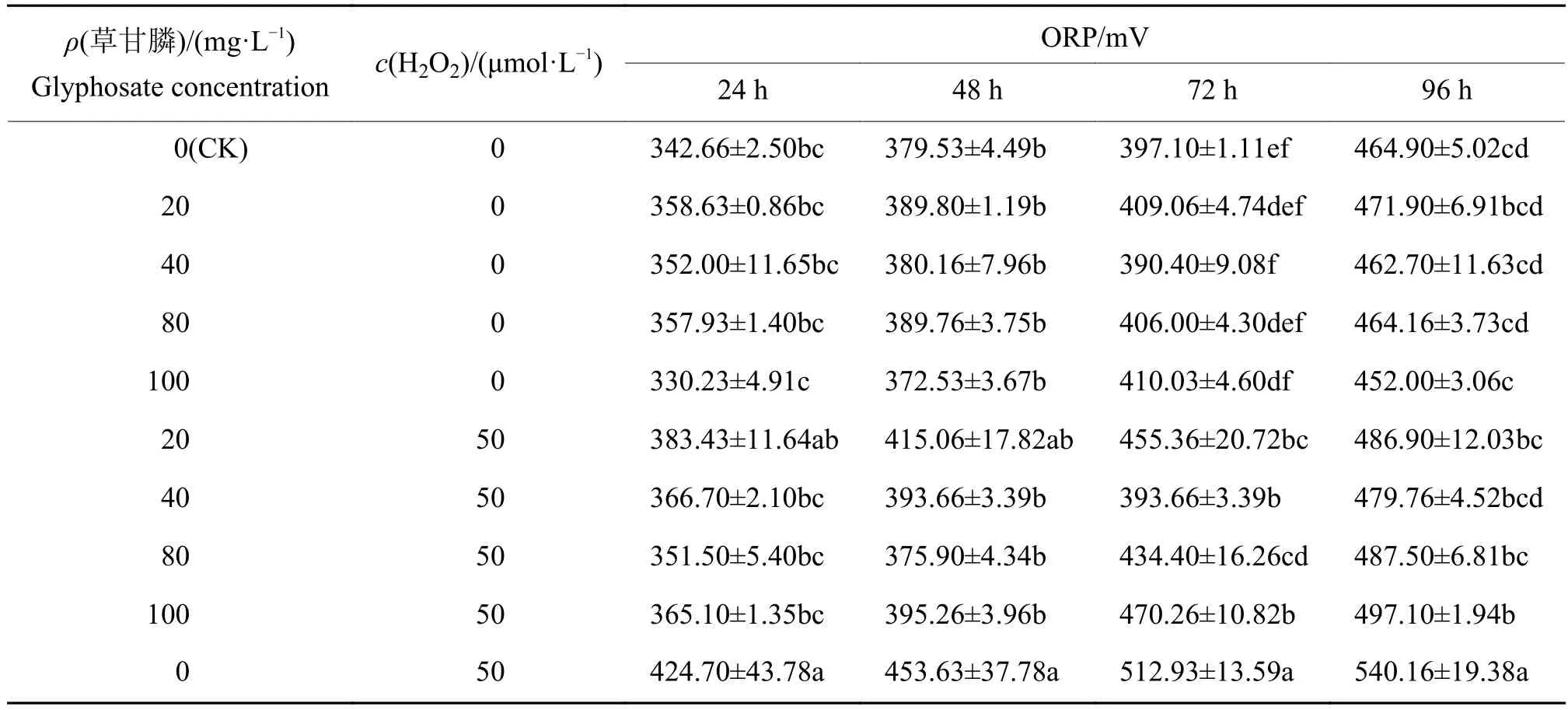
表1 不同处理下福寿螺水体氧化还原电位(ORP)的变化1)Table 1 Change of oxidation-reduction potential (ORP) for Pomacea canaliculata water habitat under different treatments
2.1.2 氧化沉降条件下草甘膦对福寿螺水体中溶解氧的影响 不同暴露时间下溶解氧(DO)变化如表2所示。由表2可知,单独草甘膦作用下,对照组及100 mg·L-1组溶解氧随暴露时间增加呈现下降的趋势,而20、40和80 mg·L-1组则随时间增加而上升;当添加H2O2时,单独H2O2、草甘膦质量浓度80和100 mg·L-1组溶解氧随暴露时间增加而下降,而20和40 mg·L-1组则呈上升趋势。同一草甘膦质量浓度时, 20 mg·L-1下有或无H2O2处理组在任意时间差异不显著;40 mg·L-1下有或无H2O2处理组存在显著差异;80 mg·L-1下有或无H2O2处理组在48 h时存在显著差异,其余时间差异不显著;100 mg·L-1下有或无H2O2处理组在24、48和72 h时存在显著差异,96 h时无显著差异。

表2 不同处理下福寿螺水体溶解氧(DO)含量的变化1)Table 2 Change of dissolved oxygen (DO) content for Pomacea canaliculata water habitat under different treatments
2.1.3 氧化沉降条件下草甘膦对福寿螺水体中pH的影响 福寿螺水体中pH变化如表3所示。由表3可知,单独草甘膦作用下,对照组(CK)pH随暴露时间增加呈现先增加后下降的趋势,其余处理组pH随暴露时间增加而上升;当添加H2O2时,单独H2O2组pH随暴露时间增加而下降,其余处理组pH随暴露时间增加而上升。同一草甘膦质量浓度时,20 mg·L-1下有或无H2O2处理组在48 h时pH存在显著差异,48、72和96 h时pH无显著差异,40 mg·L-1下有或无H2O2处理组在24、48和72 h时pH存在显著差异,96 h时pH无显著差异;80 mg·L-1下有或无H2O2处理组仅在24 h时pH存在显著差异;100 mg·L-1下有或无H2O2处理组在任一时间pH差异均不显著。

表3 不同处理下福寿螺水体pH的变化1)Table 3 Change of pH for Pomacea canaliculata water habitat under different treatments
2.2 氧化沉降条件下福寿螺对草甘膦的急性毒性响应
氧化沉降条件下福寿螺对草甘膦的急性毒性响应使用其急性毒性结果进行评估,其试验结果表明:不同浓度草甘膦处理下,单独或与H2O2共同作用均不能致福寿螺全部死亡。在最高质量浓度100 mg·L-1草甘膦处理下,有或无H2O2,福寿螺的死亡率均在各处理组中达到最大,观察到96 h后螺肉外翻出螺壳直接死亡。随着暴露时间的增加,各浓度处理下福寿螺出现个别死亡现象。但96 h后各个浓度的死亡率均小于35%,说明福寿螺在添加H2O2且高浓度草甘膦条件胁迫下也能绝大部分较好地生存下来,这与已有报道福寿螺对除草剂的生态适应性强、耐污性强[2]的说法一致。随着草甘膦浓度升高福寿螺中毒程度加深,死亡数会个别增多,甚至出现福寿螺个体的螺肉与螺壳分离的现象,中毒效应明显。
福寿螺对草甘膦急性毒性的半致死浓度(LC50)如表4所示。参照《化学农药环境安全评价试验准则》对水生物毒性等级划分如下(以96 h的LC50作为划分标准):LC50≤0.1 mg·L-1为剧毒,0.1< LC50≤1.0 mg·L-1为高毒,1.0<LC50≤10.0 mg·L-1为中毒,LC50>10.0 mg·L-1为低毒[27]。本试验结果表明,在添加和未添加H2O2时,草甘膦48 h的 LC50均为133.479 mg·L-1,为低毒。草甘膦是目前使用最多的除草剂种类之一,福寿螺对其响应的急性毒性为低毒,这可能与福寿螺本身抗逆性强有关。

表4 草甘膦对福寿螺的半致死浓度(LC50)Table 4 The 50% lethal concentration (LC50 ) of glyphosate to Pomacea canaliculata mg·L-1
2.3 氧化沉降条件下草甘膦对福寿螺SOD、AMS、CAT和LPS酶活性的影响
通过对受草甘膦污染96 h后的福寿螺进行酶活力测定,氧化沉降下草甘膦对福寿螺SOD、AMS、CAT、LPS酶活性影响如表5所示。在未添加H2O2时,96 h后福寿螺体内AMS活性随着草甘膦浓度的升高没有明显的上升或下降;而SOD、CAT、LPS 活性在 20、40 mg·L-1草甘膦时相对CK有所升高,到80 mg·L-1草甘膦时又呈现一定的下降趋势,100 mg·L-1草甘膦时CAT活性又有所升高,但各处理间差异均不显著。CAT和SOD是生物体内重要的保护酶,它们能够消除细胞中多余的自由基,从而防止自由基对自身的伤害[28]。可见,高浓度草甘膦农药进入福寿螺生物体后酶活性呈现先诱导、再抑制、后再诱导的趋势,在染毒过程中福寿螺慢慢适应所处胁迫环境并不断提高抗逆性,在该逆境中顺利生存,这可能是福寿螺入侵后能得以生存并大量繁殖的原因。在添加H2O2时,96 h后福寿螺体内的AMS和LPS活性在单独过氧化氢组最高,而SOD和CAT活性在100 mg·L-1草甘膦+H2O2组最高;SOD、CAT活性随着草甘膦浓度升高呈现先诱导、再抑制、后再诱导的规律;AMS活性随草甘膦浓度升高呈现上升的趋势,但各处理间差异不显著;LPS活性在20 mg·L-1时比CK组升高约30%,随后略有下降,到100 mg·L-1时又呈现上升趋势,但其活性始终比CK组高,说明在添加H2O2后,福寿螺体内酶活性仍然呈现上升的趋势,这表明福寿螺本身具有很好的自我保护机制,从而使草甘膦对福寿螺的毒害不明显。同一浓度草甘膦处理下,对比添加与不添加H2O2时酶的活力,当草甘膦浓度相同时无论是否添加H2O2,福寿螺体内SOD、AMS、CAT、LPS的活性无显著差异,但CAT在最高浓度100 mg·L-1时添加H2O2组的活性显著高于不添加组,且高于其他处理组,说明CAT酶对氧化胁迫更为敏感。

表5 不同处理对福寿螺各种酶活性的影响1)Table 5 Effects of different treatments on activities of various enzymes for Pomacea canaliculata
3 讨论与结论
3.1 氧化沉降条件下草甘膦对福寿螺水体环境的影响
不同的水体pH会使福寿螺产生不同的抵御能力,当环境过酸或过碱时福寿螺会选择逃离或分泌黏液并关闭厣甲[29]。朱丽霞等[30]研究发现,当水体环境的pH在6.5~8.5的中性、弱酸和弱碱范围内时比较有利于福寿螺的存活、体质量增长以及产卵等。本研究中,随暴露时间的增加CK组pH先升高后下降,单独H2O2组则呈现下降的趋势,但最终所有处理组的pH均稳定在7.0~8.5,这为福寿螺生存提供了一个适宜的pH条件。水体的氧化还原电位可以反映水体中所有物质的宏观氧化还原性[31],氧化还原电位越高则说明该体系的氧化能力越强[32]。水气相互作用影响水体中CO2、O2分压,从而导致水体氧化还原电位的变化,当水体被搅动时会加快水气交换,可以快速改变水体中气体分压[31]。由于福寿螺的活动、进食等行为会对水体进行充分搅动,导致水体中溶解态悬浮物、沉积物等的增加,这是水体氧化还原电位增加的原因。氧化还原电位在一定程度上与水体中的溶解氧含量相关[32],氧化还原电位较低且有机质含量较高的水体在微生物氧化分解有机物过程中需要消耗大量的氧,导致水体的溶解氧含量发生变化[33]。本研究中随着暴露时间的增加氧化还原电位呈现增加的趋势,溶解氧在这个过程中有升高也有下降的趋势,产生这一现象的原因可能是微生物(如藻类等)、福寿螺在生存过程中不断消耗溶解氧进行代谢导致溶解氧降低,但是福寿螺的活动搅动水体从而使溶解氧又升高。总的来看,氧化沉降条件下的水体环境变化仍在福寿螺适应的范围内。
3.2 氧化沉降条件下福寿螺对草甘膦的急性毒性响应
草甘膦对于大多数水生动物均存在急性毒性效应[34]。此外,农药对螺的影响,以及农药富集对螺的影响与多种因素有关,如物种对农药的敏感性[35]、化学作用[36]和暴露时间[37]。Xu等[15]研究草甘膦对福寿螺幼螺的急性毒性的结果表明,对刚出生的幼螺,24和48 h的LC50分别为178.50和175.00 mg·L-1,说明草甘膦对幼螺的急性毒性是属于低毒的,且环境浓度的草甘膦能够促进福寿螺螺卵的提前孵化;刘昌平等[38]研究了4种常用除草剂对日本三角涡虫Dugesia japonica的急性毒性效应,结果表明草甘膦对日本三角涡虫的安全质量浓度为 7.64 mg·L-1,24~96 h 的 LC50为 41.78~27.97 mg·L-1,毒性等级为中等。天然水体中的农用化学品和环境浓度草甘膦会对水生生物造成一定风险。Cavalcante等[39]研究草甘膦对虹鳟鱼Oncorhynchus mykiss的毒性效应,结果表明草甘膦会对虹鳟鱼产生遗传毒性且会对其遗传物质造成损伤。Guilherme等[40]将鳗鱼Anguilla暴露于环境草甘膦浓度的水体中,3 d后鳗鱼的鳃和肝细胞的DNA链断裂。Cuhra等[41]以大型蚤为研究对象,将其暴露于亚致死量的草甘膦中,结果对大型蚤的生产、繁殖产生了负面影响。本试验以福寿螺为试验生物,通过对水体添加H2O2及草甘膦农药,探究氧化沉降条件下草甘膦对福寿螺的急性毒性效应,试验结果表明,无论是否添加H2O2,当添加不同浓度草甘膦后,福寿螺均有不同程度的死亡,且随着时间的推移死亡数增加,当草甘膦质量浓度达到100 mg·L-1时福寿螺的死亡率达到最大。在添加和未添加H2O2时 48 h 的 LC50均为 133.479 mg·L-1,草甘膦对福寿螺为低毒。因此,使用草甘膦与H2O2复合作用进行福寿螺防治是一个漫长且缓慢的过程。
3.3 氧化沉降条件下草甘膦对福寿螺 SOD、AMS、CAT和LPS酶活性的影响
SOD是一种消除生物体内活性氧的重要的抗氧化酶,是体内主要的保护酶[42]。CAT是一种能够有效消除各类自由基团从而能使细胞膜系统不受损伤并能催化底物氧化还原反应的酶,同时,CAT还能够提高免疫力、促进生物体健康等[43]。宋超等[44]就除草剂氟乐灵及其降解过程中生物氧化、化学氧化和化学与生物耦合氧化对斑马鱼氧化应激影响进行研究,结果表明,氟乐灵对斑马鱼的影响较小,而黄秀枝等[45]研究甲氨基阿维菌素对福寿螺的毒性,发现低浓度甲氨基阿维菌素下福寿螺肝脏SOD酶活性变化不大,中浓度下SOD在暴露24 h时酶活性达到最大值;短时间胁迫下,甲氨基阿维菌素对福寿螺CAT酶活性均呈现出激活作用,高浓度时激活作用更加明显。LPS是脂肪酶又叫做酰基甘油水解酶,是一种特殊的水解酶[46],其来源广泛,动物体内脂肪酶含量较多存在于脂肪组织和胰脏中[47]。AMS是一种重要的淀粉水解酶,其广泛分布在动植物和微生物体中[48]。罗明珠等[49]通过比较福寿螺和田螺Cipangopaludina chinensis的胃和肝脏中的淀粉酶和脂肪酶发现,福寿螺AMS和LPS的酶活性均明显高于田螺,福寿螺对淀粉类、脂肪类物质的消化能力比田螺高。
本试验通过对福寿螺添加氧化沉降物质H2O2及草甘膦农药,探究氧化沉降条件下福寿螺对草甘膦农药的酶活性影响。酶活性试验结果表明:高浓度草甘膦农药进入福寿螺生物体后,SOD、CAT、AMS、LPS在添加和未添加氧化沉降物质H2O2条件下其酶活性呈现先诱导再抑制然后又诱导的趋势,在染毒过程中福寿螺慢慢适应所处胁迫环境,不断提高抗逆性,在逆境中顺利生存。福寿螺在其生长发育过程中各种酶活性变化幅度大,这可能与其生长发育较快的特性相适应;其生长发育快时消化酶活性就会升高,相应的消化能力就会提高,从而使其获得更多的养分。这可能是福寿螺能很好地获取食物能量、快速生长、在逆境中成功入侵的原因之一[49],可见福寿螺入侵能力之强大,防治工作迫在眉睫。
我们的前期工作[15]和本文结果表明,草甘膦对福寿螺的毒害效应不明显,试图通过草甘膦除草的同时又抑制福寿螺的做法是无效和不现实的。但草甘膦的使用会危害水体中及周围环境的其他生物。Modesto等[50]研究发现,草甘膦会对鱼类产生毒害作用,会使鱼类血液中的血球容积增大,体内的抗氧化酶活性改变,红细胞和白细胞数量增加。Lajmanovich等[51]报道,草甘膦对水生动物鱼、虾、青蛙、蝌蚪等产生毒害,草甘膦施药48 h后使青蛙体内乙酰胆碱脂酶和谷胱甘肽酶活性降低,且蝌蚪在3.80 mg·L-1草甘膦处理下大量死亡。福寿螺的大量繁殖还会危害周围的水稻、空心菜等作物,何铭谦等[52]经过对广东省19个地级市调查发现,每年约有50%的稻田受到福寿螺的危害。Horgan等[53]调查访问厄瓜多尔瓜亚斯省正常经营水稻田的农民,2010、2011和2013年分别有43%、78%和100%户农民反映水稻受到福寿螺的危害。桑松等[54]就山坑螺Margarya melanioides和田螺作为指示生物监测茶园环境农药残留的研究表明,山坑螺对甲氰菊酯、敌敌畏和毒死蜱等有机磷类和拟除虫菊酯类农药比较敏感,具备作为其残留监测指示生物的潜力。而本文中福寿螺对草甘膦的相对高耐受性可能是其轻易入侵取代乡土螺类甚至得以暴发的一个重要原因。福寿螺的防治以及农药的安全使用对环境的发展至关重要,应该找出科学有效的综合防治的方法控制福寿螺的繁殖与扩张危害,而草甘膦的使用应该做到科学有效。
3.4 结论
氧化沉降条件下,水体环境主要水质指标的变化幅度仍在福寿螺适应的范围内;草甘膦对福寿螺48 h 的 LC50为 133.479 mg·L-1,其对福寿螺急性毒性效应为低毒,草甘膦与H2O2复合污染对福寿螺急性毒性影响并不显著。草甘膦对福寿螺酶活性影响呈现先诱导再抑制然后又诱导的趋势,SOD和CAT活性的升高使福寿螺增强了自我保护的能力;AMS和LPS活性的升高有助于福寿螺消化和获取能量的能力不断提高,使其能在该胁迫环境中顺利生存。在本试验中,有或无氧化沉降条件的影响,均不会显著影响草甘膦对福寿螺的急性毒性毒害作用和酶学防御机制,试图通过草甘膦除草的同时又抑制福寿螺是无效和不现实的。
