黄芪多糖及黄芪甲苷干预对脂多糖诱导的奶牛乳腺上皮细胞炎症的作用
2022-07-07樊嘉琦李宇思周学章
樊嘉琦,贾 芳,李宇思,周学章
(宁夏大学 生命科学学院, 宁夏 银川 750000)
奶牛乳腺炎是影响奶牛养殖业发展的重要疾病之一,奶牛乳腺炎发生时会导致乳腺组织的损伤,也会导致奶牛乳腺上皮细胞(Bovine mammary epithelial cells,BMECs)的存活率降低,牛奶中乳蛋白表达量减少[1]。研究发现,中药及中药提取物可提高细胞免疫活性,调动组织的自身防御机制,达到治疗乳腺炎的目的[2]。黄芪提取物黄芪甲苷(Astragaloside Ⅳ,AS-Ⅳ)、黄芪多糖 (Astragalus polysacharin,APS)因具有抗炎、抗菌、抗病毒、抗氧化、抗应激等多种活性被广泛报道[3-4]。AS-Ⅳ和APS是黄芪的主要活性成分,可通过清除自由基、降低炎症因子、保持Ca2+平衡等方式起到消炎作用。AS-Ⅳ可通过抑制细胞的氧化应激与炎症反应,减少氨对BMECs的破坏作用[5];APS可通过提高细胞中抗氧化酶的活性,抑制氧化应激因子的表达,以减弱过氧化氢(H2O2)诱导的BMECs的凋亡[6];奶牛乳房组织灌注APS注射液可有效抑制隐性奶牛乳腺炎的发病情况,并提高乳腺组织的免疫水平[7];使用添加APS的饲料饲喂奶牛可提高奶牛乳腺的免疫力,降低隐性乳腺炎的发病率[8];使用发酵的黄芪粉饲喂奶牛可显著提高牛奶中乳蛋白含量,降低奶牛乳腺组织中体细胞脱落数量[9]。上述研究表明APS能抑制隐性奶牛乳腺炎,并能提高动物的免疫力,但是系统的作用机制还不清楚,因此本文研究关于AS-Ⅳ、APS干预脂多糖(Lipopolysaccharides,LPS)刺激BMECs的炎症反应机制以及对β-酪蛋白表达的影响,以明确AS-Ⅳ、APS抑制BMECs炎症的作用机制。
1 材料与方法
1.1 试验细胞
BMECs由宁夏大学生命科学学院王东老师惠赠,培养在含10%(φ)胎牛血清和1%(φ)青链霉素的高糖培养基中,所有细胞均在含有5%(φ)CO2的37 ℃培养箱中培养。
1.2 主要仪器及试剂
GE化学发光检测仪(美国Promega公司),倒置显微镜(日本奥林巴斯公司),PCR仪(德国Eppendorf公司),Nanodrop2000超微量分光光度计(美国Thermo公司),荧光定量PCR仪IQ5、酶标仪(美国Bio-Rad公司)。
AS-Ⅳ、APS、LPS、青霉素、林可霉素、Hoechst 33342染色液、瑞氏-姬姆萨复合染液(北京索莱宝公司),β-Actin、Caspase-3、Caspase-8、Caspase-9 抗体 (Abcam 公司),TGF-β、ERK1/2、p-ERK1/2、β-酪蛋白抗体(北京博奥森公司),ELISA试剂盒(江苏酶免实业有限公司),CCK-8试剂盒(大连美仑生物技术有限公司)。
1.3 BMECs炎症模型建立
1.3.1 CCK-8检测LPS刺激BMECs的生物学活性 BMECs悬液以1×104个/孔的密度接种在96孔板中,培养24 h使细胞完全贴壁。试验分为对照组 (CK),试验组 (LPS 质量浓度为0.1、0.5、1.0、2.5、5.0、10.0 mg/L),空白组,孵育 6、12、18、24 h,每组设置6次重复。弃去培养基,在含10%(φ)CCK-8的培养液中避光孵育3 h,450 nm处测量光密度,并计算细胞存活率。
1.3.2 RT-qPCR检测LPS刺激BMECs的炎症因子变化 BMECs悬液以2×105个/孔的密度接种于6孔板中。试验分为对照组(CK)、试验组(LPS质量浓度为 0.1、0.5、1.0、2.5、5.0 mg/L)。使用Trizol法提取细胞总RNA。按照HiScript II Q Select RT SuperMix for qPCR(R232)试剂盒说明书步骤逆转录合成cDNA。按照ChamQ Universal SYBR qPCR Master Mix (Q711-03)试剂盒说明书步骤进行RT-qPCR。引物设计参考文献[10],具体见表1。

表1 细胞炎症因子基因表达变化 RT-qPCR引物Table 1 RT-qPCR primers for expression changes of inflammatory genes
1.3.3 观察LPS刺激奶牛BMECs的细胞形态变化
BMECs悬液以2×105个/孔的密度接种于6孔板中。试验分为对照组(CK)、试验组(LPS质量浓度为 0.1、0.5、1.0、2.5、5.0 mg/L)。加入 500 μL 瑞氏-姬姆萨染液初染2 min,加入1 mL的PBS缓冲液复染5 min,用PBS缓冲液洗掉染色液,在油镜下观察细胞形态。加入500 μL的Hoechst 33342染色液,37 ℃避光孵育20~30 min,用PBS缓冲液洗涤3次,最后用荧光显微镜观察并拍照。
1.4 AS-IV、APS、青霉素和林可霉素对BMECs生物学活性的影响
BMECs悬液以1×104个/孔的密度接种在96孔板中,培养24 h使细胞完全贴壁,每组设置6次重复。AS-Ⅳ CCK-8试验分为对照组(CK),AS-Ⅳ试验组 (AS-Ⅳ质量浓度为 12.5、25.0、50.0、75.0、100.0、150.0、200.0、300.0 mg /L)和空白组,孵育 1、2、3、4 h。APS、青霉素、林可霉素 CCK-8试验分为对照组(CK),APS试验组(APS质量浓度为 0.10、0.25、0.50、1.00、2.00 g/L),青霉素试验组 (青霉素质量浓度为 50、100、250、500、1 000 mg/L),林可霉素试验组(林可霉素质量浓度为50、100、250、500、1 000 mg/L)和空白组,孵育 1 h。试验方法同“1.3.1”。
1.5 AS-IV、APS干预对LPS诱导BMECs中LDH、MDA、ROS表达的影响
BMECs悬液以2×105个/孔的密度接种在6孔板中,培养24 h使细胞完全贴壁。试验分为9组,A组为阴性对照组(CK);B组为LPS刺激组;C组为LPS+1 g/L APS组;D组为LPS+50 mg/L林可霉素组;E组为LPS+50 mg/L青霉素组;F组为LPS+1%(φ)乙醇组;G 组为 LPS+50 mg/L AS-Ⅳ组;H 组为LPS+75 mg/L AS-Ⅳ组;I组为LPS+100 mg/L AS-Ⅳ组。收集处理组样品上清液,按照乳酸脱氢酶 (Lactic dehydrogenase,LDH)、丙二醛 (Malonaldehyde,MDA)和活性氧 (Reactive oxygen species,ROS)测定试剂盒说明书进行检测,每组设置3次重复。
1.6 AS-IV、APS干预对LPS诱导BMECs中炎症因子表达的影响
培养、处理细胞同“1.5”,试验方法同“1.3.2”。检测细胞中 IL-6、IL-8、IL-1β、TNF-α 炎症因子基因表达变化,引物见表1。另外,收集处理组样品上清液,3 000 r/min离心10 min。按照ELISA试剂盒说明书操作,检测细胞上清液中炎症因子的分泌。
1.7 AS-IV、APS干预对LPS诱导BMECs中凋亡因子表达的影响
培养、处理细胞同“1.5”,试验方法同“1.3.2”。检测细胞凋亡相关基因表达变化,引物设计参考文献[11],引物见表2。使用凯基全蛋白提取试剂盒提取细胞全蛋白,使用BCA法测定蛋白浓度。在含125 g/L分离胶、50 g/L浓缩胶的SDS-PAGE凝胶中进行蛋白电泳,将蛋白转移至PVDF膜。转膜完成后的PVDF膜转移至0.5%(w)的脱脂奶粉中,封闭4 h。一抗4 ℃孵育12 h,TBST缓冲液清洗3次。辣根过氧化物酶标记二抗,室温孵育2 h,TBST缓冲液清洗3次。使用ECL化学发光显色液曝光和拍照。Western blot法检测Caspase-3、Caspase-8、Caspase-9蛋白表达。
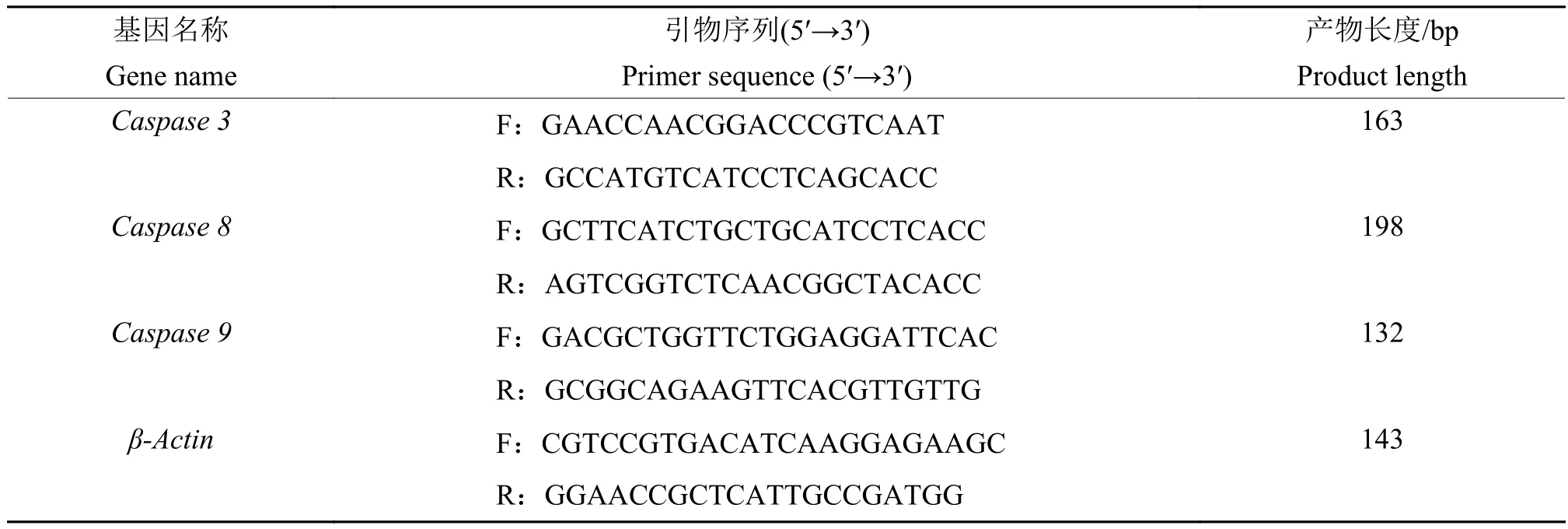
表2 细胞凋亡相关基因表达变化RT-qPCR引物Table 2 RT-qPCR primers for expression changes of apoptosis related genes
1.8 AS-IV、APS干预对LPS诱导BMECs中TGF-β、ERK1/2、β-酪蛋白表达的影响
BMECs悬液以2×105个/孔的密度接种在6孔板中,培养24 h使细胞完全贴壁。试验分为6组:对照组 (CK)、1g/L APS组、乙醇组 (φ为 1%)、50 mg/L AS-Ⅳ组、75 mg/L AS-Ⅳ组、100 mg/L AS-Ⅳ组,试验方法同“1.3.2”。检测细胞中TGF-β、ERK1/2、CSN2基因表达变化,引物设计参考文献[11],引物见表3。培养、处理细胞同“1.5”,试验方法同“1.7”,Western blot法检测 TGF-β、ERK1/2、β-酪蛋白表达。
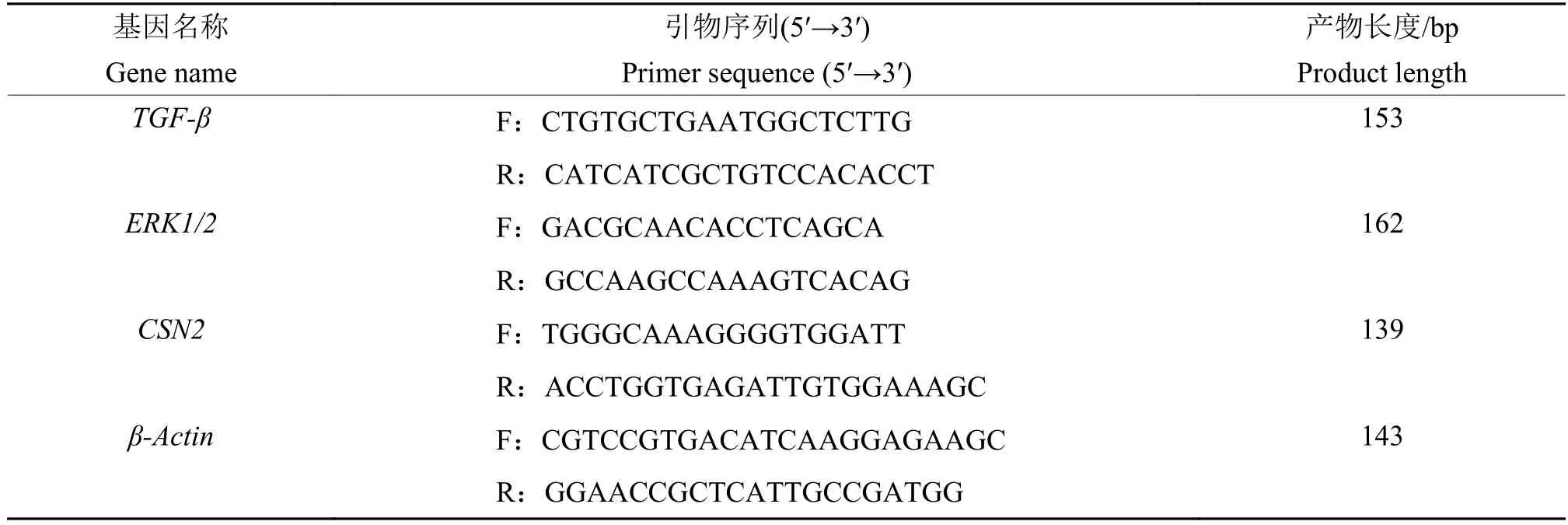
表3 TGF-β、ERK1/2、CSN2表达变化RT-qPCR引物Table 3 RT-qPCR primers for TGF-β, ERK1/2 and CSN2 expression changes
1.9 统计学分析
使用SPSS22.0软件对试验数据进行方差分析,所有试验均重复3次,数据均以“平均值±标准差”表示,P<0.05、P<0.01为差异显著。
2 结果与分析
2.1 BMECs炎症模型建立
通过CCK-8法检测LPS刺激BMECs的活性,结果如图1所示,随着作用时间的延长和浓度的升高,LPS对BMECs有明显的抑制作用,选取刺激时间24 h为后续试验基础。通过RT-qPCR检测LPS刺激BMECs中炎症因子IL-6、IL-8、IL-1β、TNF-α 表达变化,结果如图2所示,在 0.1~5.0 mg/L LPS刺激细胞 24 h时,IL-6、IL-8、IL-1β、TNF-α炎症因子基因相对表达量均显著升高(P<0.01)。之后分别通过瑞氏-姬姆萨染色和Hoechst 33342染色观察细胞形态及细胞核形态。LPS刺激细胞24 h时细胞形态及细胞核形态发生变化。细胞形态变化如图3a所示,与对照组相比,试验组中细胞核消失,细胞之间连接明显被破坏;2.5 mg/L LPS处理组细胞形态显著改变,细胞出现明显的凋亡小体。细胞核形态变化如图3b所示,与对照组相比,0.1、0.5 mg/L LPS处理组细胞核形态变为不规则圆形,1.0、2.5、5.0 mg/L LPS处理组细胞核出现断裂,随着LPS浓度的升高细胞核的断裂增多。将使用0.5 mg/L LPS刺激BMECs 24 h建立炎症模型。
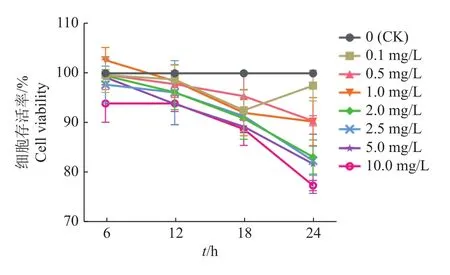
图1 不同LPS质量浓度和作用时间下BMECs生物学活性Fig. 1 BMECs bioactivities under different concentrations and action time of LPS
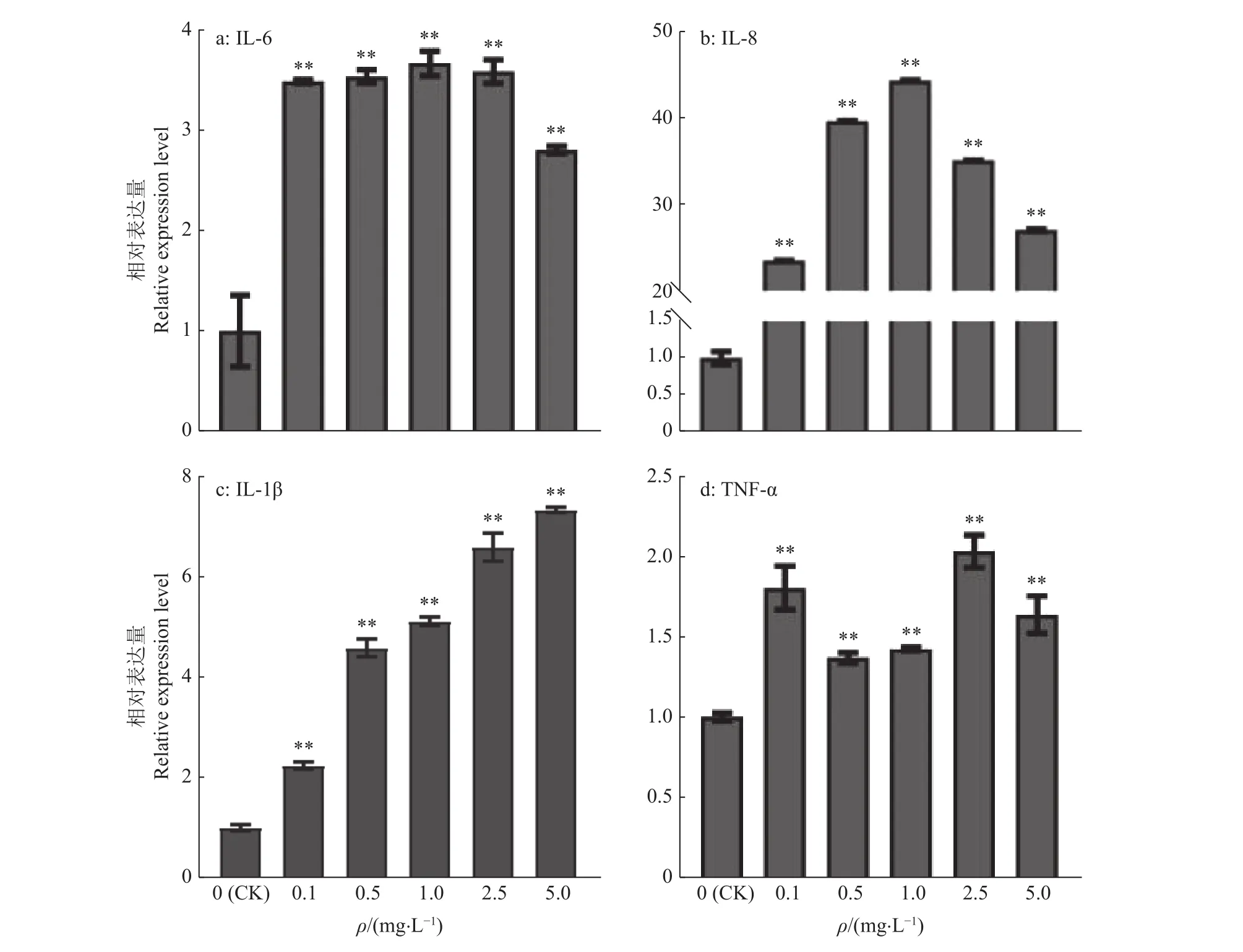
图2 不同LPS质量浓度对BMECs炎症因子基因表达的影响Fig. 2 Effects of different LPS concentrations on the gene expression of inflammatory factor in BMECs
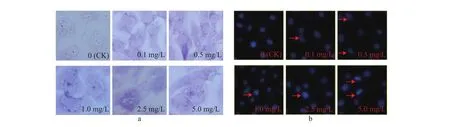
图3 不同质量浓度LPS刺激的BMECs细胞形态(a)及细胞核形态(b)变化Fig. 3 Cell morphology (a) and nuclear morphology (b) changes of BMECs stimulated by different concentrations of LPS
2.2 AS-IV、APS、青霉素、林可霉素刺激BMECs的生物学活性检测
CCK-8法检测AS-Ⅳ、APS、青霉素、林可霉素对BMECs生物学活性的影响。随着作用时间的延长和浓度的升高,AS-Ⅳ对BMECs有抑制作用,50、75、100 mg/L AS-Ⅳ作用1 h对细胞没有毒性,细胞存活率为 100%(图4a)。0.1、0.25、0.5、1 g/L APS作用1 h对细胞没有毒性,细胞存活率为100%(图4b)。50 mg /L青霉素(约86 U/mL)刺激细胞时,细胞存活率达到90%以上(图4c)。50 mg /L林可霉素刺激细胞时,细胞存活率达到90%以上(图4d)。将选取 50、75、100 mg /L AS-Ⅳ,1 g/L APS,50 mg /L(86 U/mL)青霉素,50 mg /L林可霉素,作为后续试验的基础。
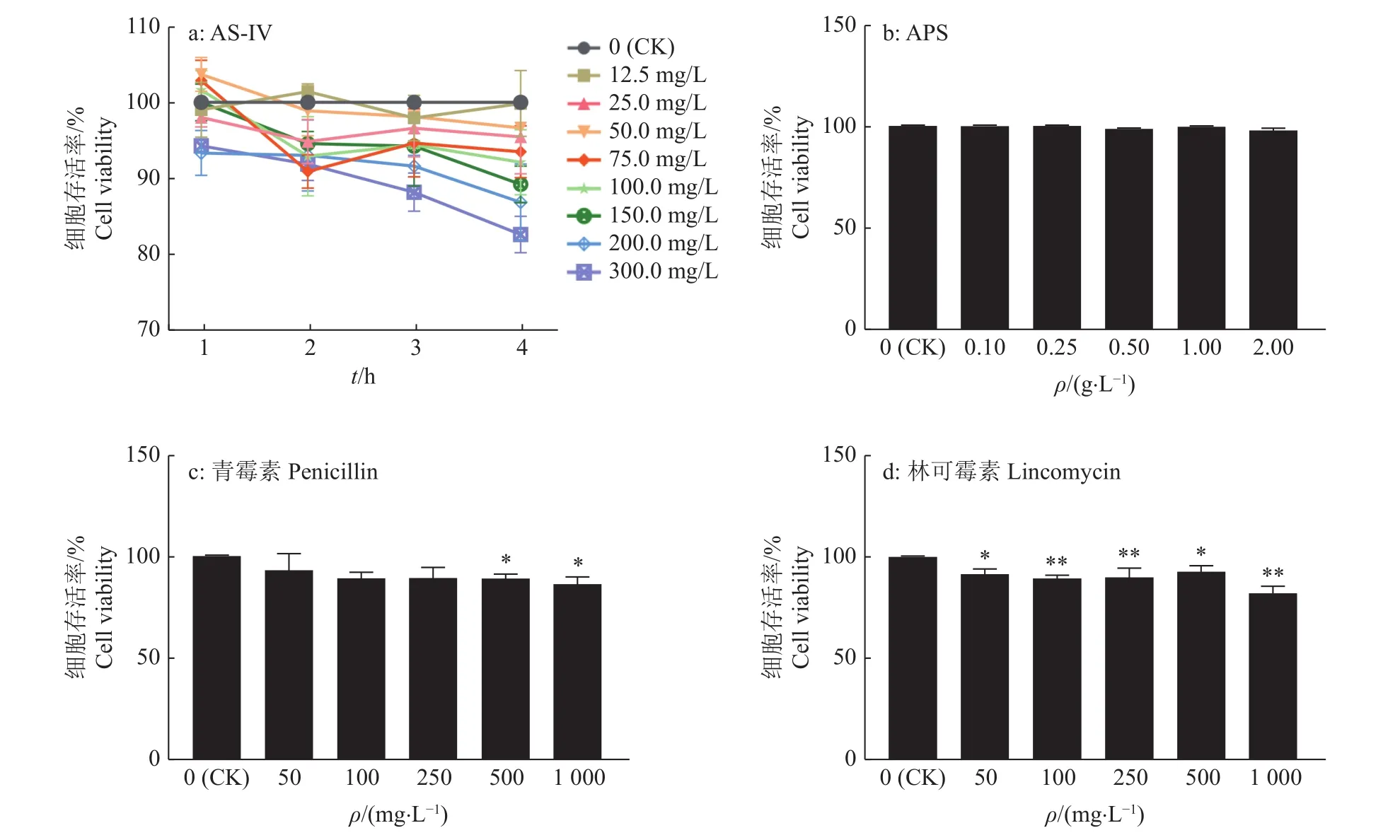
图4 AS-IV、APS、青霉素、林可霉素对BMECs存活率的影响Fig. 4 Effects of AS-IV, APS, penicillin and lincomycin on the viabilities of BMECs
2.3 AS-IV及APS干预对LPS刺激BMECs损伤的影响
LDH的表达量可反映细胞膜被破坏程度;MDA是细胞中自由基和脂质发生氧化反应产生的最终产物,可直接反映脂质过氧化程度;ROS是线粒体有氧代谢时的副产物,一般在细胞中保持平衡状态,当其失去平衡时会导致细胞氧化损伤[12]。LDH、MDA、ROS表达分别见图5a、5b、5c。与对照组(A组)相比,LPS(B组)显著激活细胞中LDH、MDA、ROS的表达(P<0.01)。AS-Ⅳ、APS、林可霉素、青霉素均能显著抑制炎症细胞上清液中LDH的分泌(P<0.05或P<0.01),其中 100 mg/L AS-Ⅳ(I组)和1 g/L APS(C 组)对LDH的抑制效果最佳;4种药物均可显著抑制炎症细胞中MDA的表达(P<0.01),其中100 mg/L AS-Ⅳ(I组)对MDA的抑制效果最好。AS-Ⅳ、APS、青霉素能显著抑制炎症细胞ROS的表达(P<0.05或P<0.01),其中 APS(C 组)的抑制效果最佳。
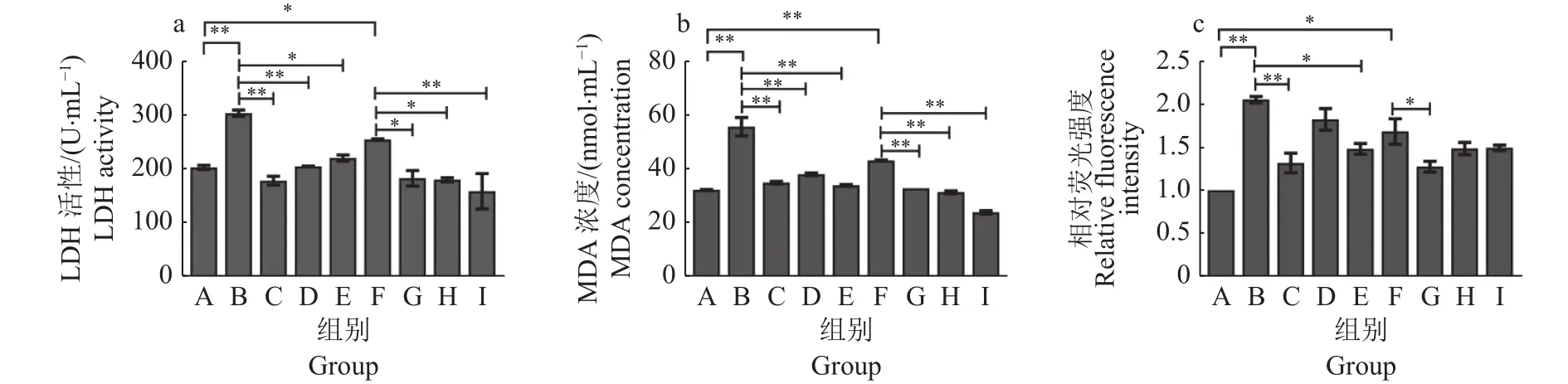
图5 AS-IV、APS干预对LPS刺激BMECs损伤的影响Fig. 5 Effects of AS-IV and APS interference on LPS damaging BMECs
2.4 AS-IV及APS干预对LPS刺激BMECs中炎症因子表达的影响
通过RT-qPCR试验和ELISA试验检测4种药物干预炎症细胞中 IL-6、IL-8、IL-1β、TNF-α 炎性因子的变化。RT-qPCR试验结果如图6所示,AS-Ⅳ、APS均能显著抑制炎症细胞中IL-6、IL-8、TNF-α3种基因的相对表达(P<0.05或P<0.01),但IL-1β基因的相对表达无显著变化(P>0.05);林可霉素显著激活炎症细胞中IL-6、IL-8、IL-1β3种基因的相对表达(P<0.01),TNF-α基因的相对表达无显著变化(P>0.05);青霉素显著提高炎症细胞中IL-6、IL-8基因的相对表达 (P<0.01),IL-1β、TNF-α基因的相对表达无显著变化(P>0.05)。ELISA试验结果如图7所示,AS-Ⅳ、APS可显著抑制炎症细胞中IL-6、IL-8、TNF-α 蛋白的表达 (P<0.05 或P<0.01),其结果与基因变化一致;林可霉素显著抑制炎症细胞IL-8蛋白的表达(P<0.05);青霉素显著抑制IL-6、IL-8蛋白的表达 (P<0.05、P<0.01);4种药物对 IL-1β蛋白的分泌无显著影响(P>0.05)。综上发现AS-Ⅳ、APS对LPS刺激的BMECs炎性因子表达的抑制效果强于林可霉素、青霉素2种抗生素的抑制效果。
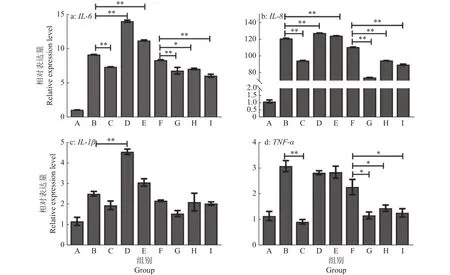
图6 AS-IV、APS干预对LPS刺激BMECs中炎症因子基因相对表达量的影响Fig. 6 Effect of AS-IV and APS intervention on LPS stimulating relative expression of inflammatory factor genes in BMECs

图7 AS-IV、APS干预对LPS刺激BMECs炎症因子表达量的影响Fig. 7 Effect of AS-IV and APS intervention on LPS stimulating the expression of inflammatory factors in BMECs
2.5 AS-IV及APS干预对LPS刺激BMECs中凋亡因子表达的影响
为研究AS-Ⅳ、APS对LPS诱导的BMECs凋亡过程中的细胞保护机制,通过RT-qPCR试验和Western blot试验检测细胞中凋亡相关因子Caspase-3/8/9表达变化。RT-qPCR结果如图8所示,AS-Ⅳ可以下调炎症细胞中caspase-3基因的表达,APS和林可霉素对于炎症细胞中caspase-3/8/9基因均有显著抑制效果(P<0.05或P<0.01),青霉素可以显著抑制炎症细胞中caspase-3/8的表达(P<0.01)。蛋白变化如图9、10所示,AS-Ⅳ对炎症细胞中Caspase-3/8/9蛋白的表达均有抑制效果(P<0.05或P<0.01);APS能显著抑制炎症细胞中Caspase-3/8蛋白的表达(P<0.01),Caspase-9表达量却显著上升(P<0.01)。因此推测AS-Ⅳ可以通过死亡受体途径和线粒体途径共同抑制细胞凋亡;APS则通过死亡受体途径抑制细胞凋亡。
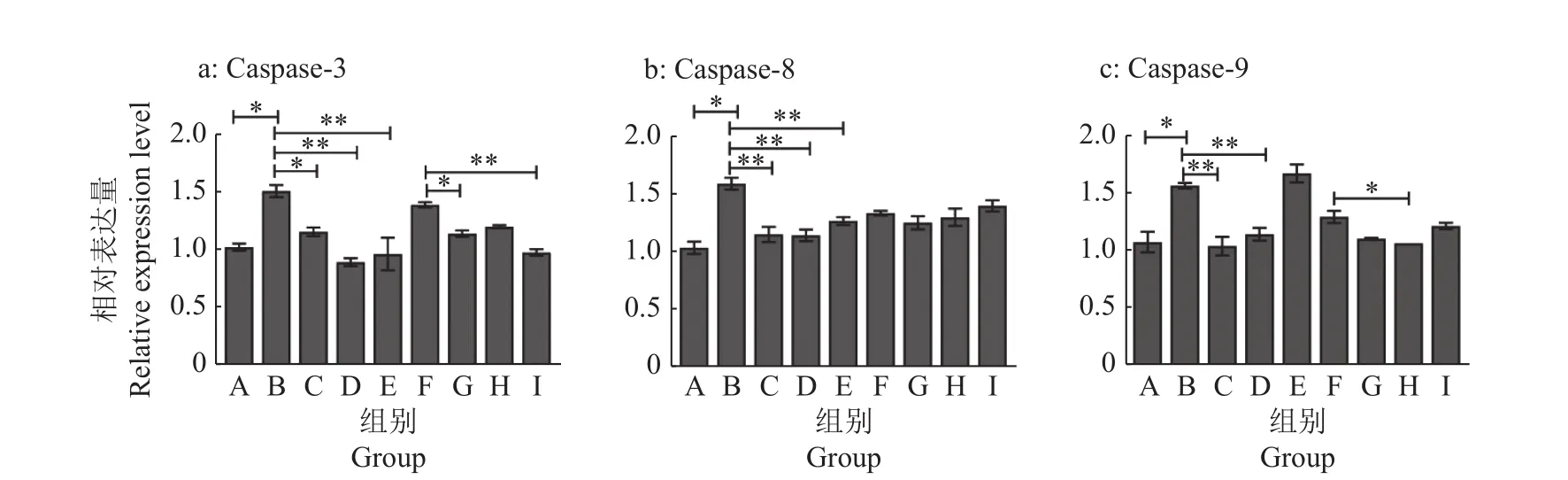
图8 AS-IV、APS干预对LPS刺激BMECs凋亡因子mRNA相对表达量的影响Fig. 8 Effect of AS-IV and APS intervention on LPS stimulating relative expression of apoptosis factor mRNA in BMECs
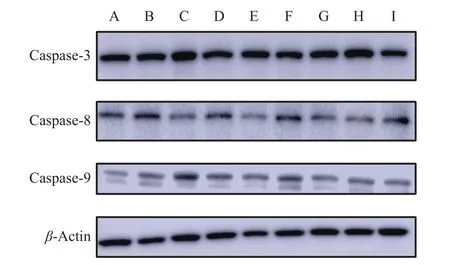
图9 AS-IV、APS干预对LPS刺激BMECs凋亡蛋白表达的影响Fig. 9 Effect of AS-IV and APS intervention on LPS stimulating expression of apoptotic protein in BMECs
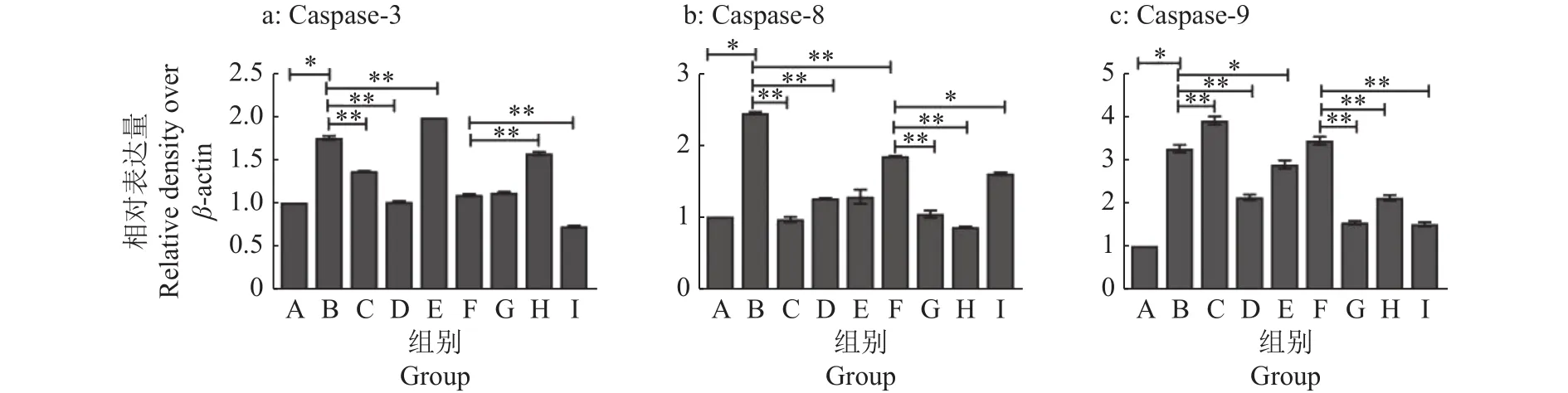
图10 AS-IV、APS干预LPS对BMECs凋亡蛋白表达量的影响Fig. 10 Effect of AS-IV and APS intervention on LPS affecting expression of apoptotic protein in BMECs
2.6 AS-IV及APS刺激对 BMECs中TGF-β、ERK1/2、β-酪蛋白表达的影响
本试验将通过RT-qPCR试验和Western blot试验,检测AS-Ⅳ和APS 2种药物作用于BMECs后,细胞中 TGF-β、ERK1/2、β-酪蛋白的表达变化。RT-qPCR检测结果如图11所示,与对照组相比,APS组显著激活了TGF-β、ERK1/2基因的相对表达(P<0.01),显著抑制了CSN2基因的相对表达(P<0.05);与乙醇组相比,AS-Ⅳ能显著抑制细胞中ERK1/2基因的相对表达(P<0.01),显著激活CSN2基因的相对表达(P<0.01),100 mg/L AS-Ⅳ能显著抑制细胞中TGF-β基因的相对表达(P<0.05)。Western blot检测结果如图12、13所示,与对照组相比,APS显著激活细胞中β-酪蛋白(P<0.05),极显著激活ERK1/2蛋白的表达(P<0.01),对 TGF-β 蛋白无显著影响 (P>0.05);与乙醇组相比,AS-Ⅳ能显著抑制细胞中TGF-β、ERK1/2蛋白的表达 (P<0.05或P<0.01),100 mg/L AS-Ⅳ能显著激活β-酪蛋白表达(P<0.01)。说明AS-Ⅳ和APS均可激活细胞中β-酪蛋白的表达,但正常状态下,AS-IV刺激BMECs中β-酪蛋白表达的效果更好。
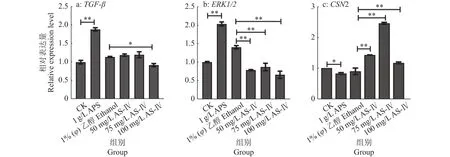
图11 AS-IV和APS对BMECs 中 TGF-β、ERK1/2、CSN2 相对表达量的影响Fig. 11 Effects of AS-IV and APS on relative expression level of TGF-β, ERK1/2 and CSN2 in BMECs
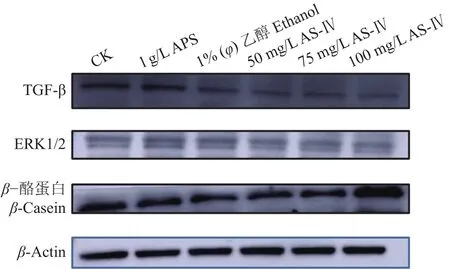
图12 AS-IV 和 APS对 BMECs 中 TGF-β、ERK1/2、β-酪蛋白表达的影响Fig. 12 Effects of AS-IV and APS on expression of TGF-β,ERK1/2 and β-casein proteins in BMECs
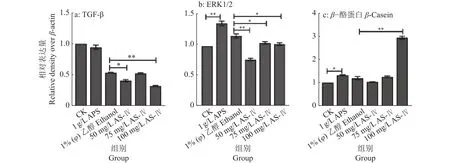
图13 AS-IV和APS对BMECs 中 TGF-β、ERK1/2、β-酪蛋白表达的影响Fig. 13 Effects of AS-IV and APS on expression of TGF-β, ERK1/2 and β-casein in BMECs
2.7 AS-IV及APS干预对LPS刺激BMECs中TGF-β、ERK1/2、β-酪蛋白表达的影响
AS-Ⅳ和APS 这2种药物干预炎症细胞β-酪蛋白及其拮抗蛋白的表达,结果如图14、15所示。与对照组(A组)相比,LPS(B组)能显著激活细胞中p-ERK1/2蛋白的表达(P<0.01),显著抑制细胞中β-酪蛋白的表达(P<0.01);与炎症细胞 (B、F组)相比,AS-Ⅳ(G、H、I组)、APS(C 组)、林可霉素(D组)、青霉素(E组)多能显著抑制炎症细胞中p-ERK1/2、TGF-β的表达,激活β-酪蛋白的表达 (P<0.05或P<0.01),其中 AS-Ⅳ、APS 对于激活炎症细胞β-酪蛋白表达效果最好。说明AS-Ⅳ、APS可激活炎症细胞中β-酪蛋白的表达,抑制炎症细胞中p-ERK1/2、TGF-β蛋白的表达。
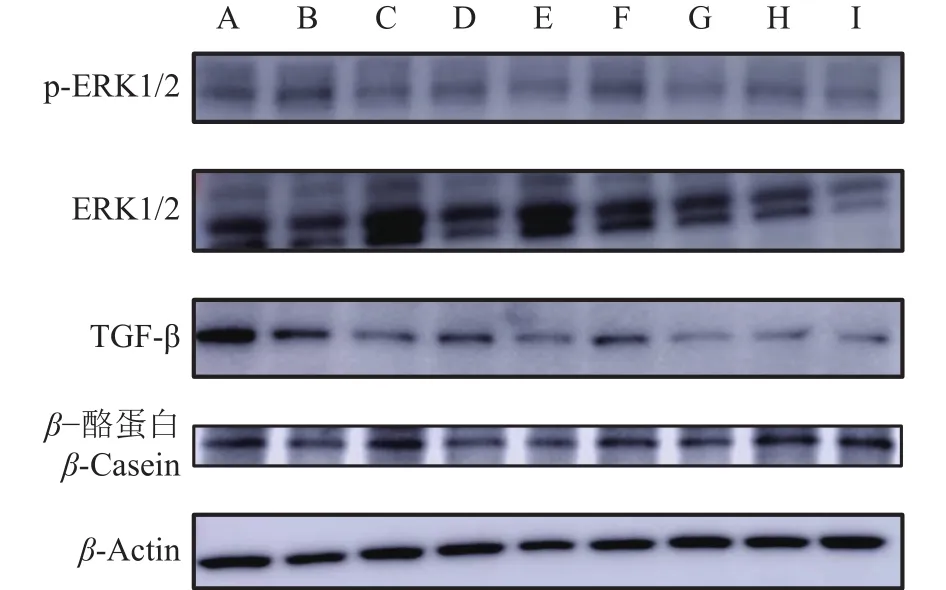
图14 4种药物干预对LPS刺激BMECs 中 TGF-β、ERK1/2、β-酪蛋白表达量的影响Fig. 14 Effect of four drugs intervention on LPS stimulating the protein expression of TGF-β, ERK1/2 and β-casein in BMECs
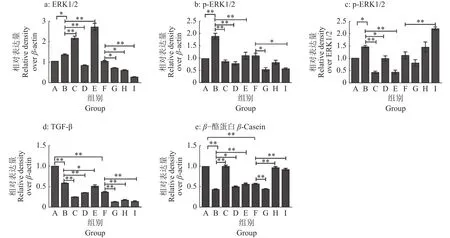
图15 4种药物干预对LPS刺激BMECs中TGF-β、ERK1/2、β-酪蛋白表达量的影响Fig. 15 Effect of four drugs intervention on LPS stimulating expression of TGF-β, ERK1/2 and β-casein in BMECs
3 讨论与结论
奶牛乳腺组织主要由上皮细胞、原代细胞、干细胞、神经细胞、脂肪细胞和巨噬细胞等组成,BMECs是乳腺组织中唯一有泌乳功能且高度分化的免疫细胞,BMECs在乳腺组织中正常的生长、分化、繁殖、死亡,一方面保障了乳汁成分的正常合成,另一方面保障了乳腺组织的动态重塑[13]。大肠埃希菌、金黄色葡萄球菌在隐性奶牛乳腺炎和临床型奶牛乳腺炎中均是主要致病菌,大肠埃希菌常作为刺激乳腺炎模型的诱导细菌,其在刺激乳腺组织时主要引起急性临床型乳腺炎[14]。LPS是革兰阴性菌细胞壁的主要成分,其作为细菌的毒力因子是使乳腺炎加剧的主要因素之一。因试验条件与试验经费的问题常使用大鼠作为研究乳腺炎的试验模型动物,研究发现与使用大肠埃希菌刺激乳腺组织相比,使用LPS刺激乳腺组织会引起与大肠埃希菌相似的感染情况及临床特征,且LPS在刺激乳腺炎方面可表现更好的重复性[15-16]。使用不同剂量的LPS刺激大鼠乳腺组织会导致如浆液性、出血性、卡他性等不同类型的急性乳腺炎,且病理特征与临床型奶牛乳腺炎的乳腺组织中的病理学特征相似,乳腺炎的损伤程度与LPS浓度呈剂量依赖性,LPS已成为刺激乳腺炎的理想模型[14,17]。长期使用精料饲喂会导致奶牛瘤胃菌群紊乱,致病菌过度繁殖,并持续释放LPS,LPS释放进入血液引起机体的低度炎症,并在乳腺组织中富集,破坏血乳屏障,诱发乳腺炎症反应[18]。多项研究发现,当乳腺组织中发生乳腺炎时,不仅会引起组织中多种炎性因子表达被激活,而且会导致组织中乳蛋白及泌乳前体物的表达被抑制[19-20]。林杰[21]使用50 mg/L的LPS刺激奶牛乳腺上皮细胞12 h,发现炎性因子表达量增加,建立炎症模型。田青等[22]研究发现500~25 000 μg/L的LPS刺激大鼠乳腺上皮细胞24 h,会激活细胞中IL-6、IL-1β、TNF-α炎性因子的表达,抑制CSN2和α-LA基因的表达。李莹莹[11]采集奶牛养殖场的奶样发现,牛奶中乳蛋白率与TGF-β1含量成负相关,当外源添加TGF-β1刺激BMECs会抑制BMECs的细胞增殖,进而上调ERK1/2基因的表达,并抑制CNS2基因的表达。本研究中使用LPS刺激BMECs 24 h,发现细胞中 IL-6、IL-8、IL-1β、TNF-α炎症因子基因和蛋白的表达升高,细胞中p-ERK1/2蛋白的表达被激活,细胞中β-酪蛋白的表达被抑制。本研究结果与田青等[22]研究结果类似,证明炎症状态下BMECs中的β-酪蛋白的表达会被抑制,并激活β-酪蛋白拮抗蛋白p-ERK1/2蛋白的表达,以及诱导炎症因子中促炎因子IL-6、IL-8、IL-1β、TNF-α 的表达。
黄芪具有补阳血、补虚损、愈肾衰等功效,传统中医上被应用于治疗气虚、表虚、水肿及疮疡等多种病症,是我国西北地区的特色中药产品之一,已经有2000多年的药用历史,其滋补效果温和,现已成为一种新兴的保健食品和饲料添加剂[23-24]。黄芪中包含200多种活性成分,其中,AS-Ⅳ、APS是有效成分,AS-Ⅳ、APS具有免疫调节、抗炎、抗氧化、抗应激、抗病毒、抗肿瘤等多种生物功效[25-26]。近年来,学者们使用BMECs作为体外研究的细胞模型,发现AS-Ⅳ、APS具有抑制炎症的作用;王凤鸽[5]发现AS-Ⅳ通过抑制氯化铵刺激的BMECs中氧化因子ROS,炎症因子IL-6、IL-8,凋亡因子BAX、Caspase-3的表达,达到保护细胞的目的;曾涵芳等[6]发现APS可抑制过氧化氢诱导的BMECs中ROS的表达,激活SOD(超氧化物歧化酶)和GSH-Px(谷胱甘肽过氧化物酶)的表达,从而缓解细胞的氧化损伤,起到保护细胞的作用。本研究发现AS-IV、APS这2种中药提取物均可显著抑制LPS诱导的BMECs炎症细胞中炎症因子(IL-6、IL-8、TNF-α)表达,降低促炎因子持续分泌,AS-IV、APS 2种中药提取物可抑制炎症细胞中炎症因子的持续分泌,抗生素对炎症因子的抑制效果不如ASIV及APS。ROS是细胞代谢过程中产生的氧分子衍生物,当细胞受到外界刺激时会大量产生,使细胞处于氧化应激状态,对细胞造成损伤;MDA常用于反映细胞中内脂质过氧化程度。本试验发现ASIV、APS可抑制炎症细胞中ROS、MDA的表达,从而提高细胞抗氧化能力,缓解细胞损伤,降低细胞功能紊乱;且AS-Ⅳ抑制炎症细胞中Caspase-3、Caspase-8、Caspase-9蛋白的表达,APS能抑制炎症细胞中Caspase-3、Caspase-8蛋白的表达,减缓炎症引起的细胞凋亡。本试验证明了AS-IV、APS对炎症细胞具有保护作用,研究结果与王凤鸽[5]和曾涵芳等[6]的试验结果相似。综上所述,AS-Ⅳ、APS可通过抑制细胞中凋亡因子的表达,还原细胞中的氧化平衡,进而保护细胞,并且通过抑制炎性因子的分泌,缓解细胞持续的炎性损伤。
β-酪蛋白是乳蛋白的主要成分,在BMECs中合成并分泌,可通过β-酪蛋白含量反映动物奶制品品质。中药成分复杂,具有多功能、多途径、多靶点的特点,且中药及中药提取物可补充动物营养,也可增强机体代谢,提高机体免疫力,多种中药提取物可激活乳腺上皮细胞中β-酪蛋白的表达,目前对于中药的催乳机制研究越发增多[27-28]。本研究发现AS-Ⅳ刺激的正常细胞及炎症细胞均可激活β-酪蛋白的表达,抑制β-酪蛋白拮抗蛋白TGF-β、ERK1/2的表达;APS可激活正常细胞及炎症细胞中β-酪蛋白的表达,不可抑制正常细胞中ERK1/2蛋白表达,但可抑制炎症细胞中TGF-β、p-ERK1/2蛋白表达;青霉素和林可霉素也可激活炎症细胞中β-酪蛋白的表达,但AS-Ⅳ、APS对激活β-酪蛋白表达的效果更好。李楠等[28]研究发现,甲珠、漏芦、王不留行、蒲公英、通草等中药均可促进小鼠分泌乳汁,考虑到经济效益,推荐王不留行作为中药催乳剂为畜牧生产提供方向。本研究结果表明,AS-IV、APS不仅可抑制炎症细胞中炎性因子、氧化因子、凋亡因子的表达,而且可提高正常细胞及炎症细胞中乳蛋白的表达与分泌,这证明ASIV、APS对BMECs不仅有抗炎作用,还可激活细胞中乳蛋白分泌及细胞保护,存在有益影响。这为开发AS-IV、APS成为治疗奶牛乳腺炎的药物提供理论基础。
中药提取物AS-Ⅳ、APS可以激活BMECs中β-酪蛋白的表达,且可抑制炎症细胞中炎症因子、凋亡因子、氧化因子的表达。本研究提示AS-Ⅳ、APS可作为饲料添加剂饲喂奶牛或制备成中药制剂治疗乳腺炎,为提高乳制品品质、预防治疗奶牛乳腺炎提供理论依据。
