红蓝方通过线粒体凋亡途径促进人肺癌A549细胞凋亡的实验研究
2022-07-07傅厚道费明明陈雪慧
傅厚道,费明明,2,金 彤,2,胡 蔚,陈雪慧,余 静,张 顺,2
(1中国科学院大学宁波华美医院·浙江 宁波 315000;2浙江省消化系统肿瘤诊治及研究重点实验室·浙江 宁波 315000)
肺癌是世界范围内常见的恶性肿瘤,其死亡率位居所有癌症之首[1]。非小细胞肺癌(non-small cell lung cancer, NSCLC)占所有肺癌病例的80%~85%[2]。早期筛查的普及、手术与放化疗技术的进步以及靶向治疗药物的相继问世,提高了NSCLC的总体生存期,但对于失去了治愈机会的晚期NSCLC患者,其5年总生存率只有6%[3-5]。中医药在晚期NSCLC治疗方面具有独特的优势,能够增强体能,提高生活质量,延长总生存期,减少各种不良反应[6]。红蓝方(Honglan Decoction,HLD)是浙江省名中医沈力基于肿瘤患者正虚邪实的病机特点[7],以解毒攻邪、扶正抗癌为法创立的经验方,在减少放化疗副反应、提高生存质量、延缓疾病进展等方面获得了较好疗效,并使部分晚期患者能长期带瘤生存[8]。本课题以人肺癌A549细胞系作为研究模型,观察HLD体外对肺癌细胞增殖、周期和凋亡的影响,并检测相关调控通路的因子变化,进而探讨HLD治疗NSCLC的可能分子生物学机制,为进一步的深入研究奠定基础。
1 材料与方法
1.1 材料 人肺癌细胞株A549:中国科学院上海细胞生物学研究所,SCSP-503。
红蓝方(HLD):自制,水煎法制备,南方红豆杉、绞股蓝、浙贝母、白花蛇舌草、藤梨根、半枝莲、枸杞子及杜仲等均组方药味购自宁波明贝中药业有限公司。F12培养基:Hyclone,SH30026.01B;胎牛血清:Gibco,10099-141;细胞周期检测试剂盒:杭州联科生物技术股份有限公司,70-CCS012;细胞凋亡检测试剂盒:BD,550911;BCA蛋白定量试剂盒:ThermoFisher,3227;CCK-8试剂盒:索莱宝,CA1210;活性氧检测试剂盒:索莱宝,CA1410;线粒体膜电位检测试剂盒:索莱宝,M8650;HRP-标记山羊抗兔:碧云天,A0208;所有抗体均购自CST公司:PAPR(5625)、Bcl-2(4223)、Mcl-1(94296)、P-Mcl-1(14765)、Bim(2993)、Bax(5023)、Bok(86875)、Noxa(14766)、β-actin(4970)。
1.2 仪器 RV 10 auto pro V旋转蒸发仪:IKA;SpectraMax M5酶标仪:Molecular Devices;Axio Vert.A1荧光显微镜:Zeiss;蛋白质电泳仪:Bio-Rad;Allegra X-12R离心机:Beckman。
1.3 方法
1.3.1 红蓝方水提液制备 红蓝方(HLD):取南方红豆杉6 g,绞股蓝9 g,白花蛇舌草15 g,藤梨根15 g,半枝莲15 g,山楂10 g。置于医用不锈钢锅,浸泡过夜,加8 倍水煮沸30 min,倒出药液,后加8 倍水煮沸20 min,再加5倍水煮沸20 min,将3 次药液置于旋转蒸发仪上80 ℃水浴中浓缩成约40 mL药液,入真空干燥箱中干燥,得浸膏6 g,按100%浓度计算得率。取1 g红蓝方水提液浸膏,其中加入10 mL超纯水,37 ℃水浴10 min,并于旋涡混合仪上混合助溶,充分溶解后,经高速离心机1 200 r/min离心15 min,取上清液,再经0.22μm微孔滤膜除菌,制成母液浓度100 g/L,置-80 ℃冰箱备用。
1.3.2 细胞活力和增殖能力检测 CCK-8法。细胞5 000 个/孔接种于96 孔板中,设空白对照组、HLD组,每组6 个复孔。培养24 h后,HLD组按不同浓度加入(0.2、0.4、0.8、1.6、3.2、6.4、12.8 g/L),继续培养24 h,CCK-8法检测细胞活力。不同作用时间对A549细胞增殖的影响:细胞1 000 个/孔接种于96 孔板中。设空白对照组、HLD组,每组6 个复孔。培养24 h后,HLD组加入不同浓度方药(1、2、4 g/L),继续培养12、24、36、48 h后,CCK-8法检测细胞活力。
1.3.3 细胞凋亡和周期的检测 细胞传代后贴壁过夜,实验分为空白对照组、HLD组(1、2、4 g/L),药物处理24 h后,收集培养基中悬浮细胞以及贴壁的细胞并计数。细胞凋亡检测:取1×106个细胞,加入5 μL AnnexinV-FITC混匀后,再加入5 μL Propidium Iodide混匀,对照组加入PBS,室温避光孵育10 min,用流式细胞仪进行检测。细胞周期检测:取1×106个细胞,加入1 mL DNA staining solution和10 μL Permeabilization solution,涡旋振荡5~10 s混匀。室温避光孵育30 min。选择最低上样速度,流式细胞仪进行检测。
1.3.4 细胞内活性氧水平检测 A549细胞用HLD(1、2、4 g/L)处理24 h,去除旧培养基,加入使用无血清培养基1∶1 000稀释的DCFH-DA,37 ℃孵育20 min。用无血清细胞培养基洗涤细胞3 次,加入完全培养基,在荧光显微镜下观察并拍照。并用Image J软件分析荧光强度。
1.3.5 细胞线粒体膜电位检测 细胞用HLD(1、2、4 g/L)处理24 h,去除旧培养基。使用超纯水和JC-1染色缓冲液配制JC-1染色工作液。加入1 mL完全培养基,加入1 mL JC-1染色工作液,充分混匀,37 ℃孵育20 min。用超纯水和JC-1染色缓冲液配制洗涤液,冰浴。孵育结束后,使用洗涤液洗涤2次,加入2 mL完全培养基,荧光显微镜下观察并拍照,并用Image J软件分析荧光强度。
1.3.6 凋亡相关蛋白表达水平的检测 Western Blot检测。细胞用HLD(1、2、4 g/L)处理24 h,去除培养基,用预冷的PBS洗涤1 次,迅速加入蛋白裂解液,冰上放置20 min后超声处理并提取总蛋白。所得蛋白样品使用Western-blot检测蛋白(PARP、Caspase-3、Bax、Bcl-2、Mcl-1、p-Mcl-1、BimEL、BimL、Bok、Noxa、β-actin)表达情况。曝光后的条带使用image J软件统计灰度,进行分析。
2 结果
2.1 HLD对A549细胞活力和增殖能力的影响 以不同浓度HLD处理24 h后,A549细胞活力随着HLD浓度的增高而下降,IC50为4.8 g/L,见图1A。以1、2、4 g/L的HLD处理6、12、24、48 h后,与空白对照组相比,不同浓度的HLD均抑制A549细胞增殖(P<0.001),且抑制作用随浓度升高和时间延长而增强。HLD能以时间和浓度依赖性的方式抑制肺癌A549细胞的增殖,见图1 B。

图1 各组A549细胞增殖的CCK-8检测结果
2.2 HLD对A549细胞周期与凋亡的影响 不同浓度HLD处理A549细胞24 h,G2/M期细胞比例逐渐增加,说明HLD能将A549细胞周期阻滞在G2/M期;与空白对照组相比,不同浓度HLD均能诱导A549细胞的凋亡,且具有浓度依赖性。见图2与表1。
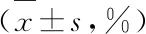
表1 各组A549细胞周期占比及凋亡率比较
2.3 HLD对A549细胞内活性氧水平的影响 荧光探针DCFH-DA本身不带荧光,可自由穿过细胞膜,进入细胞后被脂酶水解成DCFH后不能穿透细胞膜。且DCFH可被细胞内的活性氧氧化成有荧光的DCF,因此DCF的亮度代表细胞内活性氧的水平,见图3和表2。从图3可见,随着HLD浓度的增加,细胞内的绿色荧光上升,表明细胞内活性氧水平的上升,说明HLD能够上调A549细胞内活性氧水平。

图3 HLD对A549细胞内活性氧水平的影响

表2 各组A549细胞内活性氧水平荧光强度比较
2.4 HLD对A549细胞线粒体膜电位的影响 JC-1是一种广泛用于检测线粒体膜电位ΔΨm的荧光探针。在线粒体膜电位较高时,JC-1聚集在线粒体的基质中,形成聚合物,产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,为JC-1单体,产生绿色荧光。使用红绿荧光的相对比例能够衡量线粒体去极化的比例,且线粒体膜电位的下降是细胞凋亡早期的标志性事件,见图4和表3。从图5可见,随着HLD处理浓度的增加,细胞内红绿荧光比例下降明显,表明HLD能够使细胞线粒体膜电位下降。

图4 HLD对A549细胞线粒体膜电位的影响

表3 各组A549细胞内JC-1荧光强度比较
2.5 HLD对A549细胞凋亡相关蛋白的调控作用 图5可知,与空白对照组相比,不同浓度HLD组的凋亡标志蛋白Cleaved-PARP和Cleaved-Caspase-3蛋白均增加。线粒体途径促凋亡蛋白BimL、Bax、Bok、Noxa升高,抗凋亡蛋白Bcl-2与磷酸化的Mcl-1水平降低,差异有统计学意义。

注:与空白组比较,*P<0.05,**P<0.01
3 讨论
肺癌可归属于中医“癥瘕”“积聚”范畴,基本病机为正虚邪实,以痰湿瘀毒为病理因素,以正虚为本,邪实为标[9-10]。临证时虽因素体禀赋的差异和阴阳盛衰的偏颇导致具体的证候有所不同,但是在治疗上仍要以补虚扶正和解毒抗癌兼顾为要。沈力主任医师临证五十载,学验俱丰,其创立的红蓝方在增强放化疗疗效并减少毒副反应,预防肿瘤术后复发转移,延缓疾病进展延长生存期等方面都取得了良好的疗效。红蓝方中红豆杉祛邪散结,绞股蓝益气补虚解毒,浙贝母、蛇舌草、藤梨根、半枝莲清热解毒,枸杞子、杜仲扶正固本,全方共奏扶正补虚益气、解毒攻邪抗癌之效。现代药理研究显示,红豆杉水提物能促进肺癌细胞caspase-9/8/3及PARP的切割进而诱导其凋亡,且对正常细胞和组织影响很小[11]。绞股蓝所含皂甙可以诱导体内外NSCLC细胞凋亡,还能调节免疫[12-13]。蛇舌草及半枝莲等药物也在体内外显示出良好的抗肿瘤作用[14-15]。
对细胞死亡研究的深入发现了新的程序性死亡形式,包括自噬性死亡、铁死亡、焦亡等,但目前的肿瘤临床治疗中,诱导肿瘤细胞发生凋亡仍然是治疗起效的最主要机制[16]。线粒体途径的凋亡由Bcl-2家族进行调控,后者分为促凋亡蛋白和抗凋亡蛋白两类。BimL、Bax、Bok、Noxa等属于促凋亡蛋白,通过增加线粒体膜的通透性引发线粒体膜电位改变,并使细胞色素C和ROS从线粒体释放,激活Caspase的级联反应,最终切割并活化“凋亡执行者”Caspase-3,对PARP等维持细胞存活的蛋白进行水解,使细胞进入凋亡的不可逆阶段,而Bcl-2与Mcl-1属于抗凋亡蛋白,通过拮抗促凋亡蛋白的功能,防止凋亡的发生。
本文结果显示,经HLD处理后A549细胞增殖减慢,凋亡增加,ROS水平上升,线粒体途径促凋亡因子BimL、Bax、Bok、Nox上调,抗凋亡因子Bcl-2与P-Mcl-1下调,Caspase-3和PARP-1切割增加;表明HLD通过线粒体途径诱导A549细胞发生凋亡。综上,红蓝方以浓度和时间依赖的方式通过线粒体途径诱导A549细胞发生凋亡,本文结果为红蓝方进一步的临床和基础研究提供基础。
