1例兔出血症病毒2型感染疫情的诊断
2022-07-07常赵阳刘玉梅刘潍萁王佳宁张自强
常赵阳,刘玉梅,刘潍萁,王佳宁,位 兰,张自强
(河南科技大学动物科技学院,洛阳 471000)
兔出血症(rabbit hemorrhagic disease,RHD)又称兔瘟或兔坏死性肝炎,是由兔出血症病毒(rabbit hemorrhagic disease virus,RHDV)所引起的以家兔实质性器官出血、坏死为主要特征的传染性疾病。经典RHDV会导致家兔急性、出血性死亡,且该病发病急,病死率高。RHDV属于杯状病毒科,兔病毒属,对家兔具有高度传染性和致命性的病毒。我国流行的经典RHDV主要是G2和G6型,G6型也称为RHDVa。2010年,RHDV毒株的新变种在法国被发现并首次进行报道,Le-Gall-Recule等将其命名为RHDV2,也称为RHDVb。RHDV2在基因和抗原性上不同于经典RHDV和RHDVa,RHDV2衣壳蛋白(VP60)的核苷酸与经典RHDV相差15%以上,RHDV2引起了非典型的RHD,导致接种了疫苗的成年家兔和通常对经典RHDV具有抗性的幼兔的死亡。随后该毒株在欧洲开始扩散,并且在北美洲、非洲、大洋洲都有相关报道。2020年4月,我国四川省首次确诊了RHDV2感染病例,并将该毒株命名为SC2020/04。
2021年初,河南省某地区一兔场出现患病家兔急性死亡,且断奶前后的幼兔也出现发病死亡现象,死亡家兔的临床症状和病理变化与兔出血症病毒感染高度相似,本实验室通过临床剖检结合实验室检测的方法,初步确定该次疫情是由RHDV2感染所致,并以病兔的含病毒肝悬液进行了动物回归试验,对毒株的致病力有了初步了解,为后续RHDV2的防控提供了一定的参考价值。
1 材料与方法
1.1 样品来源及处理
病料样品来源为河南省某地区一规模化兔场3只疑似感染RHDV2的家兔(分别编号为样品1、样品2、样品3),分别采集3只发病家兔的胸腺、心、肝、脾、肾、肺、气管等样品,用于后期的试验检测。
1.2 主要试验试剂和仪器
Trizol试剂,Premix Taq(EXTaqVersion 2.0 plus dye),RT-PCR扩增试剂盒均为宝生物工程(大连)有限公司的产品;DM2000 DNA Marker购自康为世纪生物科技有限公司;溴化乙锭溶液购自苏州天可贸易有限公司;实验兔购买自济源市阳光兔业科技有限公司[SCXK(豫)2016-0001]。
主要仪器包括台式冷冻高速离心机(Hitachi CT15RE)、普通PCR仪(LongGene A200)、凝胶成像系统(BIORAD)、电泳仪(北京市六一仪器厂)。
1.3 病理学观察
取“1.1”中疑似感染RHDV2的家兔胸腺、心、肝、脾、肾、肺、气管等组织,浸入4%的多聚甲醛溶液中固定,修块、包埋、切片后,进行HE染色,用CaseViewer软件进行拍照并分析病理学变化。
1.4 引物的设计与合成
引物对P1/P2是参考文献[12]中使用的经典RHDV扩增引物,引物对P3/P4是参考文献[13]中使用的RHDV2扩增引物,两对引物均由通用生物系统(安徽)有限公司合成(表1)。

表1 引物序列信息
1.5 微量血凝试验
取发病家兔的肝组织,剪碎后,以1 g∶10 mL加入磷酸盐缓冲溶液(PBS)后匀浆,反复冻融后,再以1 000 r·min离心30 min,取上清25 μL在96孔V型微量凝集板上进行倍比稀释,向每孔加入1%的人“O”型红细胞悬液,立即摇匀,4 ℃静置5 min, 观察凝血现象,同时设置阴性对照组,具体方法参照《兔病毒性出血病血凝和血凝抑制试验方法》(NY/T 572—2016)。
1.6 病毒RNA的提取和反转录
使用匀浆后的家兔肝组织悬液,与Trizol试剂按1∶10(质量体积比)混合后研磨成悬液,12 000 r·min, 离心15 min,取上清液500 μL,后续按照Trizol法提取RNA的步骤进行进一步操作,提取组织中的RNA,利用RNA反转录试剂盒获得组织的cDNA,放入-20 ℃,保存备用。
1.7 病毒cDNA的PCR鉴定
分别用P1/P2和P3/P4的特异性引物进行PCR扩增。反应体系25 μL:Premix酶12.5 μL、 无酶水9.5 μL、上、下游引物各1 μL,“1.6”中获得的病毒cDNA模板1 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,51.1 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃延伸10 min。
1.8 病毒基因序列的遗传进化分析
由于60基因编码RHDV的结构蛋白,是对RHDV进行分型的主要依据,将PCR扩增的产物送至生工生物工程(上海)股份有限公司进行基因测序,根据Blast的结果,从GenBank中获取多条RHDV2毒株的60基因序列,使用MEGA-X对病毒的60基因的核苷酸序列进行构建进化树并进行遗传进化分析。
1.9 动物回归试验
严格遵循实验室安全指南和生物安全防控的条件下,在超净工作台中,取疑似RHDV2病死兔的肝脏,剔除肝样品上的结缔组织后,加入少许的PBS进行匀浆,以1 g∶10 mL制成悬液,高速离心30 min,取上清液,并用0.22 μm的滤膜除菌后保存备用。
随机选取同一批次未接种疫苗的54日龄的雄性青年兔5只,对家兔进行人工感染,分别于颈部皮下接种1 mL的病毒悬液,同时设置5只同等健康条件的家兔作为空白对照,每只接种1 mL的生理盐水,接种后分开饲养,观察记录家兔的精神,食欲及体温等临床变化,并对发病死亡的家兔及时进行剖检、取材,进行RT-PCR检测。
产生的垃圾和动物尸体经高压灭菌后无害化处理,试验结束后对整个试验环境进行彻底消毒。
2 结 果
2.1 病理学观察
2.1.1 剖检变化 家兔发病死亡后多呈现角弓反张,四肢划水样的姿态(图1A),典型症状为口鼻有泡沫状血液流出(图1B),肛门松弛,肛周有淡黄色胶冻样液体和少许粪便附着(图1C)。

A. 角弓反张;B. 口鼻;C. 肛门。扫文章首页OSID码可查看彩图A. Angle arch backtension; B. mouth and nose; C. anus. The color pictures can be found by scanning the OSID code on the front page图1 临床症状Fig.1 Clinlcal symptom
剖检可见内脏实质性器官肿胀,出血,尤其是胸腺、肝、脾、肾出血较为严重;气管环上有暗红色淤血(图2A);肺也有不同程度出血症状,有明显的水肿和大小不一的出血斑块(图2B),切开后流出泡沫状液体;胸腺肿大,出血明显,有散在的针尖到米粒大小不一的出血点(图2C);肝肿大,颜色发黄,呈土黄色或土褐色,质地变脆,切面粗糙,呈“槟榔肝”样病变,胆囊积液充盈,颜色变深(图2D);脾明显肿大,呈蓝紫色(图2E);肾出血、充血,肾表面呈暗红色,切开肾可见皮质区有散在的大小不一的针尖样出血点(图2F);肠道有轻微出血,肠系膜静脉淤血,淋巴结出血,肿大,腹部有积水;膀胱积尿,并且有白色絮状沉淀物;典型病例剖开病兔皮下可见有黄疸现象。
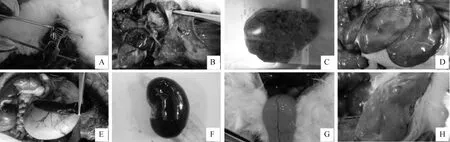
A. 气管;B. 肺;C. 胸腺;D. 肝;E. 脾;F. 肾;G. 膀胱;H. 肌肉。扫文章首页OSID码可查看彩图A. Trachea;B. Lung;C. Thymus;D. Liver;E. Spleen;F. Kidney;G. Bladder;H. Muscle. The color pictures can be found by scanning the OSID code on the front page图2 病理剖检Fig.2 Pathological examination
2.1.2 病理组织学观察 对取材的家兔的器官进行石蜡包埋,HE染色后,结果如图3所示。
发病家兔组织切片镜检显示胸腺皮质区和髓质区均有多处红细胞堆积,胸腺上皮细胞脱落,巨噬细胞数量明显增多,成纤维细胞大量死亡,崩解,细胞核皱缩(图3A、B);气管黏膜层上假复层纤毛柱状上皮细胞断裂,杯状细胞数量减少,固有层有炎性浸润,黏膜层毛细血管扩张,充血,黏膜下层与外膜分离,气管腺与透明软骨分离(图3C、D);肺组织出血,肿胀,可见有弥漫性的血管内凝血,肺泡腔内有大量粉红色炎性渗出物,主要为中性粒细胞和淋巴细胞,大面积肺泡萎缩(图3E、F);肝组织中肝细胞索排列紊乱,肝小叶结构不清晰,肝细胞有不同程度的空泡变性,胞核崩解,肝细胞塌陷和消失的区域可见纤维蛋白和出血,在肝病变的晚期,细胞或细胞碎片从肝索上脱落(图3G、H);脾组织中白髓数量明显减少,红髓正常结构消失,被大量红细胞和血浆渗透、填充,脾小结坏死,淋巴细胞数量减少,网状细胞增生(图3I、J),肾中肾小球肿胀,肾小囊被浆液性物质充盈,毛细血管充血,少量肾小管坏死,部分上皮细胞颗粒样变性或空泡变性,肾小囊刷状缘脱落(图3K、L)。
2.2 微量血凝试验
基于人“O”型血红细胞的微量血凝试验结果显示,3只发病死亡家兔的肝样品均能凝集人的“O”型血红细胞,全部出现血凝现象,该结果可证实采集的3只病兔样本均具有凝集性,初步证明了采集的病料组织中含有RHDV抗原。
2.3 RHDV2的RT-PCR检测
以病毒的cDNA为模板,用P1/P2的鉴定引物进行PCR扩增,在591 bp的位置,均未出现特异性条带(图4A);用P3/P4的鉴定引物进行PCR扩增,在829 bp的位置都出现了明亮的特异性条带(图4B);可以证明采集的死亡病兔都是由RHDV2感染引起的死亡,不是由经典RHDV感染所引起的死亡。
2.4 基于VP60基因的遗传进化分析
使用MEGA-X对病毒的60基因的核苷酸序列进行遗传进化分析,邻接法构建系统进化树(图5),结果证明试验分离得到的病毒毒株属于RHDV2的分支,与四川省分离得到的毒株SC2020/04具有高度同源性,且相似性高达98.2%。
2.5 动物回归试验
用制备的病毒上清液接种健康的家兔,每只家兔皮下注射1 mL上清液,攻毒组家兔出现了感染RHDV2的典型症状。临床表现为食欲减退,精神沉郁,体温升高,最快的病例在24 h内发病,其中一只家兔在48 h内死亡,两只家兔在72 h内死亡,两只家兔在96 h内死亡,发病过程短,发病后出现明显的神经症状,四肢呈划水状,发出尖叫后死亡。病理剖检可见全身多器官出血,肝、脾充血出血严重(图6A、B),临床症状与感染RHDV2死亡的家兔高度相似,病理组织切片观察结果显示,攻毒组家兔各实质性器官中有大量的出血点,肝中明显可见肝细胞有空泡样变性,窦状隙中有红细胞堆积,胞核溶解(图6C),脾中可见红髓区和白髓区大量细胞崩解、坏死,淋巴细胞数量减少,大量红细胞进入脾索,且脾索处大量纤维组织增生,脾血窦内皮细胞脱落,在脾索和脾血窦周围出现大量红细胞,并伴随大量炎性细胞浸润(图6D),而空白对照组无上述的症状和病理变化。取病死兔的肝进行PCR扩增,攻毒组均显示出特异性条带,检测到RHDV2呈阳性。(图7)。

A、B. 胸腺;C、D. 气管;E、F. 肺;G、H. 肝;I、J. 脾;K、G. 肾;左侧A、C、E、G、I、K放大倍数10×;右侧B、D、F、H、J、L放大倍数40×。扫文章首页OSID码可查看彩图A, B. Thymus; C, D. Trachea;E, F. Lung; G, H. Liver; I, J. Spleen; K, G. Kidney; The magnification of A, C, E, G, I and K on the left is 10×; The magnification of B, D, F, H, J and L on the right is 40×. The color pictures can be found by scanning the OSID code on the front page图3 各组织脏器的病理变化Fig.3 Pathological changes of various tissues and organs
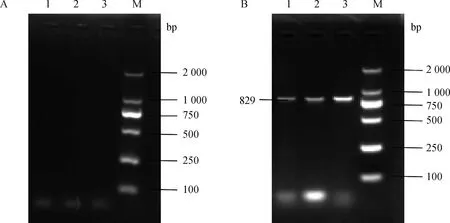
A. RHDV扩增(P1/P2);B. RHDV2扩增(P3/P4);M. DM2000 DNA相对分子质量标准;1~3. 肝样品1~3A. RHDV amplification (P1/P2); B. RHDV2 amplification (P3/P4); M. DM2000 DNA marker;1-3. Liver sample 1-3图4 分离毒株的PCR扩增Fig.4 PCR amplification of the isolated virus
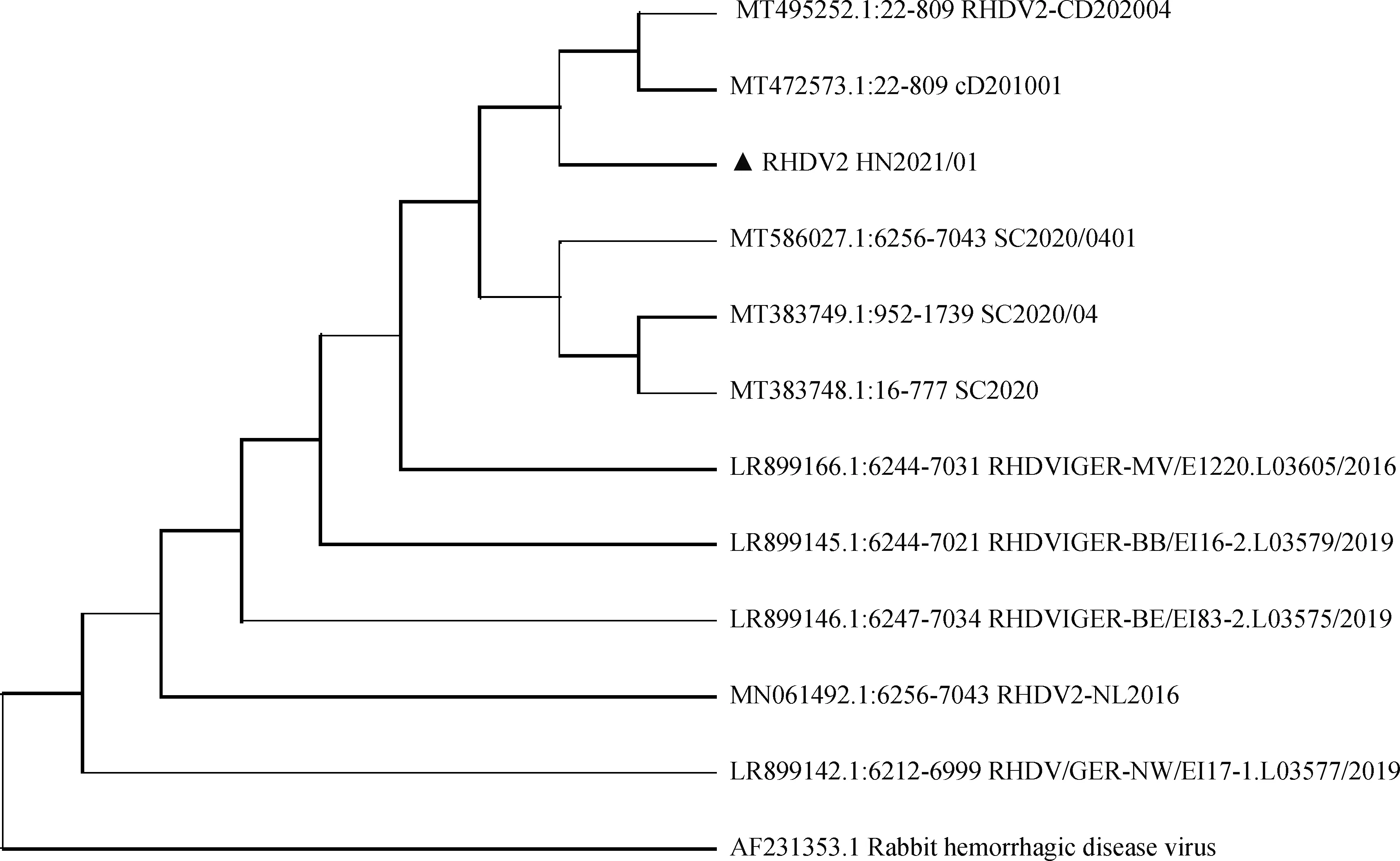
图5 VP60基因的邻接法(Neighbor-joining,NJ)进化树Fig.5 Neighbor-joining phylogenetic tree of VP60 genes
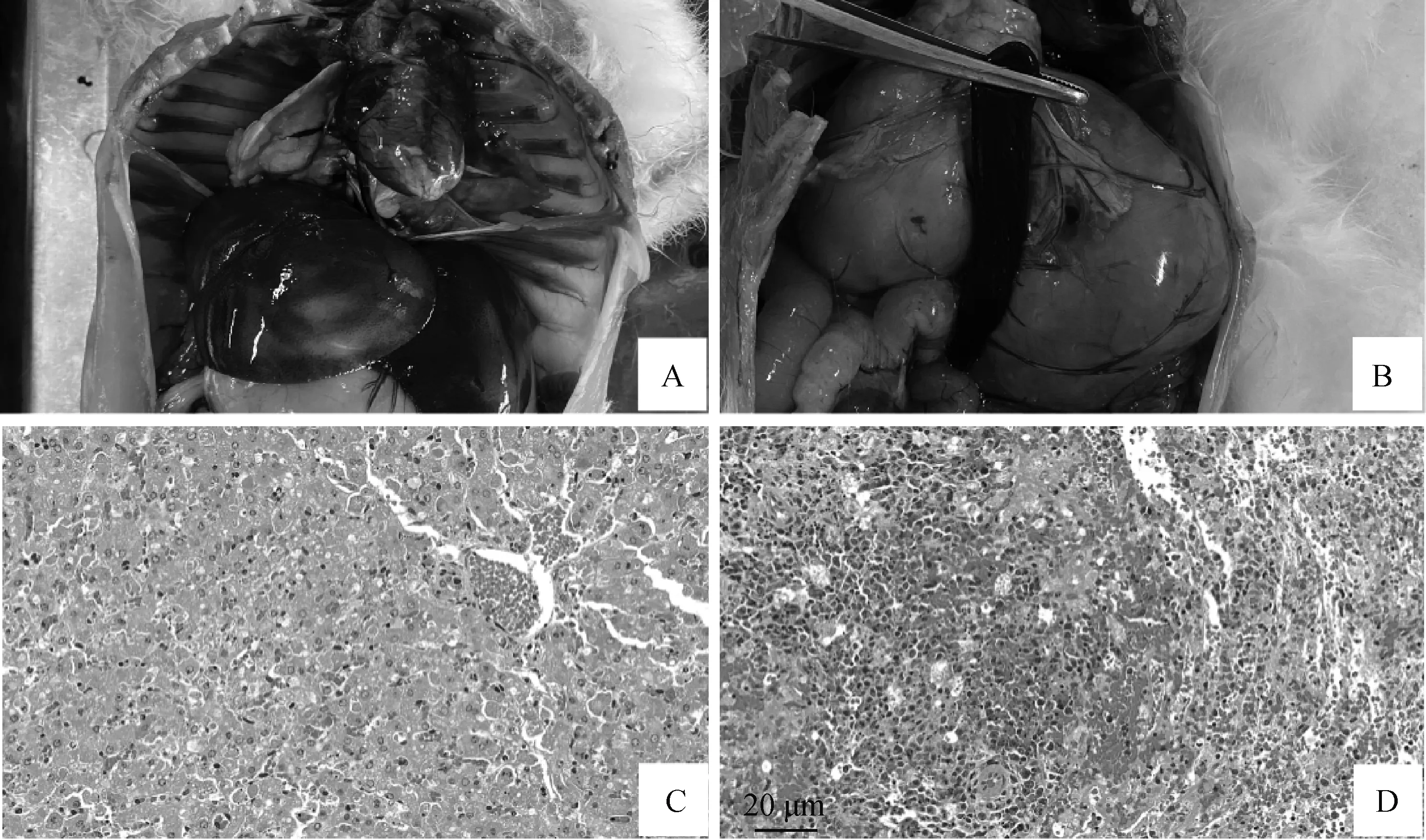
A、C. 肝;B、D. 脾;A、B. 剖检病理变化;C、D. 组织病理变化(40×)。扫文章首页OSID码可查看彩图A, C. Liver; B, D. Spleen; A, B. Pathological changes of autopsy; C, D. Histopathological changes (40×). The color pictures can be found by scanning the OSID code on the front page图6 攻毒试验的病理变化Fig.6 Pathological examination of challenge test

M. DM2000 DNA相对分子质量标准;1~5. 肝样品M. DM2000 DNA marker;1-5. Liver samples图7 攻毒试验的PCR扩增Fig.7 PCR amplification of challenge test
3 讨 论
自1984年,中国首次从德国进口商业养殖的安哥拉兔中发现经典RHDV,至今已有37年,目前,该病通过经典RHDV疫苗免疫能够很好的预防和控制。2010年,RHDV2在法国被发现,目前在全球范围内流行,有逐渐取代经典RHDV的趋势,成为危害家兔的主要病原。经典RHDV主要感染两月龄以上的家兔,死亡率非常高,甚至达到99%,但对40日龄以下的家兔不易感,哺乳仔兔不发病。然而,RHDV2主要感染断奶前后的家兔,最早对11日龄以上仔兔即可感染致死,对仔兔的致死率可达50%。相较于经典RHDV,RHDV2感染的宿主范围更广,不仅能感染家兔,还能感染欧洲野兔、意大利兔、撒丁海角兔和山兔。经典RHDV在我国的流行传播中出现了G2基因型的新变种,而RHDV2进入我国时间较短,正处于传播阶段,新的变种在国内还未见报道,但是国外已经报道RHDV2出现了新的变异重组体,流行范围在全球不断扩大,在多个国家都有其相关报道,严重影响RHDV2的预防和治疗效果。
本实验室通过临床问诊了解到该兔场对基础母兔和幼兔已注射兔病毒性出血症、多杀性巴氏杆菌病二联灭活疫苗,发病后,再次紧急接种了兔病毒性出血症疫苗,未能有效控制家兔发病,兔场死亡率继续不断上升,采集发病兔场样本,通过临床剖检和病理组织学观察发现感染RHDV2的家兔的病理变化与感染经典RHDV家兔的病理变化未见有明显的区别。感染RHDV2后典型的病兔口鼻处有泡沫样血液流出,临床剖检可见内脏多器官充血、出血;病理组织切片镜检观察,各器官的组织病理变化明显,尤其是肝和脾最为典型,可见组织中淋巴细胞和中性粒细胞大量浸润,实质性细胞大量崩解,坏死;RT-PCR扩增,从临床病例的样品中扩增出了RHDV2的特异性条带,未扩增出经典RHDV的特异性条带;基于60基因的核苷酸序列测序和遗传进化分析结果证实了该病毒为RHDV2,并且与在四川省发现的国内首例毒株SC2020/04有高达98.2%的相似性;在动物回归试验中,攻毒组的家兔在接种1 mL含有病毒的上清液后,72 h内全部死亡,平均死亡时间65.8 h,死亡率达到100%,病理组织切片结果呈现出典型的RHDV2病理症状,有明显的出血斑块,RT-PCR扩增均显示出特异性条带,RHDV2结果呈阳性。
RHDV2的传播速度快,对环境的抵抗力强,其存在于宿主的血液、器官、排泄物、呕吐物、分泌物中,此外污染的水源、饲料和宿主接触过的场地等都可能成为接触感染的传染源。目前RHDV2在我国发现的时间尚短,要加强防控,防止病毒的大面积传播和出现新的可致病重组体。河南作为我国的养兔大省,一定要在销售、运输过程中做好消杀,加强检疫与隔离,切断传播途径,坚持做好卫生防疫工作。加强对家兔RHDV2的监测,了解我国不同区域的RHDV2的流行情况和抗原变异情况对疾病的防控和疫苗的研发具有重要意义。目前,我国并没有针对RHDV2的有效疫苗,研发疫苗更是当务之急,应当加快病毒组织灭活疫苗等相关疫苗的研发,为中国养兔业提供强而有力的保障措施。
4 结 论
本研究证实,引起本次河南兔场兔群大规模发病死亡的病原为RHDV2,是首次在河南发现家兔感染RHDV2,这为RHDV2的合理防控提供了科学参考。
