硫酸化党参多糖对H2O2致RAW264.7细胞损伤和小鼠急性酒精损伤的保护作用
2022-07-07孙嘉琪杨诗靖郭世宁石达友
孙嘉琪,杨诗靖,谭 盈,白 霖,郭世宁,2,石达友,2*,刘 翠*
(1.华南农业大学兽医学院,广州 510642; 2.广东省兽用中药与天然药物工程技术研究中心,广州 510642)
酗酒是一个重要的全球健康问题,酒精摄入过多会引起机体肝损伤、免疫功能及脂质代谢紊乱,其中免疫功能失调在急性酒精损伤的发展中扮演着重要角色。研究表明,酒精诱导的急性损伤模型中,小鼠体内炎性细胞因子、趋化因子增加,激活体内免疫系统。在中医理论中,酒性湿热,过量饮酒之后,湿热毒邪蕴结体内,损伤及脾,致脾之运化功能失司,机体免疫力下降。党参(())作为我国传统药物,具有健脾益气、养血生津之功效,常用于脾肺气虚、食少倦怠、咳嗽虚喘等方面的治疗。现代研究表明,党参含有多种天然药理活性成分,如多糖、皂苷、生物碱、黄酮类等,其中党参多糖(polysaccharide,CP)具有包括免疫调节、抗氧化、抗肿瘤等广泛的药理作用。研究表明,CP可改善由环磷酰胺所致免疫抑制大鼠的胸腺指数、脾脏指数,提高血清免疫球蛋白G(IgG)、免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、补体C3、补体C4水平,增强大鼠的免疫功能。近年来,利用硫酸化修饰获得的硫酸化多糖具有较好的免疫调节作用。本研究旨在探究硫酸化党参多糖(sulphatedpolysaccharide,SCP)对小鼠急性酒精损伤的保护作用,筛选出对急性损伤具有良好保护作用的中草药活性成分,为研制新型中兽药提供理论依据。
1 材料与方法
1.1 细胞
RAW 264.7细胞,来源于ATCC细胞库。
1.2 试验动物
四周龄雄性昆明小鼠,体重20~25 g,购自济南朋悦实验动物繁殖有限公司,实验单位使用许可证编号:SYXK(粤)2014-0136,合格证号:37009200008032。试验期间饲喂小鼠全价饲料,自由饮水及采食,室温控制在19~25 ℃,相对湿度为30%~70%。
1.3 主要仪器与试剂
BDS系列倒置生物显微镜购自重庆奥特光学仪器责任有限责任公司;Thermo 3111CO培养箱购自美国Thermo Fisher Scientific;MK3型酶标仪购自赛默飞(上海)仪器有限公司;DMEM培养液、胎牛血清购自Gibco公司;磷酸缓冲盐溶液(PBS)、青链霉素双抗购自北京鼎国生物技术有限公司;二甲基亚砜(DMSO)购自天津市灏洋生物制品科技责任有限公司;噻唑蓝(MTT)购自索莱宝生物科技有限公司;30% HO试剂购自广州化学试剂厂,批号:20160401-1;ELISA检测试剂盒购自上海酶联生物科技有限公司,批号:201709。
1.4 制备CP与SCP
用水煎醇沉法从党参饮片中提取总多糖,选用sevage法去除蛋白,以DEAE-52纤维柱分离纯化,制备CP。采用氯磺酸-吡啶法,以氯磺酸-吡啶(1∶6)制备酯化试剂,将CP在80 ℃下震荡反应3 h,乙醇沉淀后制备SCP。SCP的制备方法参照文献[11];采用苯酚-硫酸法,测定CP糖含量为81.20%,SCP糖含量为66.30%。
1.5 体外试验
1.5.1 RAW 264.7细胞急性损伤模型建立 以10%胎牛血清DMEM培养液培养RAW 264.7细胞,待其生长至对数生长期时用于试验。将细胞浓度调整至5×10个·mL加入96孔板,每孔100 μL,37 ℃、5% CO培养17 h后,在每孔分别加入不同浓度的HO,从浓度为200 mmol·L倍比稀释11个浓度,分别于0.5、1 h后,用PBS漂洗2次,DMEM培养液换液,加入MTT 30 μL,继续培养4 h,加入DMSO 100 μL,摇匀,酶联免疫仪检测570 nm处吸光值(A值),计算RAW 264.7细胞经HO氧化损伤刺激的抑制率:细胞抑制率(%)=(空白组OD组-HO组OD值/空白组OD值)×100。
1.5.2 SCP对HO诱导细胞的生长状态的影响 将处于对数生长期的RAW 264.7细胞浓度调至5×10个·mL,加入96孔板中,每孔100 μL,37 ℃、5% CO培养24 h后,分别加入不同浓度的CP与SCP,加入的CP和SCP浓度根据前期预试验结果筛选得出,CP浓度为2、2、2mg·mL,SCP浓度为2、2及2mg·mL。另设空白对照组(加含10%胎牛血清DMEM培养液)及阳性对照组(10 μg·mL),继续培养24 h后,加入终浓度为12.5 mmol·L的HO培养1 h,建立HO氧化损伤;应用倒置显微镜观察HO刺激下各组RAW 264.7细胞生长状态。
1.5.3 SCP对HO诱导细胞的吞噬功能的影响 如“1.5.2”所述建立HO氧化损伤后,收集细胞,PBS洗涤细胞2次,各组分别加入FITC-葡聚糖,37 ℃避光孵育30、60、90 min,另设4 ℃对照组;孵育后各组加入PBS,2 000 r·min离心10 min,弃去上清,重复洗涤2次,除去未吸附的FITC-葡聚糖;PBS重悬细胞,配成1×10个·mL悬浮液,以未加FITC-葡聚糖的RAW 264.7作为阴性对照,流式细胞仪检测染色细胞荧光。
1.5.4 SCP对HO诱导细胞的细胞因子释放的影响 如“1.5.2”所述建立HO氧化损伤后,收集各组细胞上清液,采用ELISA法分别测定上清液白介素-2(IL-2)、白介素-4(IL-4)、白介素-10(IL-10)、干扰素-γ(IFN-γ)的含量。
1.6 体内试验
1.6.1 试验分组与处理 90只雄性昆明小鼠,适应性饲养7 d,随机分成9组,分别为空白对照组(B),模型对照组(MO),VC对照组(VC),CP低、中、高剂量组(CPL、CPM、CPH),SCP低、中、高剂量组(SCPL、SCPM、SCPH)。CP与SCP的3个剂量组分别按100、200、300 mg·kg小鼠体重每天进行灌胃维生素C,VC组按100 mg·kg小鼠体重每天进行灌胃,B和MO组给予同体积双蒸水,连续灌胃30 d,末次灌胃后,禁食16 h,除B组外其余组小鼠灌胃50%乙醇12 mL·kg建立小鼠急性酒精损伤模型。
1.6.2 生长情况 试验期间观察各组小鼠生长情况。分别于给药前(D)和给药后第7(D)、14(D)、21(D)及30(D)天称量各组小鼠体重,计算平均体重,并计算平均日增重(ADG)=(终末体重-初始体重)/天数。
1.6.3 血液生理学检测 灌服乙醇6 h后,每组随机抽取5只小鼠,摘眼球采抗凝血,用全自动血细胞分析仪测定血液中白细胞(WBC)、红细胞(RBC)、血小板(PLT)、血红蛋白(HGB)、淋巴细胞(LYM)和红细胞比容(HCT)的含量变化。
1.6.4 血清生化学检测 灌服乙醇6 h后,每组随机抽取5只小鼠,摘眼球采血,析出血清,用全自动血生化分析仪测定血清中甘油三酯(TG)、总胆固醇(TC)、乳酸脱氢酶(LDH)的含量变化。
1.6.5 血清免疫因子测定 灌服乙醇6 h后,每组随机抽取5只小鼠,摘眼球采血,分离血清,用ELISA法测定IL-2、IL-4、IL-10和IFN-γ的含量。
1.6.6 脏器指数 造模6 h后,分别对每组小鼠称量体重,剖检,取心、肝、脾、肺、肾,称重,计算脏器指数。脏器指数=脏器重量(mg)/体重(g)。
1.7 数据处理
试验数据用SPSS 22.0统计分析软件单因素ANOVA分析各组间的差异显著性,通过Duncan’s新复极差检验法进行各组间的多重比较,结果以“平均数±标准误”表示。采用GraphPad Prism 5软件制作柱状图。
2 结 果
2.1 RAW 264.7细胞急性损伤模型建立
不同浓度、不同作用时间下HO刺激RAW 264.7细胞的抑制率如图1所示,200 mmol·L的HO对RAW 264.7的抑制率均最高,随着HO浓度的降低对RAW 264.7细胞的抑制作用呈下降趋势,25~200 mmol·L的HO作用0.5 h下对RAW 264.7细胞的抑制率>50%;12.5~200 mmol·LHO作用1 h对RAW 264.7细胞的抑制率>50%,且12.5与25、50 mmol·LHO作用1 h的抑制率无显著差异(>0.05)。因此,选择12.5 mmol·LHO作用1 h建立RAW 264.7细胞急性损伤模型。

A. H2O2刺激0.5 h;B. H2O2刺激1 h。柱上不同字母表示差异显著(P<0.05)A. H2O2 stimulate 0.5 h; B. H2O2 stimulate 1 h. Different letters on the colum indicate significant difference (P<0.05)图1 不同浓度H2O2对RAW 264.7细胞的抑制率Fig.1 Inhibition rate of different concentrations of H2O2 on RAW 264.7 cells
2.2 SCP对H2O2诱导细胞的生长状态的影响
各组RAW 264.7细胞生长状态如表1所示,B组 细胞生长状态良好,贴壁性好,个别细胞有轻微分化,细胞密度大,局部细胞发生复层;MO组细胞贴壁不良,大部分细胞发生完全分化,细胞较为稀疏,密度较B组低,培养液中略微存在细胞碎片。除CPL组细胞密度较低外,其余各给药组细胞生长状态良好,密度较大,局部细胞出现复层,与B组相似。其中SCP各组的细胞密度、生长状态较佳,与B组及VC组相似。
2.3 SCP对H2O2刺激下RAW 264.7细胞的吞噬功能影响
由表2可知,4 ℃条件下,除SCPL组外,各组细胞的吞噬率均最低;37 ℃条件下,随作用时间的延长,各组细胞的吞噬率呈上升趋势。不同温度与作用时间下MO组的细胞吞噬率均最低,37 ℃时显著低于B组。4 ℃条件下,SCPL、SCPM、CPL组显著高于MO组(<0.05),且SCPL、SCPM、CPL组吞噬率与VC组差异不显著(>0.05);37 ℃下作用30 min,除SCPL组外,其余各组吞噬率均显著高于MO组(<0.05),其中SCPH、CPM组与VC组差异不显著(>0.05);作用60 min,SCPL、CPL组与VC组差异不显著(>0.05),SCPM组显著高于VC组(<0.05);作用90 min,除CPM组外,各组吞噬率均显著高于MO组(<0.05),其中SCPL、SCPM组与VC组差异不显著(>0.05)。SCP对HO刺激下RAW 264.7细胞的吞噬作用优于CP,尤其是SCPL、SCPM组。
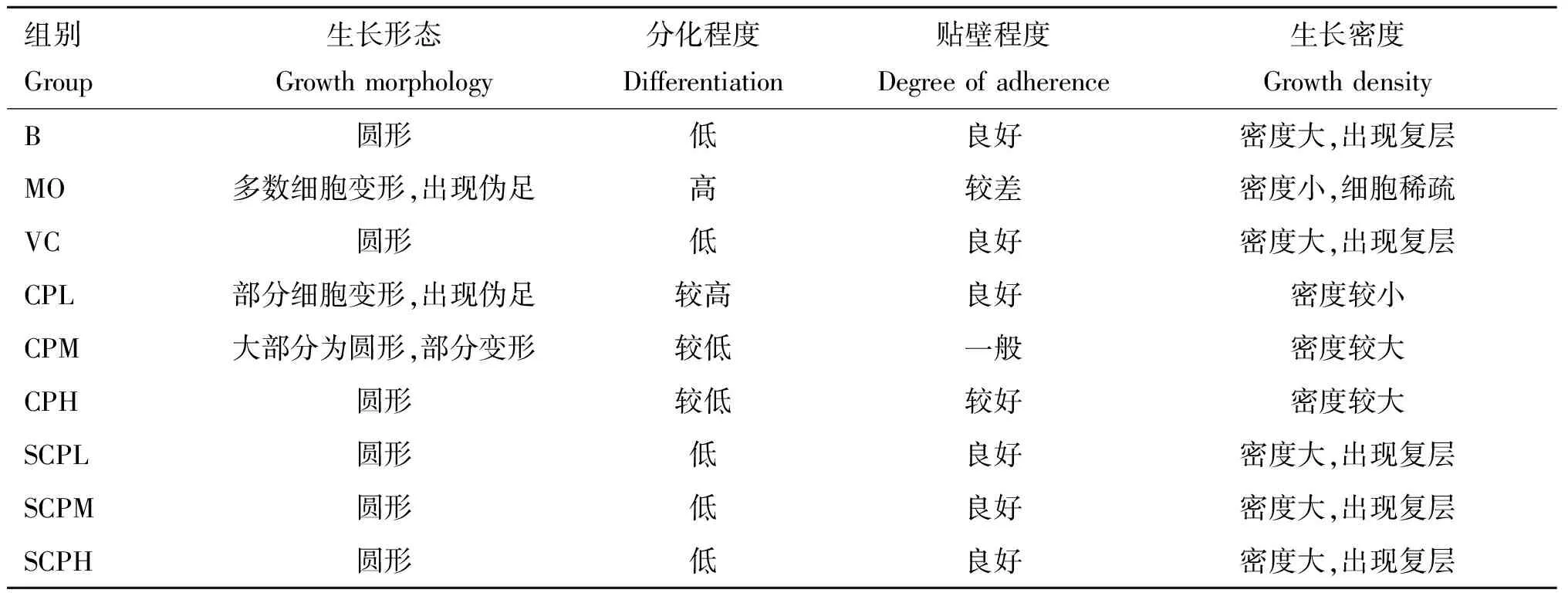
表1 各组对H2O2刺激下RAW 264.7细胞生长状态的影响
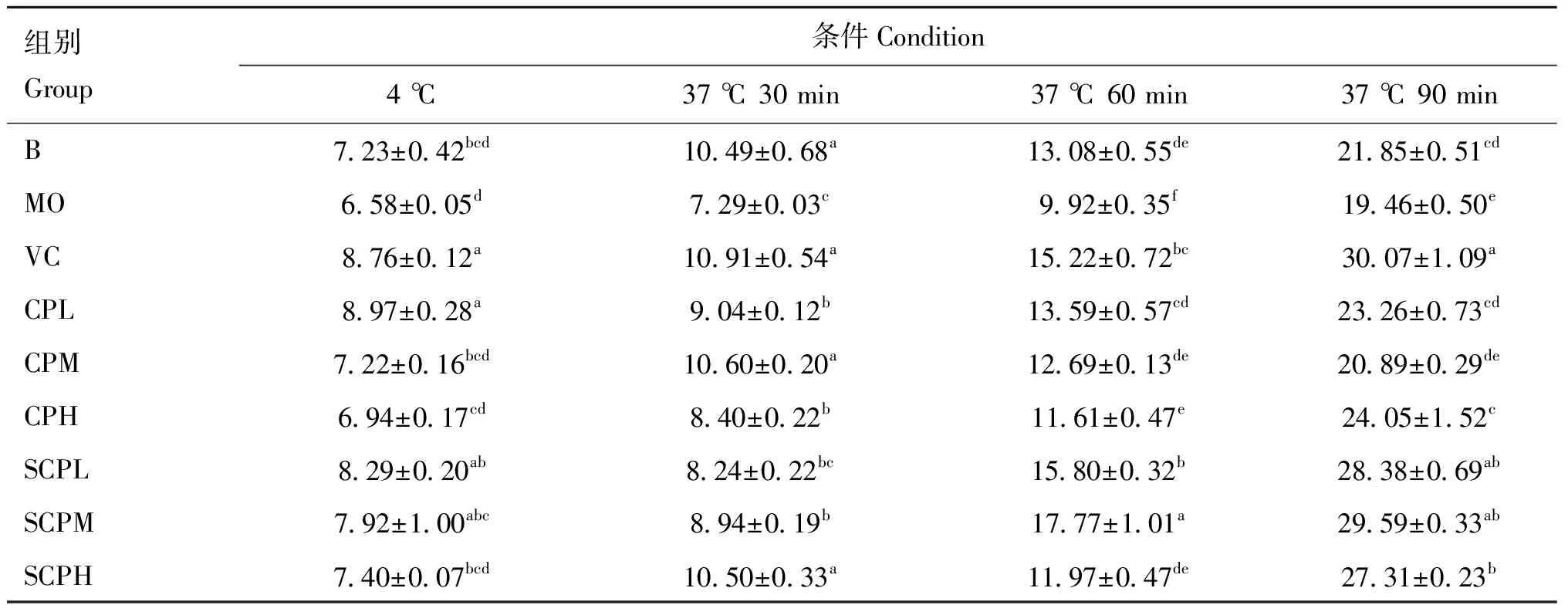
表2 各组对H2O2刺激下RAW 264.7细胞的吞噬率影响
2.4 SCP对H2O2刺激下RAW 264.7细胞的细胞因子水平影响
由表3可知,各组IL-2水平,与B组相比,MO组显著降低(<0.05),各SCP与CP组的IL-2水平均升高,与B组无显著差异(>0.05);IL-4水平,与B组相比,MO组IL-4水平显著升高(<0.05),SCPL、SCPM、SCPH及CPH组IL-4水平显著低于VC组(<0.05);IL-10水平,与B组相比,MO组IL-10水平降低,VC、CPL、SCPH和SCPL组IL-10水平高于MO组,且SCPH组IL-10水平高于VC组,但各组之间差异不显著(>0.05);IFN-γ水平,与B组相比,MO组IFN-γ水平显著降低(<0.05),各SCP与CP组的IFN-γ含量显著高于MO组(<0.05),其中SCPL、CPL组与B组、VC组差异不显著(>0.05)。SCP各组对IL-4分泌的抑制作用以及对IFN-γ、IL-10分泌的促进作用优于CP各组,对IL-2分泌的促进作用与CP各组无显著差异,因此SCP对急性损伤细胞分泌细胞因子的调节作用效果优于CP。
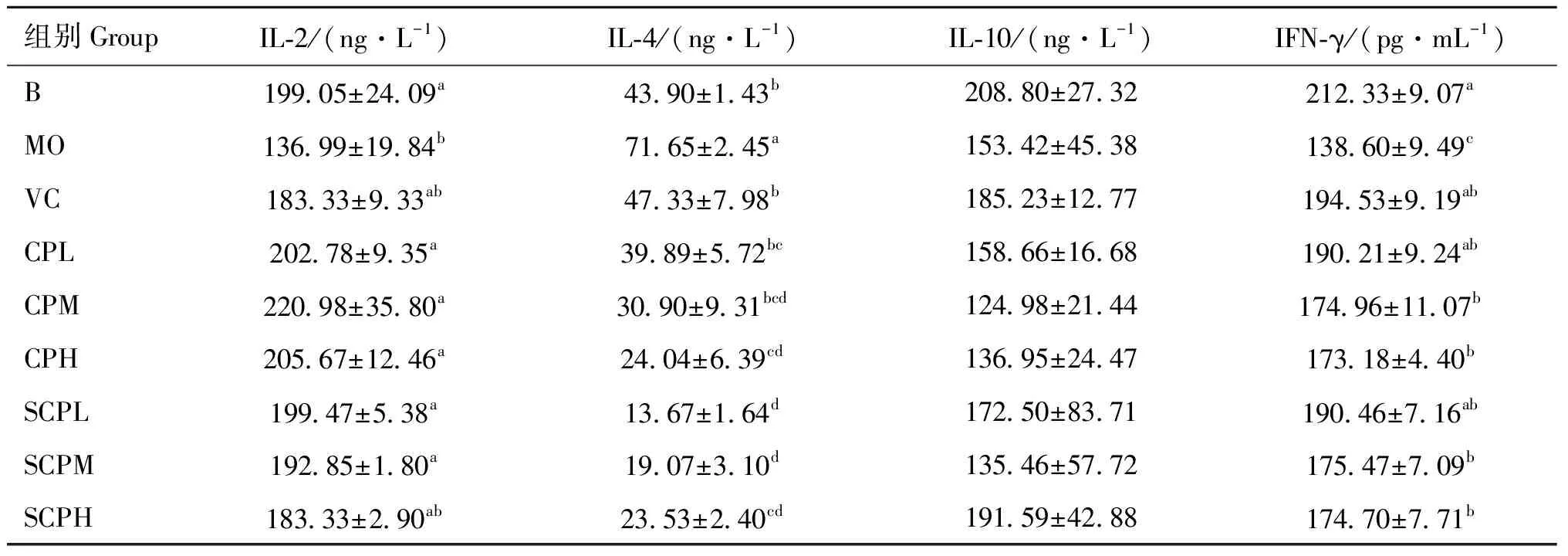
表3 各组对RAW 264.7细胞分泌细胞因子水平影响(n=5)
2.5 SCP对小鼠生长情况的影响
观察各组小鼠30 d内的生长情况,各组小鼠均精神正常、饮食正常,被毛顺滑,无脱毛或毛发杂乱现象。如表4所示,在D,各组小鼠体重无显著差异(>0.05);在D,SCPH组小鼠体重显著高于B组与MO组体重(<0.05);D,SCPH组小鼠体重显著高于B组(<0.05);在D,SCPH、CPM组小鼠较其他组高,但无显著差异(>0.05);在D,SCPH、CPL组小鼠体重较其余组高,但无显著差异(>0.05);各组小鼠平均日增重无显著差异(>0.05)。
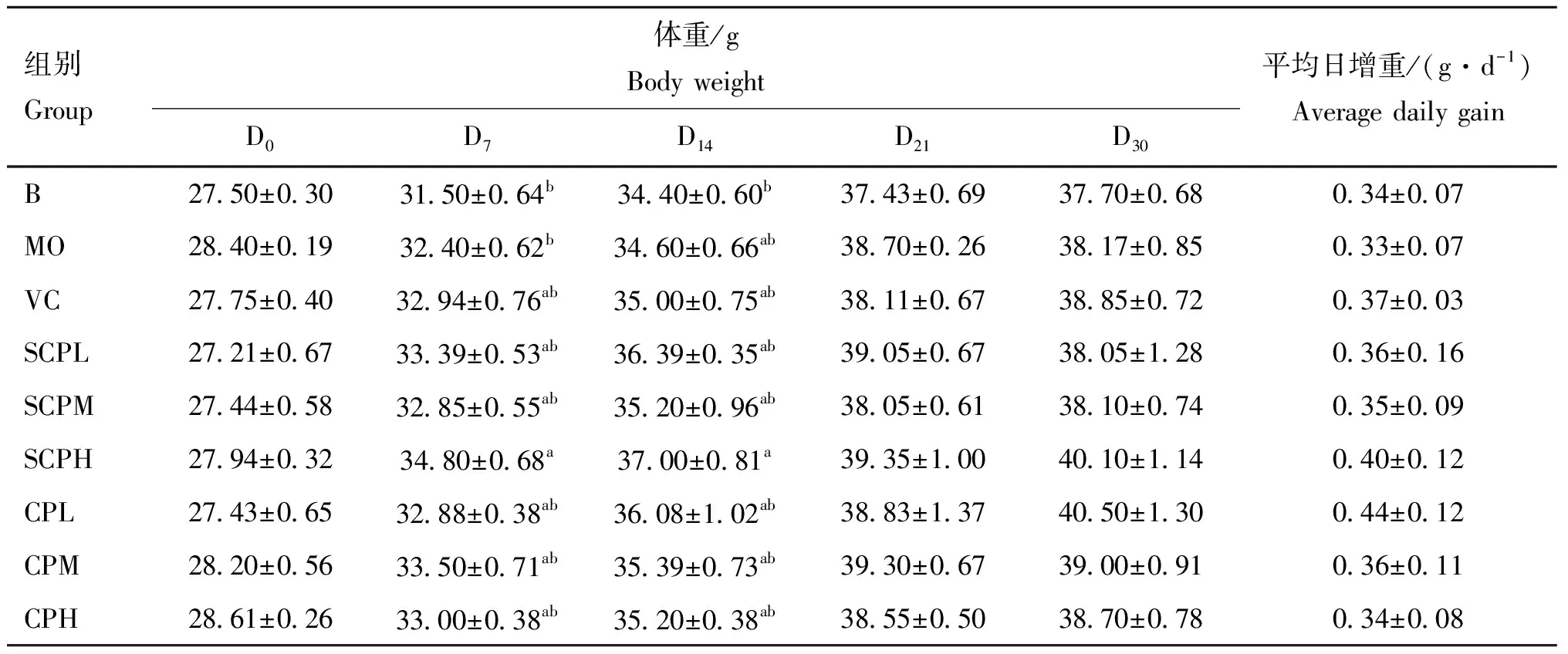
表4 各组小鼠的生长情况(n=10)
2.6 SCP对酒精损伤小鼠血液生理学指标影响
根据表5,各组WBC结果显示,与B组相比,MO组WBC数量升高,且高于正常范围4.63×10~7.63×10个·L,SCPL、SCPM、CPL和CPH组能够使WBC恢复至正常水平(<0.05);RBC结果显示,MO组处于正常范围9.11×10~13.17×10个·L,但与B组相比显著下降(<0.05),各给药组RBC数量均较MO组上升,其中SCPH以及CP各组显著升高(<0.05);小鼠PLT正常范围为762.93×10~1 189.91×10个·L,而本研究中VC组PLT以及各给药组均高于正常范围,这可能是因为雄性小鼠PLT水平会随着年龄的增长而增加;HGB正常范围为141.69~173.81 g·L,MO组HGB低于正常范围,除SCPM组外,各给药组可升高HGB至正常范围;LYM的正常范围为57%~85%,MO组LYM在正常范围内,但有升高趋势,SCPM以及CP各组LYM较MO组显著下降(<0.05);HCT的正常范围为44%~56%,MO组HCT处于正常范围,但存在下降趋势,SCPH组以及CP各组HCT较MO组显著上升(<0.05)。 SCP能够恢复小鼠血液中WBC、HGB至正常水平,一定程度上改善酒精损伤小鼠的血液生理学指标。
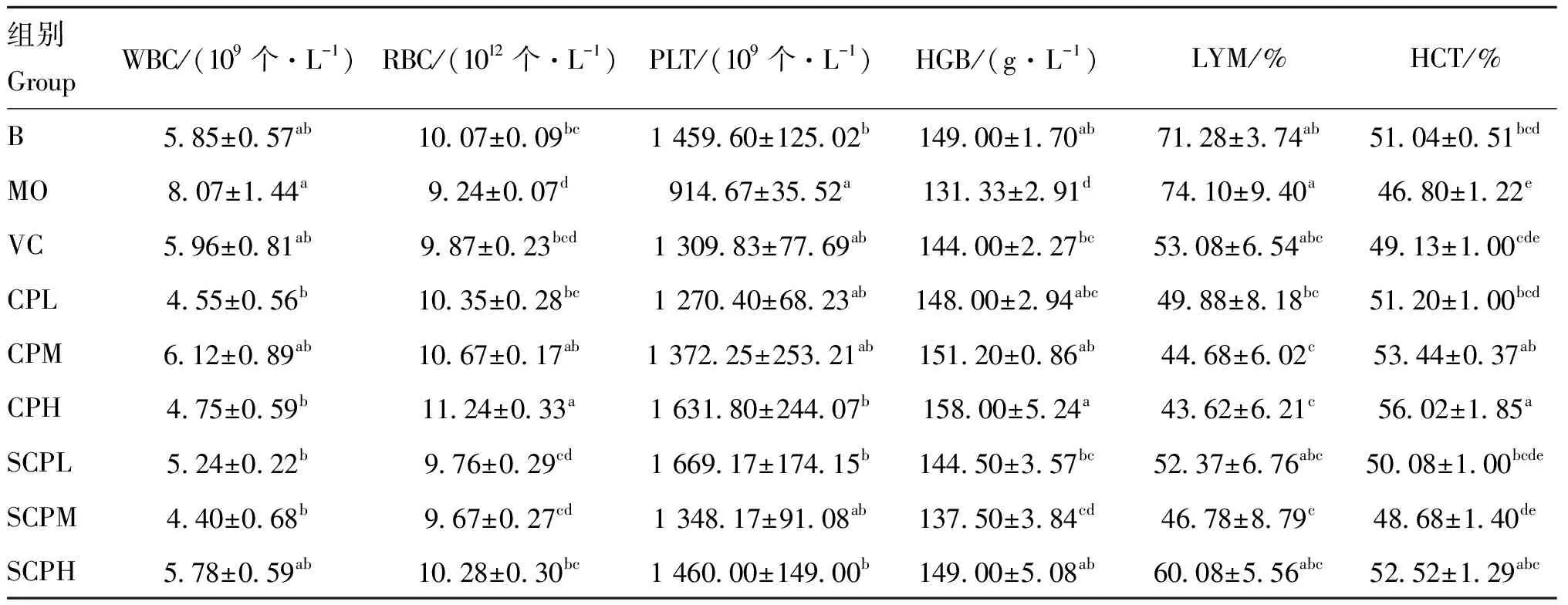
表5 各组小鼠的血液生理指标(n=5)
2.7 SCP对酒精损伤小鼠血清生化学指标影响
TG正常生理范围为1.06~2.20 mmol·L,由表6可知,MO组为(4.10±0.78)mmol·L,显著高于正常生理范围(<0.05),SCPL和SCPM组能够使TG含量恢复至正常范围(<0.05);TC正常生理范围为2.86~3.64 mmol·L,MO组为(1.96±0.17)mmol·L,显著低于生理范围(<0.05), 除SCPL和VC组外,各给药组显著升高(<0.05),其中SCPM和SCPH组使TC恢复至正常范围,效果最佳;LDH正常生理范围为1 325.8~2 193.3 U·L,MO组小鼠LDH为(607.25±245.00)U·L,显著低于生理范围(<0.05),SCP和CP均能显著升高LDH至正常范围(<0.05)。SCP和CP均能恢复小鼠血清中TG、TC、LDH至正常水平,改善酒精损伤小鼠的血清生化学指标,其中SCP对TG和TC的恢复作用优于CP。
2.8 SCP对酒精损伤小鼠血清免疫因子指标影响
由表7可看出,与B组相比,MO组IL-2水平显著下降(<0.05),与MO组相比,各给药组IL-2水平显著升高(<0.05),与B组无明显差异(>0.05),其中SCPL、SCPM、CPH组IL-2水平最高;在分泌IL-4水平上,MO组对比B组显著升高(<0.05),各给药组较MO组显著降低(<0.05),其中SCPL、SCPM、SCPH、CPM、CPH组显著低于VC组(<0.05),SCP各组的IL-4水平最低;IL-10水平,MO组对比B组有下降趋势,CPL、CPM组较MO组略有升高;各组分泌IFN-γ水平中,与B组相比,MO组显著下降(<0.05),与MO组相比,除CPH、SCPL组外,各给药组显著升高(<0.05),与B组无明显差异(>0.05),其中SCPH、CPL组IFN-γ水平最高。SCP各组对IL-4分泌的抑制作用优于CP各组,对IL-2、IFN-γ分泌的促进作用与CP各组无显著差异。说明SCP和CP对急性损伤小鼠分泌细胞因子具有一定调节作用,且SCP对IL-4分泌的抑制作用优于CP。

表6 各组小鼠的血液生化指标(n=5)
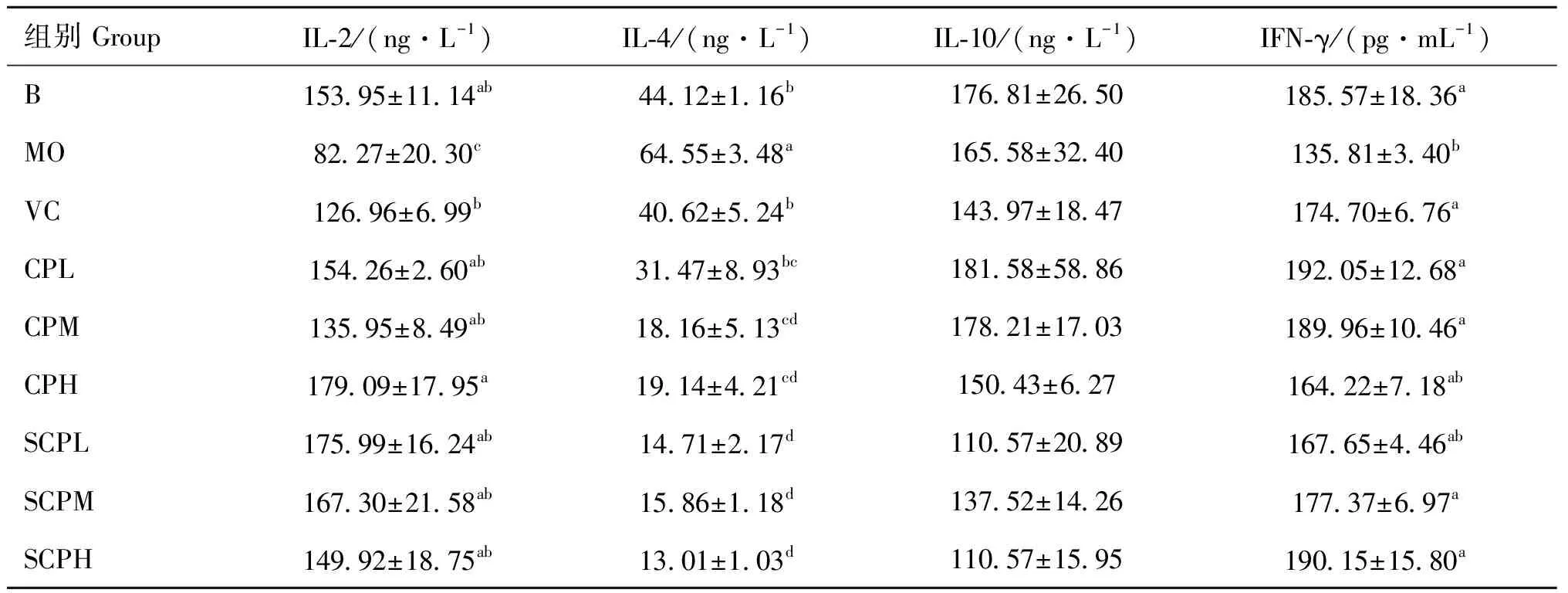
表7 各组小鼠血清细胞因子水平(n=5)
2.9 SCP对酒精损伤小鼠脏器指数影响
如表8所示,与B组相比,MO组小鼠肝脏指数显著升高(<0.05),与MO组相比,各给药组肝脏指数显著降低(<0.05),且与B组差异不显著(>0.05),其中SCPL、CPL、CPM组肝脏指数最低;各组小鼠心、脾、肺、肾等器官的脏器指数无显著差异(>0.05)。SCP各组对小鼠肝脏指数恢复作用与CP无显著差异,说明SCP与CP均能改善酒精造成的小鼠急性肝损伤。
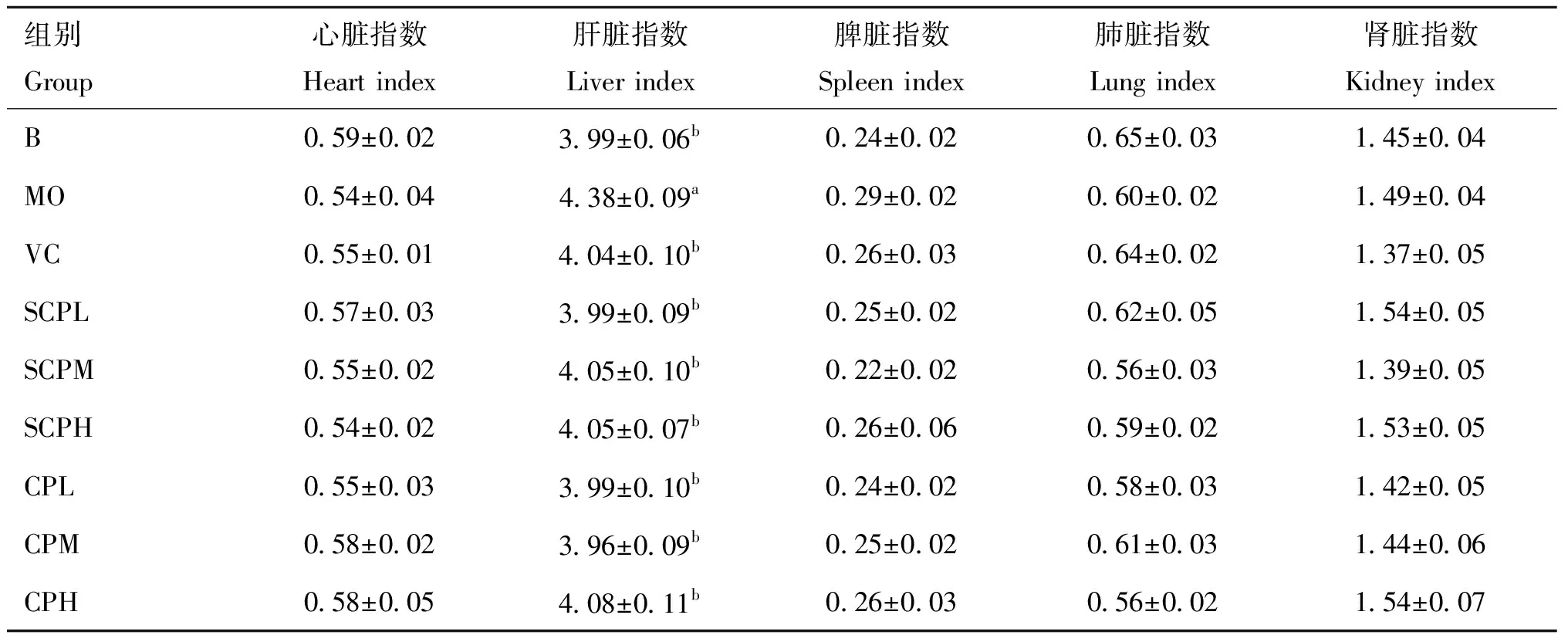
表8 各组小鼠的脏器指数(n=10)
3 讨 论
3.1 SCP对H2O2刺激的巨噬细胞吞噬作用的影响
吞噬作用是生物体内巨噬细胞、树突状细胞、中性粒细胞等免疫细胞识别和吞噬外来物质的功能,是生物体的基本防御机制。其中,巨噬细胞能够参与特异性免疫和非特异性免疫,对特定的细胞碎片及病原体进行吞噬和消化,并且分泌白介素1β(IL-1β)、肿瘤坏死因子-α(TNF-α)、白介素-12(IL-12)等促炎因子,进行免疫调节。研究表明,CP可显著提升小鼠巨噬细胞吞噬能力,且能显著提高巨噬细胞TNF-α和IL-1β的分泌量,促进抗体产生,增强小鼠非特异性免疫功能。目前许多研究显示,硫酸化修饰后的多糖免疫活性增强,如硫酸化枸杞多糖能显著促进巨噬细胞的增殖,提高其吞噬功能,紫菜硫酸多糖可通过调节巨噬细胞、T细胞、B细胞等发挥其免疫调节作用。本试验结果显示,不同温度与作用时间下MO组的细胞吞噬率均最低,显著低于B组,表明HO刺激下RAW 264.7细胞的吞噬作用降低,4 ℃条件下,SCPL、SCPM及CPL组的细胞吞噬率显著高于MO组;37 ℃ 条件下,随作用时间的延长,RAW 264.7细胞的吞噬率逐渐升高,SCP对HO刺激下RAW 264.7细胞的吞噬作用优于CP,尤其是SCPL、SCPM组。因此,SCP促进细胞吞噬的效果优于CP,这可能是由于SCP促进了巨噬细胞的增殖,并诱导其向M1型分化,故能显著提高巨噬细胞的吞噬功能。
3.2 SCP对乙醇刺激小鼠脏器指数的影响
脏器指数能够反映出动物机体中各脏器的生长发育情况,间接体现出各脏器的功能强弱、损伤程度,其中肝是动物体内重要的代谢器官之一。试验第30天,采取乙醇灌胃的方法制造小鼠急性损伤模型。此方法对于急性损伤的研究领域比较常见,灌胃乙醇后小鼠肝细胞排列紊乱、出现水肿、炎性细胞浸润。本试验中,SCP和CP能够降低肝脏指数,说明SCP与CP能够缓解乙醇造成的肝损伤。
3.3 SCP对乙醇刺激小鼠血液生理指标的影响
血常规检测是诊断血液疾病的基础检查手段,可判断体内炎症、贫血或凝血等问题。WBC、LYM、PLT升高常见于各种感染与炎症性疾病,RBC、HGB、HCT的降低则表示有贫血、出血等现象。本试验中MO组小鼠血液WBC、LYM水平显著升高,其中WBC高于正常生理范围,提示小鼠存在炎症;RBC、HGB、HCT、PLT水平降低,其中HGB低于正常生理范围,提示小鼠存在出血、贫血现象。SCP和CP则可以不同程度地改善小鼠血液生理学指标,将WBC和HGB恢复至正常水平,具有一定的抗炎、促凝作用。其作用机制可能与抑制白细胞的产生以及促进血小板的产生有关,从而起到降低体内炎症、调节机体免疫功能的作用。
3.4 SCP对乙醇刺激小鼠血清生化指标的影响
血清生化检测可反映机体各器官的代谢水平,用于内脏疾病的诊断。TG表示血清中的血脂含量,TG过高提示肝和肾存在炎症或损伤。本试验中MO组小鼠TG显著高于正常生理范围,而SCP和CP均将其恢复至正常范围,从而缓解肝和肾损伤。TC为血清总胆固醇,TC过低提示存在肝损伤。MO组TC显著低于生理范围,除SCPL组外,各给药组升高TC至正常范围,改善肝损伤。LDH表示乳酸脱氢酶,广泛分布于各个器官,其中心、肾、骨骼肌中含量最丰富。因此LDH异常提示肾或心存在损伤。MO组小鼠LDH显著低于生理范围,SCP和CP均能升高LDH至正常范围,改善肾损伤。本试验中MO组小鼠血清中TG、TC、LDH含量异常,超出正常生理范围,提示小鼠造模后出现肝和肾损伤,因此,本试验中酒精诱导小鼠急性损伤模型造模成功。SCP和CP均能使TG、TC、LDH恢复至正常水平,改善急性酒精性损伤小鼠血生化指标,其中SCP对TG和TC的恢复效果优于CP,对小鼠急性损伤具有保护作用。
3.5 SCP对H2O2刺激的巨噬细胞以及乙醇刺激的小鼠分泌免疫因子的影响
IL-2是一种T细胞生长因子,对T细胞的成熟、增殖、分化至关重要,还可增强NK细胞的细胞溶解活性,并促进B细胞产生免疫球蛋白。机体内IL-2的表达失调与免疫疾病相关,常作为治疗疾病的靶点。研究表明,正常小鼠服用复方党参口服液后血清中的-2基因的表达量显著升高。硫酸化后的多糖能够升高免疫抑制型鸡外周血IL-2水平,从而提高免疫功能,还能够显著提高雏鸭体内IL-2水平,提高其抗病毒功能。在本研究中,体外试验结果显示,各SCP与CP组的IL-2水平均升高,且与B组无显著差异,表明SCP和CP能够显著促进细胞分泌IL-2。在体内试验中,SCP和CP能够显著提升IL-2水平,其中SCPL及CPH组效果最佳,优于VC组。体内试验结果与体外试验结果相一致。提示SCP和CP可能通过提高IL-2的分泌量,促进T细胞的增殖与分化,刺激B细胞的增殖,从而提高机体免疫功能。
IL-4是一种来源于T细胞的B细胞生长因子,可以触发Th2细胞分化、M2巨噬细胞极化,还能够促进巨噬细胞表达抗原,杀死肿瘤细胞,参与MHCⅡ类抗原的调节和FcR的表达。研究显示,党参炮制品能够降低免疫抑制家兔血清中过高的IL-4水平。硫酸化后的多糖降低IL-4效果更加显著,能够降低鸡骨髓源树突状细胞分泌IL-4水平。在体外试验与体内试验中,SCP和CP均能显著降低IL-4水平,说明SCP和CP可能通过抑制机体分泌IL-4,降低机体特异性免疫反应,增强非特异性免疫反应,从而调节免疫功能;其中SCP各组IL-4水平显著低于VC组(<0.05),表明SCP降低IL-4水平作用优于CP。
IL-10是一种炎症与免疫抑制因子,能够抑制Th1细胞IL-2和IFN-γ的分泌,抑制IL-22、IL-20、IL-19等促炎细胞因子、趋化因子和趋化因子受体的表达。本试验中SCP和CP在一定程度上能够促进IL-10水平,且SCP各组的促进效果优于CP,与前人报道一致,说明SCP可能通过抑制促炎因子,缓解机体炎症反应,起到免疫调节作用。
IFN-γ能够激活巨噬细胞,诱导巨噬细胞趋向于M1型极化,还能够调节癌细胞和受感染细胞的免疫状态。研究显示,党参多糖纳米乳灌胃免疫抑制模型小鼠能够提高其IFN-γ水平。本研究体外试验结果显示,SCP和CP能够显著促进IFN-γ分泌,与前人研究结果相一致。体内试验结果与体内试验结果相近,其中SCPH组对IFN-γ分泌的促进作用优于CP,尤其是SCPH组。说明SCP能够通过促进IFN-γ分泌,刺激巨噬细胞向M1型分化,增强其吞噬活功能,从而提高机体的非特异性免疫功能。
4 结 论
一定浓度的SCP和CP可缓解HO建立的RAW 264.7细胞急性损伤的细胞贴壁不良、密度降低、细胞死亡等现象,促进细胞分泌IL-2、INF-γ,在促进巨噬细胞吞噬、抑制细胞分泌IL-4方面,SCP的效果优于CP。乙醇建立的小鼠急性损伤模型中,一定浓度的SCP和CP可升高小鼠血液中RBC、HGB、HCT、PLT含量,降低WBC、LYM含量;升高血清中TC、LDH含量,降低TG含量;提高细胞因子IL-2、INF-γ分泌水平,降低IL-4分泌水平。在改善血清中IL-4、TG和TC含量方面,SCP效果优于CP。
