伪狂犬病病毒变异株gC抗体间接ELISA检测方法的建立及初步应用
2022-07-07吴学敏陈如敬陈秋勇车勇良刘玉涛周伦江王隆柏
吴学敏,陈如敬,陈秋勇,车勇良,严 山,刘玉涛,周伦江,王隆柏
(福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心,福州 350013)
伪狂犬病病毒(pseudorabies virus,PRV)是一种神经性疱疹病毒,可感染多种哺乳动物,包括反刍动物、食肉动物和啮齿动物,导致易感动物中枢神经系统的疾病。猪是PRV的天然宿主,伪狂犬病(pseudorabies,PR)对养猪业危害性大,具有高度隐性感染的特点,耐过的母猪常呈潜伏感染。2011年以来,许多猪场发生了PR,主要表现为猪群PRV-gE抗体阳性率显著升高,普遍出现母猪流产、仔猪神经症状和死亡率高等临床情况。目前,该病在部分地区偶有发生,也还发现免疫PRV疫苗的养猪场发生伪狂犬病,并分离到PRV新的流行毒株。相关研究表明,新分离的PRV毒株出现了变异,而经典毒株的疫苗未能完全保护变异强毒力PRV的感染。PRV已发现11种功能性蛋白,其中,gC糖蛋白为囊膜蛋白,广泛分布于病毒颗粒的囊膜表面,能够诱导机体产生高水平的中和抗体。自2012年以来,大量关于PRV新分离毒株的研究表明,主要免疫保护基因(、、)均发生不同程度的变异,与疫苗Bartha毒株差异较大。因此,掌握猪群保护性抗体水平情况,在PR的预防中尤为重要。
本研究通过克隆表达变异PRV FJ-2012株基因,利用原核表达的gC重组蛋白以建立PRV-gC 蛋白抗体ELISA检测方法,并对PR流行场和净化场进行检测,为猪场PR的防控提供依据,也为进一步开展变异PRV血清学研究奠定基础。
1 材料与方法
1.1 毒株和细胞
PK细胞、pCzn1 质粒和Arctic express(DE3)感受态细胞由福建省农业科学院畜牧兽医研究所保存。2012年,从福建省免疫伪狂犬疫苗发生猪伪狂犬病的猪场分离到PRV,并命名为FJ-2012株,该毒株由本实验室保存。
1.2 试剂材料
限制性内切酶I和I购自宝生物工程(大连)有限公司,EasyPureQuick Gel Extraction Kit,EasyPurePlasmid MiniPrep Kit (EM101),酶标记猪二抗均购自北京全式金有限公司。蛋白纯化的Ni-IDA亲和层析胶购自Novagen公司。PRV-gB糖蛋白ELISA抗体检测试剂盒购自西班牙海博莱公司。试验涉及相关的猪血清(包括PRV-gB/gE抗体均为阳性或者阴性的血清)由本实验室制备和保存。
1.3 pCzn1-gC重组质粒的构建
根据GenBank中登录的PRV参考毒株全基因组序列(ID:KM189913.1),以gC蛋白的主要膜外区域(53 986—55 272)的片段序列设计基因的表达引物gC-F:5′-CATATGGGCACGACGCCCACCGGG-3′, gC-R:5′-TCTAGATTAGCTGGTCACGACGGGCCAGC-3′。引物由生工生物(上海)工程有限公司合成,预计扩增的片段大小为1 287 bp。 以PRV FJ-2012株的DNA为模板进行扩增,将扩增的片段插入pCzn1载体上,构建重组质粒。将该重组质粒转入Arctic express(DE3)感受态细胞中,进行PCR和双酶切(I、I)验证,并将重组质粒送生工生物(上海)工程有限公司进行测序。
1.4 pCzn1-gC重组蛋白的表达及纯化
双酶切及PCR验证均正确的单克隆菌落,加入IPTG至终浓度为0.5 mmol·L,37 ℃诱导表达目的蛋白。用12% SDS-PAGE和Western blot验证表达效果,以及使用Ni-IDA亲和层析纯化目的蛋白,BCA法测定目的蛋白浓度。
1.5 pCzn1-gC重组蛋白间接ELISA方法的建立
根据矩阵滴定法,确定间接ELISA方法的抗原包被浓度和血清稀释比例的最佳配比。通过检测40份PRV抗体阴性血清(gB和gE抗体均为阴性),统计分析样品的OD值的平均值(Mean)和标准方差(SD),初步确定阴阳性判断标准。通过检测猪繁殖与呼吸综合征病毒(PRRSV)抗体阳性血清、猪流行性腹泻病毒抗体(PEDV)阳性血清、猪圆环病毒2型抗体(PCV-2)阳性血清、猪瘟病毒抗体(CSFV)阳性血清、猪细小病毒抗体(PPV)阳性血清以及PRV抗体阳性血清(gB和gE抗体均为阳性),验证该方法的特异性。利用批内重复和批间重复试验,验证该ELISA方法的重复性。对PRV抗体阳性猪血清(gB和gE抗体均为阳性)倍比稀释后,确定该ELISA方法的敏感性。最终确定建立PRV-gC抗体间接ELISA方法。
1.6 gC抗体检测分析
1.6.1 与gB抗体检测对比 用上述建立的方法,对若干个猪场随机抽取的120份猪血清进行检测,同时使用某品牌商品化试剂盒(竞争ELISA方法)检测gB抗体,将检测结果进行对比分析。
1.6.2 不同猪场gC抗体检测对比 用上述建立的方法,对来源于PRV野毒阳性猪场的80份猪血清,及来源于PRV完全净化猪场的血清80份进行检测,将检测结果进行对比分析。
2 结 果
2.1 目的基因的扩增
以变异PRV FJ-2012株的核酸为模板,针对gC蛋白基因进行PCR扩增,目的条带约1 287 bp,将PCR产物送生工生物(上海)工程有限公司进行克隆测序,将序列与GenBank中的PRV对应序列进行比对确认扩增的片段为PRV病毒的gC蛋白基因。
2.2 gC蛋白表达载体构建
构建的pCzn1-gC重组质粒转化至Arctic express(DE3)表达菌,进行PCR和双酶切验证,PCR结果如图1可见到明显的目的条带,与预期的条带(1 287 bp)大小一致;酶切后产物跑胶也可见预期的条带(1 287 bp)。将抽取的质粒送去测序,测序的结果与病毒扩增的gC片段序列相似性为100%,说明成功构建了变异PRV FJ-2012株的gC蛋白表达载体。
M,DNA相对分子质量标准;1~3.pCzn1-gC重组质粒M. 2K marker;1-3. pCzn1-gC recombinant plasmid图1 PCR验证结果Fig.1 The results of PCR validation
2.3 gC重组蛋白的诱导表达
将构建好的表达菌于IPTG终浓度为0.5 mmol·L的LB培养基,37 ℃诱导表达4 h。收集细菌沉淀并裂解,SDS-PAGE胶显示在约47.5 ku处有一条明显的重组蛋白条带(图2),且Western blot试验也表明,在47.5 ku处有特异性条带。表明Arctic express(DE3)菌有表达出PRV-gC重组蛋白,并命名为“pCzn1-gC融合蛋白”。
2.4 gC重组蛋白间接ELISA方法
2.4.1 抗原包被最佳浓度和血清最佳稀释度 将纯化后的pCzn1-gC融合蛋白包被于ELISA板,采用矩阵法测试结果显示:当抗原包被浓度为10 μg·mL, 样品血清按1∶50稀释时,样品阳性OD值较大,为0.816,且P/N值也最大,为2.22。因此,最佳抗原包被浓度为10 μg·mL,最佳血清抗体稀释度为1∶50。
2.4.2 间接ELISA方法临界值的确定 参照本研究建立的方法,检测PRV-gB和PRV-gE抗体均为阴性的猪血清,初步确定gC蛋白抗体间接ELISA方法判定标准:被检样品OD值≥0.438判定为阳性,≤0.406判定为阴性,介于两者之间判定为可疑。
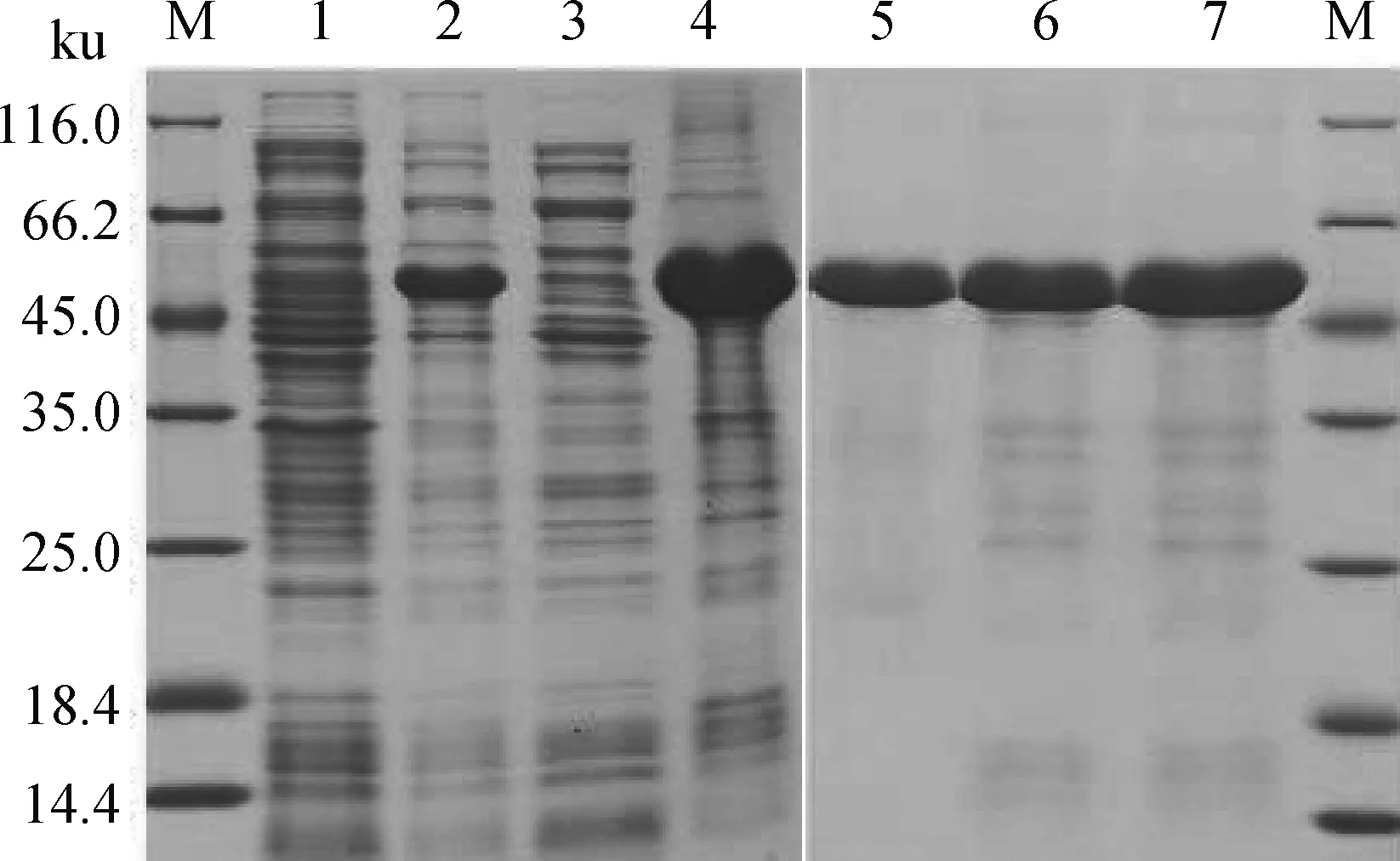
M.蛋白质分子质量标准;1.未诱导破碎菌液;2.诱导后破碎菌液;3.诱导破碎后菌液上清;4.诱导破碎后菌液沉淀;5~7.洗脱纯化后结果M.Protein maker;1.Uninduced broken bacterial liquid;2.Broken bacterial liquid after induction;3.Bacterial supernatant after induced crushing;4.Induced bacterial precipitation after crushing;5-7.Results after elution and purification图2 表达蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of expressed protein
2.4.3 特异性验证 采用本研究建立的方法,对PRRSV、PEDV、PCV-2、CSFV和PPV的阳性血清检测结果都为阴性,仅PRV抗体阳性血清为阳性,因此该方法的特异性良好,对其他病原抗体无交叉反应。
2.4.4 重复性试验 采用本研究建立的方法,对样品批内重复检测结果显示:每个样品重复测试OD值的方差为0.003~0.009,变异系数为0.5%~1.9%;批间重复检测结果显示:每个样品重复测试OD值的方差为0.009~0.024,变异系数为2.0%~3.9%;因此,本研究建立的ELISA方法稳定可用,具有良好的重复性。
2.4.5 敏感性试验 对PRV抗体阳性猪血清(gB和gE抗体均为阳性)进行倍比(1∶2~1∶128)稀释,用该方法检测结果表明:阳性血清以1∶32倍稀释后,再按1∶50进行稀释检测,即1 600倍稀释后仍能检测出阳性,表明本研究建立的ELISA方法具有较高的敏感度。
2.5 初步应用及符合率
用本研究建立的方法和商品化gB抗体检测试剂盒,对临床猪血清进行检测,结果显示:PRV-gC抗体阳性率为91.67%,PRV-gB抗体阳性率为95.00%,其中,商品化试剂盒测出阳性样品中的4份 和可疑样品中的1份,本方法结果均判定为阴性,因此两种抗体检测结果的整体符合率为95.83%。结果表明,在猪群血清中,PRV的gC蛋白抗体和gB蛋白抗体的阳性率基本一致,该方法可用于临床检测,为PRV的疫苗免疫效果评价提供参考。
2.6 不同猪场gC抗体检测结果
用本试验建立的方法,对来源于PRV野毒阳性猪场的80份猪血清,及来源于PRV野毒净化猪场的80份血清进行检测,两种猪场均免疫伪狂犬基因缺失疫苗,gC抗体检测结果如表1所示,PRV阳性猪场的gC抗体阳性率为96.25%(77/80),而PRV野毒完全净化猪场的gC抗体阳性率仅为78.75%(63/80)。从不同猪场gC抗体检测结果发现,PRV野毒完全净化猪场的gC抗体阳性率明显低于PR不稳定猪场,也明显低于本场gB抗体的阳性率,表明经典PRV毒株基因缺失疫苗免疫产生的gC抗体与变异FJ-2012株的gC蛋白不能起完全的免疫反应。

表1 不同猪场PRV抗体检测结果
3 讨 论
酶联免疫吸附测定法(enzyme linked immune sorbent assay,ELISA)是在免疫酶技术的基础上发展起来的一种免疫测定技术,可分为直接法、间接法、竞争法、双抗体夹心法等,原理都是抗原与抗体的结合反应。间接ELISA方法是在固相载体包被抗原,加入待检样品,再加入酶标抗体,再进行显色和读数,根据建立的阴阳性临界值进行判定结果。该方法具有操作方便、重复性好、特异性强、灵敏度高等特点,便于临床检测使用,且样品直接作为一抗未经标记处理,保证样品的原有特征,仅通过酶标二抗增强其反应信号,因此更适用于血液中病毒或疫苗产生抗体的检测。目前市售PRV gB-ELISA抗体检测试剂盒多数是基于 1~2个抗原表位建立的阻断ELISA方法,但流行的PRV变异株gB抗原位点出现了一定的漂移,因此阻断ELISA可能会出现一定比例的误判。本试验利用新分离的PRV变异毒株FJ-2012株的gC重组蛋白为包被抗原建立相应的ELISA检测方法,旨在提高ELISA检测方法的广谱性、特异性及敏感性,也基本能满足PRV血清学临床诊断的要求。
PRV基因组核苷酸碱基G+C含量高达75%,在所有糖蛋白中gB、gC和gD蛋白与宿主的免疫应答密切相关,是PRV感染诱导产生保护性免疫的主要免疫原性抗原。gC糖蛋白为PRV的囊膜蛋白,分布于病毒颗粒的囊膜表面,具有高度保守性,能够诱导机体产生高水平的中和抗体,是猪和小鼠细胞毒性T淋巴细胞的重要靶抗原,同时也是病毒与宿主细胞受体黏附的主要成分,被认为是一种有效的免疫反应诱导剂。有研究表明,利用变异伪狂犬病病毒gD和gC蛋白抗原表位串联体具有临床保护作用,有助于预防伪狂犬病病毒变异株的攻击。近几年,我国PRV新分离的毒株gC蛋白基因及对应氨基酸均发生不同程度变异,其中,gC蛋白63—69 aa出现7个氨基酸的插入,还有134—138 aa和143—153 aa区域都是gC蛋白重要的B细胞抗原线性表位。本研究检测结果也发现,存在感染PRV野毒的猪场gC抗体阳性率明显高于PRV野毒净化场,表明PRV变异毒株的gC蛋白抗原性有发生不同程度的改变,也验证了变异毒株gC蛋白基因序列和氨基酸序列变异在免疫学上的差异。
4 结 论
从2011年下半年PR的再次流行,很多免疫疫苗的猪也发生PR,再次提醒要重视该病的监测和净化。临床上使用的PRV血清学检测试剂盒大部分都是针对gE和gB蛋白抗体的检测,而本研究利用新分离PRV流行毒株的gC蛋白,建立了特异性强、灵敏度高和重复性好的PRV-gC蛋白抗体间接ELISA检测方法,完全能满足PRV野毒流行的猪场和PRV野毒净化猪场猪群PRV-gC蛋白抗体血清学诊断要求;从不同猪场gC抗体检测结果表明,经典PRV毒株基因缺失疫苗免疫产生的gC抗体与变异FJ-2012株的gC蛋白不能起完全的免疫反应。
