牛坏死杆菌的43 ku外膜蛋白在其黏附细胞中的作用初步分析
2022-07-07贺显晶肖佳薇郭东华
贺显晶,蒋 凯,肖佳薇,郭东华
(黑龙江八一农垦大学动物科技学院,大庆 163319)
牛坏死杆菌()属于梭杆菌属,是一种革兰阴性,无鞭毛,不形成芽胞和荚膜的严格厌氧菌,其广泛存在于自然界中。早期发现牛坏死杆菌是一个以继发感染为主的典型“机会主义”病原,是引起牛肝脓肿、腐蹄病和坏死性喉炎的主要病原菌,近年来大量研究显示在奶牛乳腺炎和子宫内膜炎等疾病发生过程中牛坏死杆菌也发挥重要作用。牛坏死杆菌入侵后,主要通过释放白细胞毒素、溶血素、LPS等对机体造成损伤。当前针对白细胞毒素、溶血素等的靶标蛋白制备的疫苗,虽能在一定程度上抑制牛坏死杆菌的感染,但免疫保护效果与临床应用仍存在很大的差距。因此,仅针对牛坏死杆菌常规毒力因子研究其致病机制和防治方案远远不够,有必要对牛坏死杆菌其他功能蛋白进行拓展性研究。
病原菌黏附宿主细胞或组织是病原菌侵袭及致病的先决条件,病原菌利用表面的黏附分子与宿主细胞表面受体相互作用完成其对宿主细胞的黏附。当前有关于牛坏死杆菌黏附的相关研究尚属空白,因此,从黏附宿主细胞角度探索牛坏死杆菌感染机制是牛坏死杆菌病抗感染研究的新方向。由于牛坏死杆菌不具有菌毛、鞭毛和荚膜等细菌黏附相关结构,经胰酶处理后,坏死杆菌黏附细胞数量显著降低。且与牛坏死杆菌同菌属的具核梭杆菌中,一些外膜蛋白(FomA、FadA和Fap2等)在具核梭杆菌黏附及入侵中发挥重要作用。因此,作者推测外膜蛋白(outer membrane proteins,OMPs)在牛坏死杆菌黏附中发挥潜在作用。2013年,Sun等首次在牛坏死杆菌H05菌株上鉴定了43K OMP,并发现其与梭杆菌属中具核梭杆菌、变异梭杆菌和溃疡梭杆菌等的OMPs相似,进一步研究发现其广泛存在于牛羊腐蹄病的坏死杆菌临床分离株中。前期笔者所在课题组初步验证了牛坏死杆菌43K OMP对BHK-21细胞、牛乳腺上皮细胞和牛子宫内膜细胞具有黏附作用,但针对43K OMP在牛坏死杆菌黏附细胞中的作用未进行深入探讨及定量分析。因此,明确43K OMP在牛坏死杆菌黏附中的作用,将为牛坏死杆菌感染机制的理解和抗菌策略提供新的理论支持。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞及载体 坏死杆菌A25菌株购自美国ATCC公司(,亚种,ATCC 25286),基因缺失菌A25Δ43K OMP为前期研究中通过同源重组技术制备获得,保存于黑龙江八一农垦大学兽医分子病理学实验室,鼠乳腺上皮细胞(EpH4-Ev)由吉林大学农学部惠赠,小鼠肝细胞(AML12)购于中国科学院干细胞库(编号:SCSP-550),牛坏死杆菌43K OMP多克隆抗体血清、牛坏死杆菌高免血清、牛坏死杆菌43K OMP多抗血清、牛坏死杆菌43K OMP单克隆抗体、兔阴性血清及鼠阴性血清均保存于黑龙江八一农垦大学兽医分子病理学实验室。
1.1.2 主要试剂与仪器 细菌基因组DNA提取试剂盒购于天根生物技术有限公司,DMEM培养基、DMEM/F12培养基、HEPE、LiCl、LDS、SLS、ITS、地塞米松均购于美国Sigma公司,胰酶等购于Gibco公司,FBS购于Clark公司,Alexa Fluor 488标记山羊抗兔IgG、Triton X-100、抗荧光淬灭封片液购于碧云天生物技术有限公司,ExDNA聚合酶等购于宝生物生物工程有限公司,二甲基亚砜、麦氏比浊管购于索莱宝生物科技有限公司,甲砜霉素购于阿拉丁试剂公司;所有引物合成由上海生工生物工程股份有限公司完成。全自动厌氧培养箱购于上海跃进医疗器械有限公司,TCS SP2型激光共聚焦显微镜购于德国Leica公司。
1.2 方法
1.2.1 细菌的培养及鉴定 将牛坏死杆菌A25菌株和基因缺失菌A25Δ43K OMP甘油冻存菌复苏接种于预还原的苛养肉汤培养基中,在厌氧培养箱内进行细菌培养,温度为37 ℃,气体条件:85 mL·LN、5 mL·LCO和10 mL·LH,革兰染色和PCR鉴定后,按照1∶100传代,传3~4代后用于细菌黏附试验,同时基因缺失菌A25Δ43K OMP培养基中添加2 μg·mL的甲砜霉素。基因缺失菌A25Δ43K OMP为本实验室前期通过同源重组方法获得,以A25菌株DNA为模板扩增同源重组片段,将其与甲砜霉素抗性基因连接并克隆入自杀质粒pCVD442获得打靶质粒。通过电转化,将打靶质粒转入β2155,获得供体菌。将供体菌与受体菌A25菌株接合试验后通过抗性筛选、PCR技术和基因测序技术对菌落克隆进行筛选和鉴定。本研究中利用引物Porin-outF5/Porin-outR5和Porin-outF3/Porin-outR3(表1),对基因缺失株5′端和3′端插入片段进行PCR鉴定,采用50 μL PCR扩增体系:DNA模板0.5 μL,上、下游引物各0.5 μL,灭菌纯水20.5 μL,DNA聚合酶25 μL, DMSO 3 μL。 PCR扩增条件:95 ℃预变性5 min; 95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1.5 min,35个循环;72 ℃再延伸7 min。PCR产物经1%的琼脂糖凝胶电泳后鉴定。
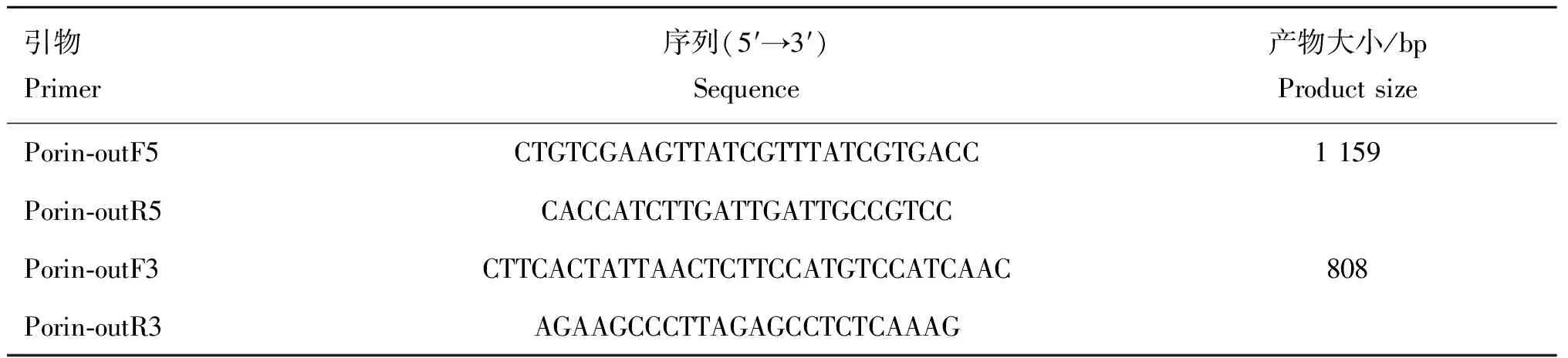
表1 引物序列设计
1.2.2 重组蛋白和天然蛋白的制备 参照文献[17,19]等的方法进行牛坏死杆菌天然43K OMP的提取,参照贺显晶等的方法构建牛坏死杆菌43K OMP原核表达载体,进行牛坏死杆菌43K OMP的表达,其中蛋白的纯化和复性委托北京海盖德科技有限公司完成。
1.2.3 43K OMP对鼠乳腺上皮细胞的黏附试验 将鼠乳腺上皮细胞接种于共聚焦培养皿中,调整细胞浓度培养24 h后,PBS漂洗细胞3次,4%多聚甲醛固定细胞1 h,PBST漂洗3次,除去多余的固定液。3 mL·LBSA室温封闭2 h,PBST充分漂洗3次。试验组加入重组蛋白和天然蛋白,每孔加入浓度为25 μg·mL,对照组加入BSA,室温孵育1 h。孵育结束后,PBST充分漂洗3次,去除未黏附的蛋白和培养基,加入43K OMP单克隆抗体(稀释度为1∶400)4 ℃孵育过夜,预冷的PBST充分漂洗3次, 去除游离抗体;加入Alexa Fluor 488标记的二抗(1∶500 稀释),37 ℃孵育1 h,PBST充分漂洗3次, 抗荧光淬灭剂封片,4 ℃冰箱内避光保存,激光共聚焦显微镜下观察结果。
1.2.4 天然蛋白竞争试验 将鼠乳腺上皮细胞或鼠肝细胞消化接种于6孔板中(1×10·mL),细胞生长到覆盖率85%~90%后每孔加入天然43K OMP(100 μg·mL),对照组不加入43K OMP,37 ℃孵育1 h,PBS缓冲液清洗3次,以去除未黏附的OMPs。将对数生长期的牛坏死杆菌用完全培养基制备浓度为10CFU·mL的菌悬液,分别与两组细胞37 ℃共孵育1 h。PBS缓冲液清洗3~5次, 以去除未黏附的细菌。收集细胞悬液后接种于FAB固体平板中,厌氧箱内培养24~48 h后计数。
1.2.5 抗体抑制试验 将鼠乳腺上皮细胞或鼠肝细胞消化接种于6孔板中,37 ℃培养24 h,PBS缓冲液清洗3次。将处于对数生长期的牛坏死杆菌菌液离心收集菌体,PBS溶液重悬离心3次,加入完全培养基调节细菌浓度为10CFU·mL备用。按照1∶200和1∶50的浓度将43K OMP多抗和单抗与上述菌液厌氧37 ℃孵育1 h。同时设置阴性血清组和正常细菌组作为对照组,将菌悬液与细胞共孵育1 h后弃培养液,PBS漂洗3~5次,以除去未黏附的细菌。用细胞刮刀将细胞刮下后用提前厌氧的BHI培养基重悬,按照倍比稀释后将细胞悬液涂布于FAB固体平板上,在厌氧培养箱中培养24~48 h 后,对菌落进行计数。
1.2.6 43K OMP基因缺失对坏死杆菌黏附力的影响 细胞消化接种于6孔板中,待细胞生长成良好的单层细胞且达到一定密度后,将培养好的牛坏死杆菌A25菌株和基因缺失株A25Δ43K OMP按照相同比例接种于BHI液体培养基内,37 ℃厌氧培养18~28 h,将处于对数生长期的菌液用提前厌氧处理的PBS溶液洗涤3~4次,完全培养基重悬后用麦氏比浊管调整细菌浓度为10CFU·mL备用。分别取2 mL加入到细胞培养板内,37 ℃厌氧培养1 h,弃去培养液,PBS漂洗3次,洗去未黏附的细菌。用细胞刮刀将细胞刮下后用厌氧的BHI培养基重悬倍比稀释后涂布于FAB固体平板上,基因缺失菌在FAB固体平板中添加2 μg·mL的甲砜霉素,厌氧培养24~48 h进行菌落计数。
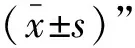
2 结 果
2.1 牛坏死杆菌43K OMP对鼠乳腺上皮细胞的黏附
将鼠乳腺上皮细胞与天然蛋白和重组蛋白共孵育后,经免疫荧光显色后发现天然蛋白组和重组蛋白组的细胞膜处激发绿色荧光,而对照组无荧光出现(图1),表明天然和重组的43K OMP均能黏附于上皮细胞细胞膜表面。

图1 牛坏死杆菌43K OMP与鼠乳腺上皮细胞的黏附(标尺=50.1 μm)Fig.1 The adherence of the 43K OMP of F. necrophorum to mouse mammary epithelial cells(bar=50.1 μm)
2.2 天然蛋白对牛坏死杆菌黏附的影响
当细胞与天然43K OMP预孵育1 h后,外膜蛋白组和对照组黏附鼠乳腺上皮细胞的牛坏死杆菌数量分别为2.3×10和2.79×10CFU·mL; 而外膜蛋白组和对照组黏附鼠肝细胞的牛坏死杆菌数量分别为1.75×10和2.48×10CFU·mL。由此,笔者发现当细胞与天然43K OMP预孵育1 h后,与空白对照组相比,黏附于鼠乳腺上皮细胞和鼠肝细胞的牛坏死杆菌菌量显著降低(<0.05)(见图2)。结果表明:天然43K OMP蛋白能竞争牛坏死杆菌对鼠乳腺上皮细胞和鼠肝细胞的黏附。
2.3 抗体对牛坏死杆菌黏附的影响
当牛坏死杆菌与43K OMP多抗共孵育后,鼠乳腺上皮细胞抗体组、阴性血清对照组和细菌对照组细胞上黏附的牛坏死杆菌数量分别为1.50×10、2.29×10和2.35×10CFU·mL(图3A);鼠肝细胞抗体组、阴性血清对照组和细菌对照组细胞上黏附的牛坏死杆菌数量分别为1.47×10、2.79×10和2.82×10CFU·mL(图3B)。而当牛坏死杆菌与43K OMP单抗共孵育后,鼠乳腺上皮细胞抗体组、阴性血清对照组和细菌对照组细胞上黏附的牛坏死杆菌数量分别为1.63×10、2.50×10和2.55×10CFU·mL(图3C);鼠肝细胞抗体组、阴性血清对照组和细菌对照组细胞上黏附的牛坏死杆菌数量分别为1.97×10、2.53×10和2.67×10CFU·mL(图3D)。因此,牛坏死杆菌与43K OMP多抗或单抗共孵育后能显著降低黏附于鼠乳腺上皮细胞和鼠肝细胞上的牛坏死杆菌数量(<0.000 1)。以上结果显示,43K OMP抗体能显著降低黏附于细胞上的牛坏死杆菌数量。

A. 天然43K OMP对牛坏死杆菌黏附鼠乳腺上皮细胞的影响;B. 天然43K OMP对牛坏死杆菌黏附鼠肝细胞的影响。**.P<0.01; ***.P<0.001A. The effect of F. necrophorum binding to MMECs by preincubated with native 43K OMP protein; B. The effect of F. necrophorum binding to AML12 cells by preincubated with native 43K OMP protein. **.P<0.01; ***.P<0.001图2 天然43K OMP对牛坏死杆菌黏附细胞的影响Fig.2 The effect of F. necrophorum binding to cells by preincubated with the native 43K OMP protein
2.4 43K OMP基因缺失对牛坏死杆菌黏附力的影响
利用引物Porin-outF5/ Porin-outR5和Porin-outF3/ Porin-outR3分别对菌株进行PCR扩增,电泳结果如图4。结果显示,基因缺失株A25Δ43K OMP分别扩增出大小为1 159和808 bp的条带,而牛坏死杆菌A25菌株未扩增出特异性条带,此结果与预期相符,表明所选的菌株为43K OMP基因缺失菌和亲本菌A25菌株。
为更好地衡量43K OMP基因的缺失对牛坏死杆菌黏附宿主细胞能力的影响,本试验选用鼠乳腺上皮细胞和鼠肝细胞作为细胞模型。结果显示:缺失株A25Δ43K OMP和A25菌黏附于鼠乳腺上皮细胞和鼠肝细胞的菌落数分别为5.69×10和0.32×10CFU·mL,3.23×10和0.31×10CFU·mL,细菌黏附分别降低了94.4%和90.4%(图5)。同亲本株相比,A25Δ43K OMP黏附宿主细胞能力极显著下降(<0.000 1),由此可知43K OMP基因的缺失导致坏死杆菌黏附细胞的能力大大降低。
3 讨 论
近年来,牛坏死杆菌病给我国养牛业发展造成了严重的经济损失,由牛坏死杆菌感染引起的牛肝脓肿、腐蹄病、坏死性喉炎、乳腺炎和子宫内膜炎等疾病,严重制约了我国规模化奶牛养殖业的发展。在肝脓肿、腐蹄病、乳腺炎等疾病中,牛坏死杆菌对瘤胃血管内皮细胞、蹄部损伤的皮肤组织细胞、乳腺上皮细胞和子宫内膜细胞的黏附是引起感染的重要步骤,而有关牛坏死杆菌黏附机制的研究尚未阐明。前期研究发现,牛坏死杆菌43K OMP能黏附牛乳腺上皮细胞、子宫内膜细胞和BHK-21细胞,且与牛坏死杆菌同菌属的具核梭杆菌外膜蛋白FomA和FadA,在生物膜形成、细菌黏附及介导免疫中发挥重要作用。但43K OMP在牛坏死杆菌黏附中究竟扮演什么角色,发挥怎样的作用目前尚未可知。因此,明确43K OMP在牛坏死杆菌黏附宿主细胞中的作用,为研究牛坏死杆菌黏附相关蛋白和阐明牛坏死杆菌的致病机制具有重要意义。
本研究以鼠乳腺上皮细胞和鼠肝细胞为细胞模型,免疫荧光试验结果显示,天然蛋白和重组蛋白能黏附于鼠乳腺上皮细胞表面,且细胞与天然蛋白预孵育或牛坏死杆菌与抗体预孵育后,细胞上黏附的牛坏死杆菌的数量降低。其中,天然蛋白竞争结合鼠肝细胞抗体组、阴性血清对照组和细菌对照组细胞上黏附的牛坏死杆菌数量分别为1.47×10、2.79×10和2.82×10CFU·mL(图3B)。而当牛坏死杆菌与43K OMP单抗共孵育后,鼠乳腺上皮细胞抗体组、阴性血清对照组和细菌对照组细胞上黏附的牛坏死杆菌数量分别为1.63×10、2.50×10和2.55×10CFU·mL(图3C);鼠肝细胞抗体组、阴性血清对照组和细菌对照组细胞上黏附的牛坏死杆菌数量分别为1.97×10、2.53×10和2.67×10CFU·mL(图3D)。因此,牛坏死杆菌与43K OMP多抗或单抗共孵育后能显著降低黏附于鼠乳腺上皮细胞和鼠肝细胞上的牛坏死杆菌数量(<0.000 1)。以上结果显示,43K OMP抗体能显著降低黏附于细胞上的牛坏死杆菌数量。
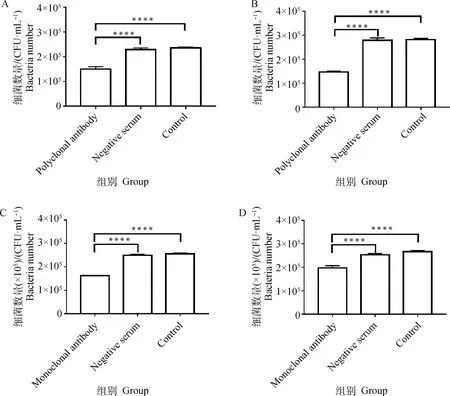
A. 多抗对牛坏死杆菌黏附鼠乳腺上皮细胞的影响;B. 多抗对牛坏死杆菌黏附鼠肝细胞的影响;C. 单抗对牛坏死杆菌黏附鼠乳腺上皮细胞的影响;D. 单抗对牛坏死杆菌黏附鼠肝细胞的影响; ****. P<0.000 1A. The effect of F. necrophorum binding to MMECs by treatment with polyclonal antibody against the recombinant 43K OMP; B.The effect of F. necrophorum binding to AML12 cells by treatment with polyclonal antibody against the recombinant 43K OMP; C. The effect of F. necrophorum binding to MMECs by treatment with monoclonal antibody against the recombinant 43K OMP; D. The effect of F. necrophorum binding to AML12 cells by treatment with monoclonal antibody against the recombinant 43K OMP. ****. P<0.000 1图3 抗体对牛坏死杆菌黏附细胞的影响Fig.3 The effect of F.necrophorum binding to hosts cells by treatment with antibody
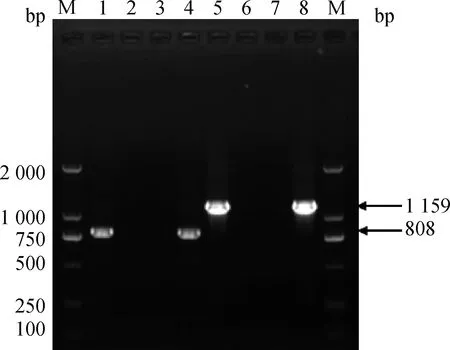
M. DNA相对分子质量标准2000;1、4、5、8. 43K OMP基因缺失株A25Δ43K OMP;2、6. 阴性对照;3、7. 牛坏死杆菌A25菌株M. DNA marker 2000;1, 4, 5, 8. A25Δ43K OMP strain;2, 6. Control;3,7. F. necrophorum A25 strains图4 43K OMP基因缺失株的PCR鉴定结果Fig.4 The PCR amplification results of the 43K OMP gene deletion strains
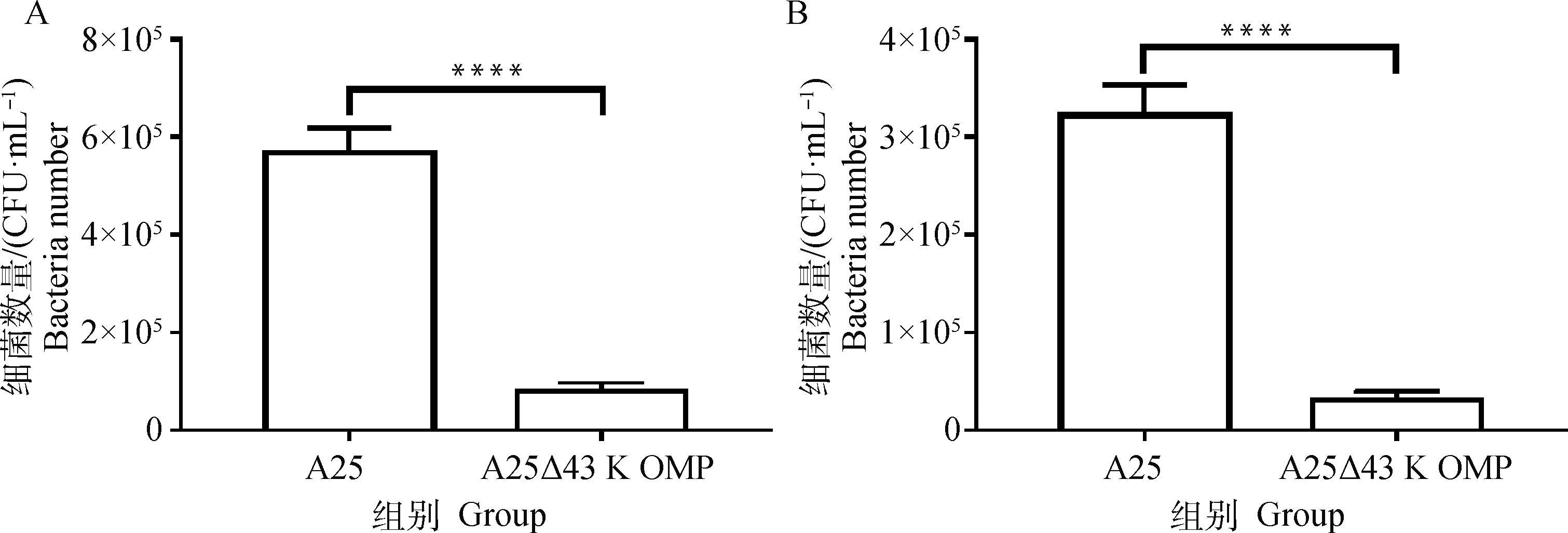
A. 牛坏死杆菌A25和基因缺失株A25Δ43K OMP黏附MMECs结果;B. 牛坏死杆菌A25和基因缺失株A25Δ43K OMP黏附AML12细胞结果。****. P<0.000 1A. The attachment of F. necrophorum A25 and A25Δ43K OMP strain to MMECs; B. The attachment of F. necrophorum A25 and A25Δ43K OMP strain to AML12 cells. ****. P<0.000 1图5 牛坏死杆菌A25和基因缺失株A25Δ43K OMP黏附结果Fig.5 The attachment of F. necrophorum A25 and A25Δ43K OMP strain to host cells
细菌黏附宿主细胞是入侵机体和感染致病的先决条件,其中特异性黏附借助特异性识别分子(细菌黏附素、配体)与靶细胞相应的受体结合,在细菌黏附宿主细胞中发挥重要作用。回顾牛坏死杆菌黏附机制相关研究,早期认为牛坏死杆菌与瘤胃上皮细胞的黏附与血凝素有关。随着OMPs在革兰阴性细菌黏附中的作用逐渐被揭示,研究显示介导坏死杆菌黏附的黏附素可能是OMPs,且分子量为17、24、40和74 ku的OMPs可能与坏死杆菌黏附有关。而与牛坏死杆菌同杆菌属的具核梭杆菌其主要外膜蛋白FomA作为一种重要的黏附蛋白,在细菌黏附、生物膜形成及直肠癌的发生中发挥重要作用。43K OMP是Sun等首次在牛坏死杆菌鉴定的OMPs,且与FomA相似性达到70.22%,其黏附功能可能与之相似,这也解释了43K OMP在介导牛坏死杆菌黏附中的重要作用。但针对于牛坏死杆菌43K OMP的其他功能性研究及牛坏死杆菌黏附机制的研究尚未明确,这些问题的阐明将为牛坏死杆菌病的综合防治提供新思路。
4 结 论
以鼠乳腺上皮细胞和鼠肝细胞为细胞模型,证明43K OMP在牛坏死杆菌黏附细胞中发挥重要作用。亲本株A25株43K OMP基因缺失后对鼠乳腺上皮细胞和肝细胞的黏附率分别下降了94.4%和90.4%,但并未完全丧失其对细胞的黏附力,可见43K OMP在牛坏死杆菌黏附细胞中发挥关键作用,但43K OMP如何发挥黏附作用的相关机制,有待于进一步探究。
