检测产单核细胞李氏杆菌溶血素的胶体金试纸条制备及初步应用
2022-07-07江玲丽高有领胡兴娟杨云凯方维焕
江玲丽,高有领,胡兴娟,章 先,杨云凯,魏 华,方维焕
(1. 宁波卫生职业技术学院,宁波 315100;2. 浙江万里学院,宁波 315100;3. 舟山海关 综合技术服务中心,舟山 316021;4.浙江大学动物预防医学研究所,杭州 310058)
产单核细胞李氏杆菌为目前已知的17种李氏杆菌中唯一一种对人类有致病性的人畜共患病致病原,感染后可引发败血症、脑膜炎、热性肠胃炎和孕妇的流产,虽然发生率较低,但死亡率较高。产单核细胞李氏杆菌在污水、土壤、动物粪便等介质中广泛存在,通过被污染的蔬菜、水果、乳制品、海鲜以及肉类等食物而传播给人类,在健康人群的携带率为1%~5%。美国每年爆发李氏杆菌感染约1 600例, 死亡260例,在免疫抑制人群中可达30%。欧洲近4年产单核细胞李氏杆菌的感染数量持续增长。2011到2016年,中国的19省爆发李氏杆菌感染253例,死亡人数占比25.7%。产单核细胞李氏杆菌已被WHO食品安全工作计划列为重点检测的食源性病原菌之一,也被我国食品安全风险监测网列为常规监测的致病菌之一。
产单核细胞李氏杆菌侵入宿主细胞后,通过李氏杆菌溶血素(Listeriolysin O,LLO)、磷脂酶 A (PI-PLC) 和 B(PC-PLC)以及 Mpl 协同作用逃离吞噬体并逸入细胞质中。LLO由基因编码,为产单核细胞李氏杆菌主要毒力因子之一,包含膜攻击复合物MACP/CDC区域,通过插入它的蛋白疏水区到宿主细胞膜的磷脂双层,进而破坏宿主细胞吞噬体膜,为细菌逸入细胞质中增殖所必需。研究表明,LLO的缺失突变体无法进入宿主细胞质中,对宿主毒力很弱。表达LLO的胞外感染菌枯草杆菌能逃离吞噬小体并能在巨噬细胞的细胞质中增殖。
目前,我国还没有关于李氏杆菌病的推荐诊断与处理方法,基本沿用传统的细菌培养、生化鉴定以及常规免疫学等技术,但分离培养操作繁琐,需数天才能得到结果,且对仪器设备具有较高的依赖性,不能满足实际检验工作特别是基层市场监管的需求。因而建立产单核细胞李氏杆菌快速、灵敏、高效、简便的检测方法对保障人畜公共卫生安全具有重要的现实意义。
本研究制备产单核细胞李氏杆菌LLO的单克隆抗体,研制LLO胶体金试纸条,经特异性、敏感性、重复性、稳定性及人工模拟样品测试,初步应用于实际海产品样品检测,以期为产单核细胞李氏杆菌的监测提供重要技术手段。
1 材料与方法
1.1 材料
1.1.1 主要器材 酶标仪(SpectraMax M5)购自美国Molecular Device公司;96孔ELISA酶标板、细胞培养板和细胞培养皿购自美国Corning公司。
1.1.2 菌株、质粒、培养基、试剂、引物 原核表达质粒pET30a、Rosetta(DE3)感受态细胞系本实验室保存。产单核细胞李氏杆菌标准菌株EGDe由丹麦哥本哈根大学Jakobsen教授惠赠,标准菌株10403S、消毒奶分离株M7系本实验室保存;特异性试验中涉及的金黄色葡萄球菌Sa A8、Sa ATCC25923和猪链球菌2型SS2 HA9801、SS2 05ZYH33由实验室保存。李氏杆菌脑心浸液培养基(BHI)购自北京陆桥技术有限责任公司。KOD Plus Neo polymerase和DNA连接酶Ligation High Ver 2.0购自东洋坊(上海)生物科技有限公司。限制性内切酶I、I,连接酶,DNA Marker等购自TaKaRa宝生物(大连)公司。PCR产物纯化试剂盒、UNIQ-10胶回收试剂盒购于AXYGEN公司。核酸电泳染料Goldview购自上海赛百盛基因技术有限公司。卡那霉素、Taq DNA聚合酶、IPTG和咪唑购自北京鼎国生物技术有限责任公司。ProtienA/G抗体纯化柱购自上海悦克生物科技有限公司。辣根过氧化物酶(HRP)标记的羊抗鼠和羊抗兔IgG均购自天津三箭生物技术有限公司,TMB显色液购自北京泰天河生物技术有限公司。细胞培养基DMEM、RPMI 1640(不含酚红)购自美国Gibco公司。引物由上海捷瑞生物工程有限公司合成。
1.1.3 实验动物 6周龄 BALB/c 雌性小鼠购自浙江中医药大学实验动物中心。骨髓瘤细胞SP2/0等为本实验室保存。
1.2 LLO的表达及纯化
1.2.1基因的扩增与克隆 根据EGDe基因序列(GenBank: M18970.1),通过VectorNTI软件设计引物对hly-a/hly-b(hly-a-I:5′-ACT-AAGGATGCATCTGCATTCAAT-3′;hly-b-I:5′-TTATTCGATTGGATT ATCTACTTTAT-3′)(扩增片段长度为1 533 bp),并引入I和I的酶切位点(下划线斜体部分)。用高保真聚合酶KOD Plus Neo polymerase扩增标准菌株EGDe的基因片段,经割胶回收纯化后,通过限制性内切酶I/I,将片段连接至原核表达质粒pET30a中,转化入感受态细胞Rosetta中。重组质粒pET-30a-hly的鉴定采用靶基因的PCR扩增及I/I双酶切鉴定,同时送往北京华大基因科技有限公司测序,以确保无移码突变。
1.2.2 可溶性LLO的低温诱导表达及纯化 将测序正确的阳性菌液接入含有卡那霉素(50 μg·mL) 的LB液体培养基中,37 ℃振荡培养至OD为0.6时,加入IPTG(终浓度1 mmol·L)16 ℃诱导表达5 h,设置梯度摸索最佳诱导时间。将最佳诱导条件下表达的菌液经超声波裂解,分离上清与沉淀后进行SDS-PAGE分析。目的蛋白经镍螯合层析柱纯化后,SDS-PAGE电泳分析其纯度,通过BCA法测定其浓度后加甘油分装,-20 ℃备用。
1.3 抗LLO单克隆抗体的制备及纯化
根据文献报道的免疫程序制备LLO单克隆抗体,Protien A/G抗体纯化柱纯化,SDS-PAGE对纯化效果进行分析。同时取细胞培养上清液,利用单克隆抗体亚型鉴定试剂盒鉴定LLO单克隆抗体的免疫球蛋白类型及亚型。
1.4 单克隆抗体的鉴定
1.4.1 单克隆抗体效价及亲和力常数的测定 采用间接ELISA方法测定腹水抗体效价。同时参考文献[14-15]所述方法进行LLO单克隆抗体亲和力常数测定,用2.5和1.25 μg·mL的LLO进行包被,倍比稀释已知浓度的单克隆抗体进行间接ELISA测定,酶标仪读波长为450 nm处的OD值,将平台期(抗体过量、抗原饱和,该区间内OD值波动极小)的OD值记为100%,并根据公式计算单克隆抗体亲和力常数:
Ka=(n-1)/2(n*Ab-Ab),n=Ag/Ag
式中:Ag、Ag为两个不同的抗原包被质量浓度(μg·mL);Ab、Ab为相应抗原包被浓度下OD值为平台期一半时对应的抗体摩尔浓度(μmol·mL)。
1.4.2 单克隆抗体特异性的测定 应用Western blot对高亲和力单克隆抗体进行特异性鉴定,将LLO单克隆抗体分别与纯化LLO蛋白、产LLO的产单核细胞李氏杆菌细菌培养上清液以及其它非产单核细胞李氏杆菌菌株培养液(金黄色葡萄球菌Sa A8、Sa ATCC25923、猪链球菌2型SS2 HA9801、SS2 05ZYH33)进行SDS-PAGE,转膜后添加腹水抗体(1∶2 500稀释)以鉴定单克隆抗体与LLO的反应特异性。
1.5 胶体金试纸的研制
1.5.1 胶体金探针的制备 采用柠檬酸钠还原法制备胶体金,以LLO单克隆抗体标记胶体金,采用差速离心法纯化胶体金探针。
1.5.2 试纸的准备 分别以单克隆抗体1D2D8和4D12C3及羊抗鼠IgG抗体作为试纸的检测线和质控线,包被硝酸纤维素(NC),组装胶体金试纸条。
1.5.3 特异性试验 利用实验室保存的产单核细胞李氏杆菌菌株(EGDe、10403S和M7)、金黄色葡萄球菌菌株(A8和ATCC25923)、猪链球菌2型菌株(HA9801和05ZYH33)等革兰阳性菌进行胶体金试纸条的特异性试验,同时设PBS和BHI阴性对照组。
1.5.4 敏感性试验 调整产单核细胞李氏杆菌M7过夜细菌培养液浓度为2.0×10CFU·mL,采用无菌PBS 进行10 倍梯度稀释,分别为2.0×10、2.0×10、2.0×10、2.0×10、2.0×10及2.0×10CFU·mL,分别经12 000 r·min离心10 min后,取上清液,进行LLO胶体金的敏感性试验。
1.5.5 重复性试验 取产单核细胞李氏杆菌分离株M7纯过夜培养物,调整细菌浓度为3.0×10CFU·mL, 每隔一周检测1次,共检测8次,进行LLO胶体金试剂条的重复性试验,同时设立BHI阴性对照组。
1.5.6 稳定性试验 将试纸条用塑料袋及铝箔密封,加干燥剂于4 ℃保存,每隔1周检测1次,检测其稳定性,共检测10次,同时设立BHI阴性对照组。
1.5.7 人工模拟样品试验 取市售冷冻虾仁、青占鱼各1 g,加入8 mL 灭菌PBS,再加入1 mL 浓度分别为3.0×10、3.0×10、3.0×10、3.0×10、3.0×10和3.0×10CFU·mL的产单核细胞李氏杆菌M7灭活菌悬液,充分振荡混匀后检测。
1.5.8 实际海产品中LLO胶体金试剂条的初步应用 2016年12月至2019年9月采集杭州、宁波、舟山菜市场海产品样本(黄鱼、贻贝、带鱼、虾仁),共计500份样品。样品按照规定冷冻或冷藏保存,8 h内送实验室检验,并按照GB4789.30—2010方法进行检测,同时采用本实验室建立的PCR方法和本研究建立的胶体金检测方法进行检测,以比较3种方法之间的符合率。
2 结 果
2.1 重组质粒pET30a-hly的鉴定
将可疑重组质粒pET30a-hly进行片段的PCR扩增,能得到1 533 bp的条带(图1),对其进行I/I双酶切后,能得到约1 533和5 400 bp的片段,与预期条带大小相符。测序结果经DNAstarMegalign分析,与GenBank:M18970.1核苷酸的同源性为100%,无任何突变,可进行后续的诱导表达。

M. DL2000 DNA相对分子质量标准;1.重组质粒的PCR扩增;2.亲本菌株的PCR扩增M. DL2000 DNA marker; 1. PCR amplification from the recombinant plasmid pET30a-hly; 2. PCR amplification from the parent strain图1 重组质粒pET30a-hly的PCR鉴定Fig.1 PCR identification of the recombinant plasmid pET30a-hly
2.2 融合蛋白LLO的表达及Western blot分析
阳性转化子经IPTG(终浓度1 mmol·L)16 ℃ 低温表达12 h为最佳诱导条件,收集菌体超声波破碎后经SDS-PAGE发现,LLO重组蛋白系可溶性表达,主要位于上清中。LLO重组蛋白大小在57 ku左右,与预期相符。收集重组质粒Rosetta-pET30a-hly经IPTG 16 ℃诱导12 h后的菌体裂解上清,通过镍柱纯化获得高纯度的重组LLO蛋白(图2)。经BCA法测定,原核蛋白LLO的浓度为2.0 mg·mL。
2.3 单克隆抗体亚型鉴定与效价测定
经细胞融合与克隆筛选,共获得5株LLO单克隆抗体杂交瘤细胞,分别为1D2D8、4G12C3、6D11F10、8C8B9和9F1C5,均为κ轻链。其中6D11F10为IgG1亚型,而1D2D8、4G12C3、8C8B9和9F1C5为IgG2b亚型(表1)。
间接ELISA方法测定腹水抗体效价,1D2D8和4G12C3效价最高,均高于200 000,8C8B9和6D11F10两株抗体效价接近,大于30 000,而细胞株9F1C5抗体效价最低(<3 000),弃去(表1)。亲和力常数1D2D8>4G12C3>6D11F10>8C8B9>9F1C5,分别为3.28×10、1.25×10、5.97×10、6.38×10、2.57×10L·mol,综合上述效价及亲和力结果,选择细胞株1D2D8和4G12C3进行后续胶体金试验。
2.4 单克隆抗体特异性的测定
LLO单克隆抗体与纯化的LLO蛋白、产单核细胞李氏杆菌标准菌株EGDe、10403S及分离株M7上清液具有良好的反应性,而与金黄色葡萄球菌(Sa A8和Sa ATCC25923)及猪链球菌2型细菌(SS2 HA9801和SS2 05ZYH33)上清培养物均无交叉反应,表明LLO单抗特异性较好(图3)。
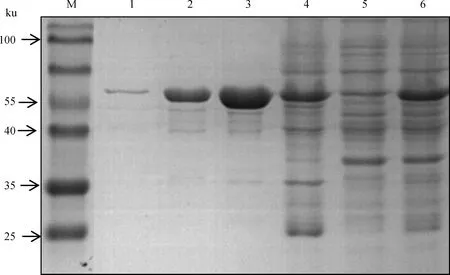
M. 蛋白Marker;1. 400 mmol·L-1咪唑洗脱;2. 200 mmol·L-1咪唑洗脱;3. 100 mmol·L-1咪唑洗脱;4. 50 mmol·L-1咪唑洗脱;5. 过柱后;6. 过柱前M.Protein molecular marker; 1. Elution with 400 mmol·L-1 imidazole; 2. Elution with 200 mmol·L-1 imidazole; 3.Elution with 100 mmol·L-1 imidazole; 4. Elution with 50 mmol·L-1 imidazole; 5.After purification; 6. Before purification图2 可溶性LLO蛋白的纯化Fig.2 Purification of soluble LLO protein
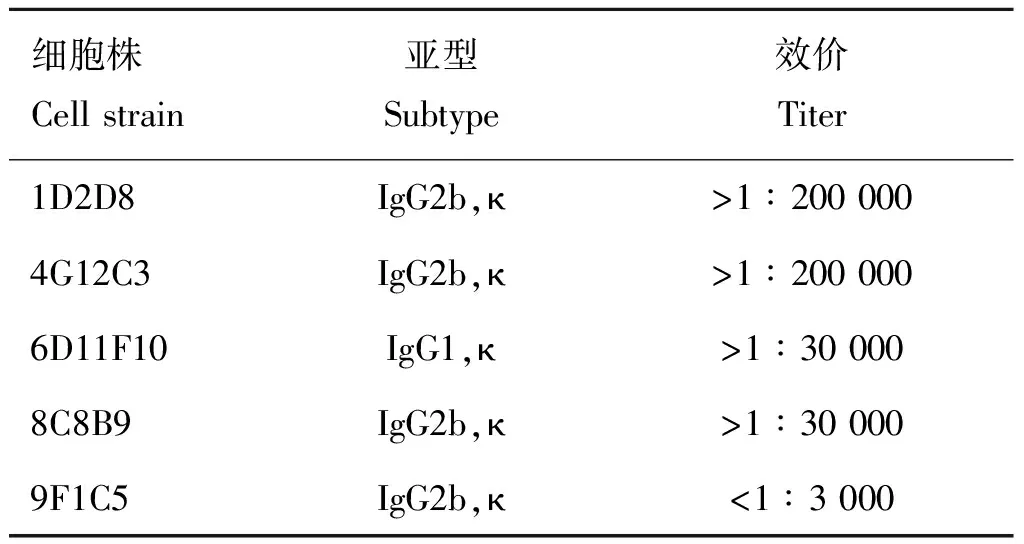
表1 LLO单克隆抗体的亚型及效价
2.5 胶体金试纸的研制
2.5.1 特异性试验 如图4所示,本试纸条特异性较高,仅与产单核细胞李氏杆菌分离株M7发生反应,不与金黄色葡萄球菌分离株A8、ATCC25923、猪链球菌2型SS2 HA9801、SS2 05ZYH33等其它革兰阳性菌株发生交叉反应,阴性对照PBS和BHI亦均只有一条质控线,表明该试剂条特异性较高。
2.5.2 敏感性试验 当细菌浓度为2.0×10、2.0×10、2.0×10、2.0×10CFU·mL时均能被LLO胶体金试剂条检出,其中2.0×10CFU·mL条带较弱。而当细菌浓度为2.0×10CFU·mL,只有质控线,表明本试验建立的LLO胶体金试纸敏感性为2.0×10CFU·mL。
2.5.2 重复性试验 结果显示,8次(第16周)均能特异性地检出产单核细胞李氏杆菌M7纯培养物,而阴性对照组只有质控条带,表明本试验建立的LLO试剂条具有较好的重复性。
2.5.3 稳定性试验 结果表明, 密封保存于4 ℃ 的LLO试纸条在保存20周后仍可特异地检出产单核细胞李氏杆菌分离株M7培养上清液, 而且敏感性没有显著降低,而BHI阴性对照组只有质控条带,表明LLO胶体金试纸条稳定性较好。
2.5.4 模拟样品试验 在人工污染样品中,当细菌浓度高于或等于3.0×10CFU·mL,可通过本研究研制的胶体金试纸条检出。因而在人工污染试验中,LLO检测的灵敏度为3.0×10CFU·mL,与纯细菌培养物检测结果基本一致。
2.5.5 实际海产品中的初步应用 利用实验室之前建立的PCR鉴定方法和国标方法GB4789.30—2010,对500份样品进行检测。结果表明,PCR方法及国标方法结果一致,500份海产品样品中12个为阳性,检出率为2.40%(12/500)。采用本项目建立的胶体金试剂条检出11个阳性样品,检出率为2.20%(11/500),敏感度略低于国标及PCR检测方法(表2)。
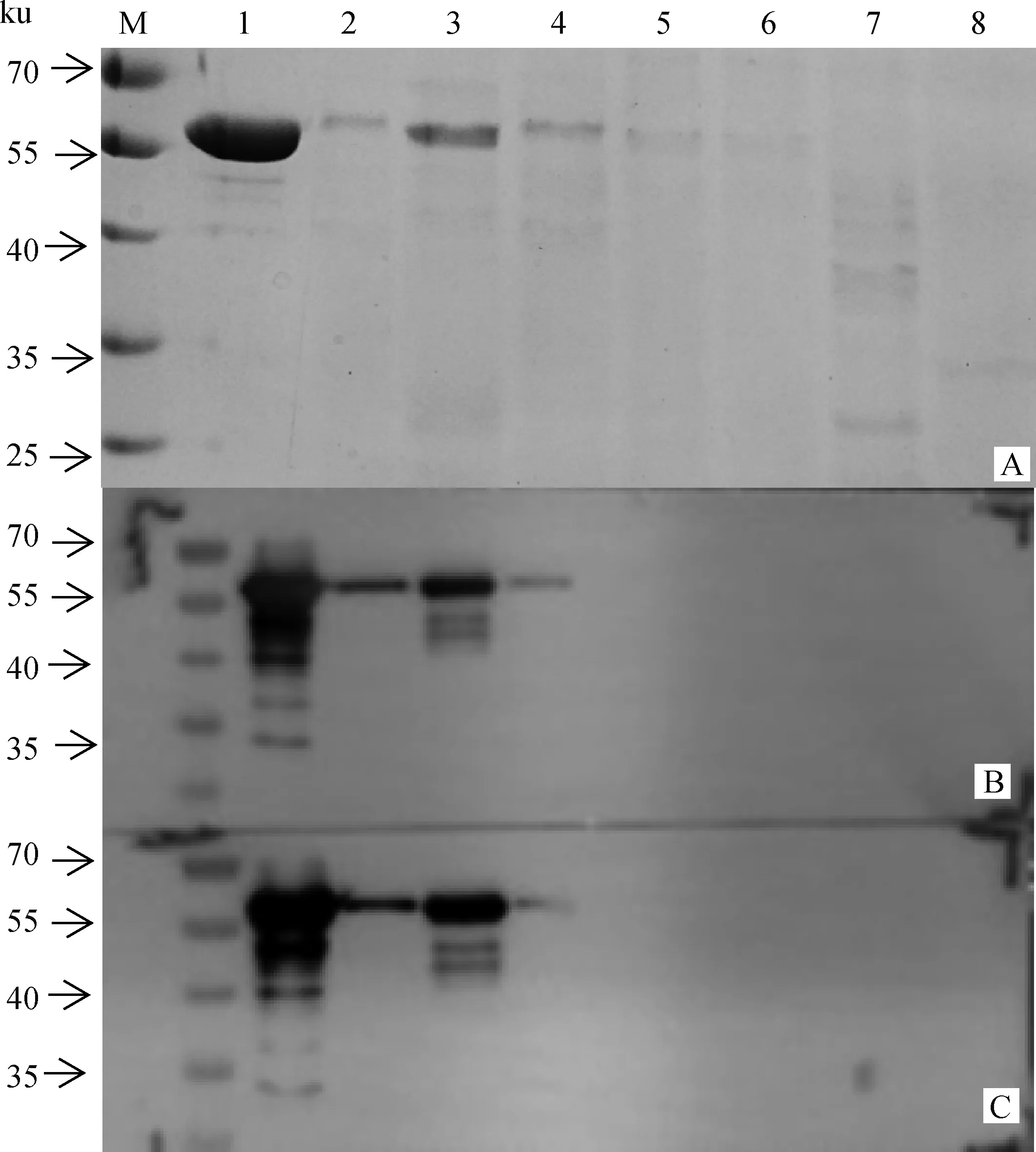
A. SDS-PAGE;B. Western blot mAb 1D2D8;C. Western blot mAb 4G12C3。M. 蛋白Marker;1.纯化的LLO蛋白;2.产单核细胞李氏杆菌 EGDe;3.产单核细胞李氏杆菌 M7;4.产单核细胞李氏杆菌10403S;5.金黄色葡萄球菌Sa A8;6. 金黄色葡萄球菌Sa ATCC25923;7.猪链球菌2型SS2 HA9801;8. 猪链球菌2型SS2 05ZYH33A. SDS-PAGE;B. Western blot mAb 1D2D8;C. Western blot mAb 4G12C3. M. Protein molecular marker; 1. Purified LLO protein; 2. L.monocytogenes strain EGDe; 3.L.monocytogenes strain M7; 4.L.monocytogenes strain 10403S; 5.Staphylococcus aureus strain Sa A8; 6.Staphylococcus aureus strain Sa ATCC25923; 7.Streptococcus suis serotype 2 strain SS2 HA9801;8.Streptococcus suis serotype 2 strain SS2 05ZYH33图3 LLO单克隆抗体的特异性鉴定Fig.3 Specific identification of LLO monoclonal antibody

1.产单核细胞李氏杆菌M7; 2. 金黄色葡萄球菌Sa A8;3. 金黄色葡萄球菌Sa ATCC25923; 4. 猪链球菌2型SS2 HA9801; 5. 猪链球菌2型SS2 05ZYH33;6. PBS阴性对照; 7. BHI阴性对照1.L.monocytogenes strain M7;2. Staphylococcus aureus strain Sa A8; 3.Staphylococcus aureus strain Sa ATCC25923;4.Streptococcus suis serotype 2 strain SS2 HA9801; 5.Streptococcus suis serotype 2 strain SS2 05ZYH33; 6.PBS negative control; 7. BHI negative control图4 LLO胶体金试纸条的特异性检测Fig.4 Specific detection of LLO colloidal gold-based test strip

表2 海产品中产单核细胞李氏杆菌不同检测方法检出率比较
3 讨 论
本研究原核表达了His-LLO 融合蛋白, 经纯化获得了纯度较高的LLO, 并制备了高亲和力和特异性的LLO单克隆抗体,研制的LLO胶体金试剂条具有特异性强、稳定性和重复性好、灵敏度较高的优点,人工污染样品试验表明灵敏度与纯细菌培养物基本一致,为3.0×10CFU·mL,略高于崔焕忠等建立的基于ActA蛋白的胶体金试纸条(3.9×10CFU·mL)。与熊国华研制的试纸敏感性1×10CFU·mL相比,更为灵敏。与栗克文等建立的化学发光免疫检测法相比时间更短,时间为15 min,大大提高了检测效率。将本研究建立的LLO胶体金试纸条应用于500份海产品的实际检测中,产单核细胞李氏杆菌的阳性检出率为2.20% (11/500),略低于国标检测方法(GB4789.30—2010)的阳性检出率2.40%(12/500)和本课题组前期建立的PCR检测方法阳性检出率2.40%(12/500),三者之间符合率为91.67%,因胶体金试纸条对仪器设备无依赖性,所以可应用于高通量实际样本检测。
自20世纪九十年代以来,产单核细胞李氏杆菌在即食食品中的污染有较多报道,目前世界各国已将产单核细胞李氏杆菌列为食品安全检测的法定项目,其检出率在不同地方及不同食品中均存在较大差异。国外研究表明,易被产单核细胞李氏杆菌污染的食品主要为乳制品(奶酪、巴氏消毒奶、冰淇淋)、肉制品(鸡肉、火腿等),海产品及蔬菜色拉等。国内研究表明,产单核细胞李氏杆菌在28省的发生率为4.42%,禽肉制品中发生率最高(8.91%),其次为海鲜(5.72%)、色拉(3.65%)、米粉类食品(2.97%)、蔬菜(2.84%)和奶制品(1.82%)。河北省即食食品中产单核细胞李氏杆菌总污染率为1.34%,其中凉拌菜及沙拉(2.62%)、生食水产品(2.51%)的检出率均高于所测其它食品如熟肉制品等。
4 结 论
本研究建立的LLO胶体金试纸条,特异性强、稳定性高、重复性好、反应速度快、灵敏度较高,检测流程简单,应用于500份海产品中的产单核细胞李氏杆菌的检测,检出率为2.20%,与其他学者报道基本一致,可应用于产单核细胞李氏杆菌引起的疾病暴发和食物中毒等多种应用场景的快速诊断,以提升政府监管力度,保障食品安全。
