氧化应激通过Fas/FasL信号通路调控奶牛子宫内膜细胞凋亡
2022-07-07张相伦刘桂芬刘晓牧张冬梅谭秀文
靳 青,张相伦,魏 晨,刘桂芬,刘晓牧,张冬梅,谭秀文*
(1.山东省农业科学院畜牧兽医研究所/山东省畜禽疫病防治与繁育重点实验室,济南 250100;2.邹城市畜牧业发展中心,济宁 273500)
胚胎早期死亡及流产给奶牛繁殖率和产奶量带来严重影响,造成极大的经济损失。关于奶牛的早期胚胎死亡很早就有报道,Ulberg等发现,输精后60~90 d约有40%胚胎死亡。Sreenan和Diskin对25年文献中奶牛胚胎死亡进行分期评估,发现受精卵估测为90%,平均产犊率为55%,表明胚胎死亡率为35%;从受精到妊娠第8天胚胎损失很少,胚胎死亡明显增加是发生在授精后的第8~16天之间(27%~31%)。进入21世纪后,尽管在奶牛养殖中采用更科学的方法和手段,但大量文献证实妊娠损失仍主要发生在输精后8~17 d,尤其在高密度集约化养殖场中,这种情况更加明显。这一时期正好处于早期胚胎向子宫内膜附植之前或附植过程中,即囊胚滋养层细胞与母体子宫内膜细胞之间逐步建立组织和生理上联系的过程。以往研究表明,子宫内膜的生理状态对妊娠的建立和维持至关重要。因此,有必要探讨奶牛养殖中影响子宫内膜生理状态的可能机制。
奶牛养殖中应激的发生几乎不可避免,各种应激状况都会造成大量氧自由基(reactive oxygen species, ROS)产生,导致氧化应激。研究发现,氧化应激与子宫内膜细胞凋亡密切相关。Hoelker等和Hailemariam等发现,患子宫内膜炎的奶牛其子宫内膜炎症反应的信号通路与凋亡基因网络、生物功能等方面交互在一起。Piras等利用脂多糖(LPS)处理奶牛子宫内膜细胞72 h后进行差异蛋白组学分析,发现LPS组28个蛋白表达上调,10个蛋白表达下调,这38个差异表达蛋白与细胞凋亡、氧化应激密切相关,其中部分差异表达蛋白参与胚胎附植过程中激活的通路。然而迄今为止,氧化应激如何调控奶牛子宫内膜细胞凋亡并未见报道,因此有必要进行深入研究。
近年来研究发现,死亡受体Fas在细胞凋亡信号通路中起关键性作用。Fas又称APO-1或CD95,是一种Ⅰ型跨膜糖蛋白,胞质区含有一段由80个氨基酸残基构成的、6个反向平行的α-螺旋形成的高度保守序列,称为死亡区(DD),该区域对于凋亡信号的传导具有重要作用。配体是FasL又称CD95L,属于Ⅱ型跨膜蛋白,可被金属蛋白酶裂解形成可溶性形式。Fas通过与三聚化的FasL结合而被激活,激活的Fas可通过其DD结合并聚集衔接蛋白Fas相关死亡结构域,导致FADD(Fas-associated death-domain)构象改变,此时的FADD可通过其自身的死亡效应结构域与具备同源结构的Caspase 8,形成由FasL、Fas、FADD、Caspase 8组成的死亡诱导复合物(death inducing signaling complex,DISC),该复合物具有裂解并激活凋亡蛋白酶Caspase 3的能力,引发细胞凋亡过程的级联反应,导致细胞凋亡。
因此,本研究利用HO构建奶牛子宫内膜细胞氧化应激损伤模型,在此基础上,探讨氧化应激通过Fas/FasL信号通路影响子宫内膜细胞凋亡的可能作用机制,旨在为解决生产中奶牛早期胚胎流产难题提供理论借鉴。
1 材料与方法
1.1 材料
1.1.1 主要试剂 DMEM/F12培养基、0.25%Trypsin-EDTA购自Gibco公司;胎牛血清FBS、三抗混合液购自Biological Industries公司;血清白蛋白BSA、HO购自Sigma公司;Annexin V凋亡试剂盒、SOD试剂盒、CAT试剂盒、2,7-二氯荧光素二乙酸酯(DCF-DA)试剂盒、总谷胱甘肽含量(GSX)试剂盒、氧化型谷胱甘肽(GSSG)试剂盒、细胞周期试剂盒购自碧云天生物公司;引物购自济南铂尚生物公司;FasL酶标试剂盒购自Scientific公司;TRIzon Reagent购自康为世纪公司;Hiscript ⅡQ RT SuperMix for qPCR (+gDNA wiper)、Cham QTM SYBR Color qPCR MasterMix购自南京诺唯赞公司。
1.1.2 主要仪器 倒置相差显微镜(Nikon)、流氏细胞仪(BD)、高速冷冻离心机(Eppendorf)、酶标仪(伯腾)、CO细胞培养箱(Thermo)、荧光定量PCR仪(Roche)、化学发光凝胶成像系统(Invitrogen)。
1.2 方法
1.2.1 奶牛子宫内膜细胞培养和处理 奶牛子宫内膜细胞系(BEND)购自上海冠导生物工程有限公司,取自美国拉勒米怀俄明州发情第14天的荷斯坦奶牛子宫内膜。按照常规方法将复苏的细胞放入完全培养液(含10%胎牛血清、1%三抗的DMEM/F12培养液)中,置于38.5 ℃、100%湿度、5% CO的培养箱内培养。待细胞贴壁至80%~90%时用0.25%胰酶(含0.05% EDTA)消化,加入完全培养液调整细胞密度为1×10个·mL。根据不同试验目的,分别接种到6孔培养板或T25培养瓶中,置于38 ℃、5% CO、饱和湿度的培养箱内培养。待细胞贴壁80%~90%时,分别用100、200、300 μmol·LHO处理6 h,对照组为未添加HO组。
1.2.2 细胞内ROS检测 用PBS漂洗细胞,加入0.25%胰酶消化3~5 min,待细胞脱落下来后加入含10% FBS的培养液终止消化, 300×、5 min离心,弃掉上清液;加入5 μmol·LDCF-DA轻轻吹打混匀,置于38 ℃、5% CO、饱和湿度的培养箱内培养30 min;用PBS离心洗涤两次,流式细胞仪上机检测。
1.2.3 SOD和CAT活性检测 用PBS漂洗细胞后,消化、离心收集细胞,加入蛋白裂解液超声波作用5 min, 4 ℃、12 000×离心10 min收集上清液;按照SOD和CAT试剂盒说明书要求进行活性检测;采用BCA蛋白质检测试剂盒测定平行样品蛋白浓度;样品酶活即为样品总的酶活性与蛋白浓度的比值,以“单位·mgprotein”表示。
1.2.4 GSH和GSSG检测 用PBS漂洗细胞后,消化、离心收集细胞,加入蛋白裂解液超声波作用5 min, 4 ℃、12 000×离心10 min收集上清液;按照GSX和GSSG说明书要求,分别检测GSX和GSSG含量;采用BCA蛋白质检测试剂盒测定平行样品蛋白浓度;样品中GSH含量为GSX与GSSG的差值;样品GSX、GSSG、GSH浓度即为每个指标总含量与蛋白浓度比值。
1.2.5 细胞周期检测 用PBS漂洗细胞后,消化、离心收集细胞,加入70%冷乙醇4 ℃固定30 min;离心收集细胞并用冷PBS于300×、5 min离心洗涤两次;弃掉上清液收集细胞沉淀,于含PI、Triton X-100和RNaseA的PBS液中4 ℃孵育1 h;流式细胞仪上机检测。
1.2.6 细胞凋亡检测 待测细胞培养板用PBS液洗两次,加入胰酶37 ℃消化5 min,待大部分细胞脱落时加入含10% FBS的细胞培养液轻轻吹打,收集细胞悬液到1.5 mL离心管中,300×离心5 min, 去掉上清液,加入195 μL缓冲液轻轻重悬细胞,然后加入5 μL Annexin V-FITC并轻轻混匀,室温避光孵育10 min,再加入10 μL PI染液轻轻混匀,室温避光孵育5 min,流式细胞仪上机检测。
1.2.7 FasL含量检测 参考张辰等的方法,在酶标板孔中分别加入100 μL标准品或待测样品,然后每孔加入100 μL酶结合物工作液,37 ℃避光孵育60 min,洗板5次;每孔加入100 μL生物素化抗体工作液,37 ℃孵育60 min,洗板5次;加入100 μL显色底物,37 ℃避光孵育15 min;最后加入100 μL终止液,酶标仪测定450 nm处吸光度,经空白校准后绘制标准曲线并计算每个样品的蛋白浓度。
1.2.8 荧光定量RT-PCR 1)引物设计:利用Primer 5.0软件设计PCR引物(表1)。2)Real-time PCR:利用试剂盒进行细胞总RNA提取,并通过A260∶A280比值和琼脂糖电泳检测RNA纯度和完整性。采用试剂盒进行cDNA合成,-20 ℃保存备用。Real-time PCR采用20 μL反应体系:SYBR Premix 10 μL,上、下游引物各1 μL,cDNA模板2 μL,ddHO 6 μL;扩增条件为:95 ℃预变性30 s; 95 ℃变性10 s,60 ℃ 30 s,反应40个循环;95 ℃ 15 s, 60 ℃ 60 s,95 ℃ 15 s。设置内参-表达量作为参照,采用2法计算mRNA的相对表达量。

表1 PCR引物序列参数
1.2.9 Western blot 参考张辰等的方法,细胞用预冷的PBS洗两次,加入蛋白裂解液反复吹打,收集裂解液4 ℃高速离心吸取上清液;将所有样品的总蛋白浓度调节至1 mg·mL;向样品离心管中加入缓冲液,混匀后置于水中煮沸5 min,使蛋白质变性;制备5%浓缩胶和12%分离胶,将蛋白样品加入点样孔中,浓缩胶和分离胶电泳电压分别为90 和120 V;70V电压下转膜30 min;将PVDF膜取出置于含3%BSA的TBST中室温封闭1 h;取出将PVDF膜置于一抗中4 ℃过夜,TBST洗膜;将PVDF膜放入辣根过氧化物酶标记的二抗溶液室温孵育2 h,TBST洗膜;取出PVDF膜,加入化学发光液室温避光孵育2 min,使用凝胶成像系统拍照并进行灰度分析,计算蛋白相对表达量。
1.2.10基因RNAi 设计干扰Fas基因的shRNA序列(GAT CCG GAA CGA GTA CAC AGA CAA GAT TCA AGA GAT CTT GTC TGT GTA CTC GTT CCT TTT TTA),并使用乱码序列作为阴性对照。将子宫内膜细胞以1×10个·mL接种于6孔培养板,置于38 ℃、5% CO、饱和适度的培养箱内培养12~16 h,直至贴壁约30%~40%;加入shRNA-Fas-慢病毒(Lv-shFas)或 shRNA-control-慢病毒(Lv-shCon)感染24 h;弃掉含病毒的培养液,更换新鲜培养液继续培养48 h;200 μmol·LHO处理细胞6 h, 收集细胞用于细胞凋亡和蛋白检测。试验分为4组,分别为:HO和慢病毒未处理组(A组)、HO处理慢病毒未处理组(B组)、HO和Lv-shCon慢病毒处理组(C组)、HO和Lv-shFas慢病毒处理组(D组)。
1.3 数据分析
所有试验都重复3次以上。试验数据采用SPSS19.0统计软件的ANOVA模块进行分析,数据先经LSD转换后进行单因素方差分析,<0.05为差异显著。
2 结 果
2.1 不同浓度H2O2对子宫内膜细胞氧化损伤的影响
不同浓度HO处理子宫内膜细胞6 h,利用流式细胞仪、酶标仪分别进行细胞内ROS水平、抗氧化酶SOD和CAT活性以及非酶性抗氧化物质GSH/GSSG比值检测。结果(图1)表明, 100 和200 μmol·LHO处理组中ROS荧光探针强度都显著高于对照组(<0.05),然而当HO处理浓度达到300 μmol·L时,流式细胞仪检测到大量细胞碎片,说明已有部分细胞出现碎裂。SOD、CAT酶活性以及GSH/GSSG比值都以HO浓度依赖性降低。上述结果表明,200 μmol·LHO处理子宫内膜细胞6 h构建氧化应激模型。

A. ROS阳性细胞比例;B. SOD酶活性;C. CAT酶活性;D. GSH水平;E. GSSG水平;F. GSH/GSSG比值A. Percentage of ROS positive cells;B. SOD activity;C. CAT activity;D. Levels of GSH;E. Levels of GSSG;F. Ratio of GSH/GSSG图1 不同浓度H2O2对子宫内膜细胞氧化损伤的影响Fig.1 Effects of different concentrations of H2O2 on oxidative damage of endometrial cells
2.2 氧化应激对子宫内膜细胞生长周期和凋亡的影响
选择200 μmol·LHO处理子宫内膜细胞6 h,分别进行生长周期和凋亡检测。结果(图2)表明,与对照组相比,200 μmol·LHO处理组显著提高细胞凋亡比例(<0.05)和降低细胞处于S期比例(<0.05)。
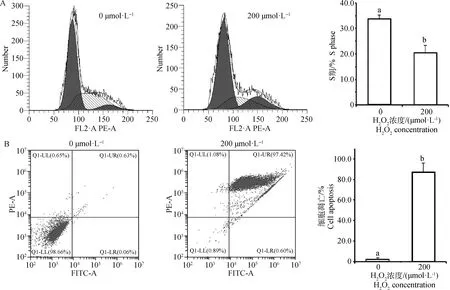
A.细胞周期中S期比例;B. 细胞凋亡比例A. Percentage of S phase in cell cycle distribution;B. Percentage of cell apoptosis图2 氧化应激对子宫内膜细胞生长周期和凋亡的影响Fig.2 Effects of oxidative stress on cell cycle and apoptosis of endometrial cells
2.3 氧化应激对Fas/FasL凋亡通路关键基因表达的影响
选择200 μmol·LHO处理子宫内膜细胞6 h,利用qRT-PCR和Western Blot分别检测Fas/FasL凋亡通路关键基因的mRNA和蛋白表达。结果(图3)表明,与对照组相比,200 μmol·LHO处理组显著提高、8、3基因的mRNA表达水平(<0.05);培养液中FasL浓度以及Fas、Caspase 8、Caspase 3基因的蛋白表达水平也都显著升高(<0.05)。
2.4 Fas干扰对细胞凋亡及Fas/FasL通路关键基因表达的影响
为进一步验证Fas/FasL通路参与氧化应激诱导子宫内膜细胞凋亡,利用慢病毒对Fas基因进行RNA干扰,结果(图4)发现,细胞Fas干扰后再经HO处理6 h,细胞凋亡率显著低于HO处理组,培养液中FasL 浓度以及Fas、Caspase 8、Caspase 3蛋白表达水平也显著降低。以上结果说明,Fas/FasL凋亡通路参与氧化应激诱导的子宫内膜细胞凋亡。
3 讨 论
研究发现,异常高的氧化应激会在细胞内产生大量的氧化中间体(如ROS),这些中间体是高活性自由基,其是否蓄积取决于氧化和抗氧化系统之间的平衡。如果细胞内氧化还原平衡被破坏,导致脂质、蛋白质和核酸发生氧化,造成细胞死亡。SOD和CAT是针对超氧自由基抗氧化防御的关键酶,它们在与氧化应激抗性相关的疾病中活性降低。GSH是一种非酶促抗氧化细胞因子,在ROS清除和活性物质淬灭中起重要作用。本研究选择200 μmol·LHO作为氧化剂处理子宫内膜细胞6 h,发现细胞内大量ROS蓄积,SOD和CAT活性显著降低,以及GSH的抗氧化系统受到严重破坏。说明子宫内膜细胞在此处理条件下受到氧化损伤,造成氧化应激。这与Tokaç等、Mathachan等、Zhao等报道一致。然而,Harris和Denicola报道,当化学、物理或生物因素引起细胞应激的状态下,ROS水平升高超出正常范围,激活SOD、CAT、谷胱甘肽过氧化物酶(GPx)等抗氧化酶的表达和活性,清除过量的ROS,恢复细胞的ROS稳态。由此推测,这可能由于当细胞所受的应激强度较小或时间较短,抗氧化系统足以抵抗ROS的负面影响;而当细胞长期处于高浓度HO刺激时,抗氧化系统遭到破坏,导致SOD和CAT的活性都降低。
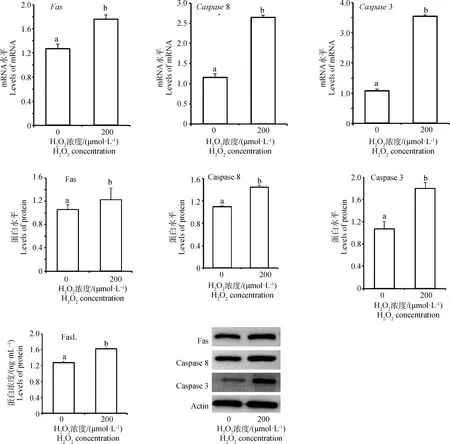
图3 Fas/FasL凋亡通路关键基因的mRNA和蛋白表达水平Fig.3 Levels of mRNA and protein expression of key genes in Fas/FasL apoptosis pathway

A. H2O2和慢病毒未处理组;B. H2O2处理、慢病毒未处理组;C. H2O2和Lv-shCon慢病毒处理组;D. H2O2和Lv-shFas慢病毒处理组A. Neither treated with H2O2 or lentiviruse;B. H2O2 treated and lentiviruse untreated;C. Infected with Lv-shCon prior to treatment with H2O2;D. Infected with Lv-shFas prior to treatment with H2O2图4 Fas基因RNAi对细胞凋亡及Fas/FasL凋亡通路关键基因的影响Fig.4 Effects of RNAi of Fas gene on apoptosis and protein expression of key genes in Fas/FasL apoptosis pathway
研究表明,氧化应激通过诱导细胞凋亡严重影响机体组织或器官的功能。ROS在氧化应激诱导的细胞凋亡中起重要作用,可以很容易地攻击生物分子,最终导致细胞凋亡或坏死。本研究表明,200 μmol·LHO处理子宫内膜细胞6 h, 凋亡细胞比例显著升高。以前研究表明,生理或病理性凋亡刺激对细胞周期进程有影响。因此,本研究有必要对细胞周期进行检测。结果发现,HO处理降低子宫内膜细胞S期比例,进而抑制细胞增殖。由此我们推断:氧化应激可能通过影响细胞周期进程,进而诱导子宫内膜细胞凋亡。
近年来研究发现,Fas/FasL信号通路是细胞和组织中非常重要的凋亡途径。Fas在正常哺乳动物胸腺、心、肝、肺、睾丸和其他组织,而FasL存在于大网膜、睾丸、胎盘和其他器官中。Fas是细胞凋亡级联反应最重要的上游信号分子,FasL可以作为膜分子或作为哺乳动物细胞表面的可溶性分子存在。Fas与FasL结合并伴随着FADD的募集,引发下游的Caspase 8激活,随后形成死亡诱导信号复合物 (DISC)进而激活Caspase 3,最终导致细胞凋亡。已有研究证明,在人卵巢颗粒细胞、成牙骨质细胞、小鼠肠上皮细胞中,氧化应激通过Fas/FasL通路诱导细胞凋亡。本研究发现,氧化应激提高奶牛子宫内膜细胞Fas、FasL的mRNA和蛋白表达水平,说明Fas/FasL信号通路被激活;随后Caspase 8表达水平升高,这是Fas介导的Caspase依赖性细胞凋亡途径的重要组成部分,然后募集到下游Caspase 3并诱导细胞凋亡。基因表达抑制后,在一定程度上降低HO诱导的细胞凋亡比例以及Fas/FasL通路凋亡相关基因表达,进一步说明Fas/FasL信号通路参与氧化应激诱导的子宫内膜细胞凋亡。
4 结 论
本研究结果表明,氧化应激通过激活Fas/FasL信号通路促进奶牛子宫内膜细胞凋亡,这为解释氧化应激对子宫内膜细胞的不利影响提供了新的见解。
