SRSF10对山羊肌内前体脂肪细胞分化的影响
2022-07-07刘珂含李艳艳王重洋朱江江林亚秋
刘珂含,王 永,李艳艳,王重洋,朱江江,熊 燕,李 安,林亚秋*
(1.西南民族大学畜牧兽医学院,成都 610041; 2.青藏高原动物遗传资源保护与利用教育部/四川省重点实验室,成都 610041)
肉质性状是动物的重要经济性状,肌内脂肪(IMF)含量又是影响肉质性状的关键因素,脂肪含量过低会导致肉风味的下降。基于此,畜牧工作者对动物IMF形成的分子调控网络尤为关注。脂肪细胞分化过程包括多潜能干细胞-前体脂肪细胞-脂肪细胞,其中前体脂肪细胞具有体积小、呈梭形、间质少、胞浆内不含脂滴的特点,且在体内和体外都可以在多种转录因子调控下激活脂肪组织相关基因,并在这些基因的顺序性调控下,经一系列复杂步骤分化为成熟脂肪细胞,此过程伴随着胞浆内脂滴聚集。前体脂肪细胞分化是脂肪细胞脂质蓄积的过程,是影响动物肌内脂肪沉积的重要途径之一,此生物学过程涉及诸多激素分泌和基因表达的相互调控,例如过氧化物酶体增殖物激活受体(proxisome proliferator-activated receptors, PPARs)、CCAAT 增强子结合蛋白(CCAAT/enhancer-binding proteins,C/EBPs)、固醇调节元件结合蛋白异形体1(sterol regulatory element binding protein isoform 1,SREBP1)、脂蛋白脂酶(lipoprotein lipase,LPL)和前脂肪细胞因子1(preadipocyte factor-1,Pref-1)等。由于肌内脂肪细胞分散在肌肉组织中,肌内脂肪的沉积不仅取决于肌内脂肪细胞的分化和增殖,而且还受肌肉生长率及其代谢活动的影响,因此肌内脂肪细胞与其他脂肪细胞相比具有特殊的增殖和分化模式。最近研究发现,可变剪接(alternative splicing, AS)在脂肪细胞分化中发挥着重要作用,阐明关键的可变剪接因子对脂肪细胞分化的调控作用及构建动物肌内脂肪细胞分化的分子机制具有重要的理论与实际意义。
含丝氨酸/精氨酸剪接因子(serine/arginine-rich splicing factor 10,SRSF10)也称为SRp38,是一种非典型富含丝氨酸/精氨酸剪接因子(serine/arginine-rich splicing factor,SRSF),作为基因表达调控机制的可变剪接体在生物体内普遍存在。研究发现,10作为可变剪接因子在mRNA可变剪接调控和葡萄糖、脂肪、胆固醇等代谢过程皆有重要作用,即作为序列特异性剪接因子与外显子剪接增强子结合、参与器官发育和癌细胞转化等。Li等研究发现,10缺陷的小鼠白色脂肪组织发育严重受损,进一步研究发现,10可通过抑制lipin1α的产生促进脂肪细胞分化,为脂肪细胞分化所必需。但尚未见在山羊等家畜中的研究报道。
本实验室前期通过高通量测序发现,10是山羊肌内脂肪细胞分化前后的上调因子,推测其可能发挥重要的调控作用。本研究旨在明确山羊10基因的生物学特性及揭示山羊10在肌内脂肪细胞分化中的调控作用,为进一步阐明10基因的生物学功能以及完善山羊肌内脂肪沉积过程中的分子调控网络提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验样品采集 供试动物是3只1周岁简州大耳公羊(四川省简阳大哥大牧业有限公司),3只 公羊生理状态良好、饲养条件为舍饲圈养。合理屠宰试验动物,将肝组织剪成小块,焦碳酸二乙酯(DEPC)水浸泡清洗,无菌锡箔纸包裹,最后分装到冷冻管中并做好标记放于液氮罐中保存。本试验中所用的山羊肌内前体脂肪细胞来自于本实验室前期冻存的7日龄羔羊的前体脂肪细胞。
1.1.2 主要试剂 转染试剂(Lipo-fectamineRNAIMAX Reagent)购自Invitrogen;2ⅹGC-Rich PCR Mix酶、007VS连接试剂盒、感受态细胞DH5α购自TSINGKE;限制性内切酶(d Ⅲ、Ⅰ)、反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)购自Thermo Fisher Scientific;琼脂糖凝胶回收试剂盒购自Tiangen;TB GreenTM Premix Ex TaqTM Ⅱ试剂盒、动物RNA提取试剂购自TaKaRa;焦碳酸二乙酯、胎牛血清、DMEM培养基、油酸购自Sigma;双抗、PBS、胰蛋白酶购自Hyclone。
1.2 方法
1.2.1 RNA的提取及反转录 液氮中研磨肝组织,向1.5 mL EP管中加入适量研磨产物,按Trizol法提取RNA并利用RevertAid First Strand cDNA Synthesis Kit试剂盒进行反转录。
1.2.2 山羊10基因克隆 通过NCBI和Primer Primer5.0软件查找山羊10的预测序列(Gene ID:102179247)并设计特异性引物(表1)。以山羊肝组织为模板,应用RT-PCR技术和10 g·L琼脂糖凝胶电泳进行克隆和产物检测。在胶图中找出正确条带,利用DNA回收试剂盒进行回收,将回收到的基因片段在金属浴中连接至pClone007 Versatile Simple Vector载体,冰上溶解DH5α感受态细胞后,水浴热激再转化,随后接种到已凝固的含有抗生素AMP和LB培养基的培养皿中,37 ℃培养箱过夜,将形状良好的分散菌落挑取至LB液体培养基中,待菌液浑浊进行菌液PCR检测并测序。对所获得的山羊10基因序列进行生物信息学分析,生物信息学分析内容及相应分析工具见表2。
1.2.3 山羊10基因时序表达谱的构建 设计1对特异性引物用于qPCR检测,以作为内参基因矫正基因的相对表达水平(表1),检测10基因在山羊肌内脂肪细胞诱导分化过程中0~120 h每间隔12 h的表达水平。
1.2.4 山羊10过表达载体构建和干扰序列合成 根据山羊10基因CDS区553 bp的序列和pcDNA3.1载体,利用BioXM2.6找出适宜的酶切位点(d Ⅲ、Ⅰ),并设计亚克隆引物(表1)。利用d Ⅲ 和Ⅰ对pcDNA3.1载体和亚克隆获得的完整山羊10基因 CDS 区序列进行双酶切。双酶切体系:pcDNA3.1:d Ⅲ、Ⅰ 各1 μL,相应Buffer 2 μL,ddHO 补至20 μL; 目的片段:d Ⅲ 和Ⅰ各1 μL,Buffer 2 μL, ddHO 补至20 μL;37 ℃金属浴30 min。利用实验室试剂盒进行纯化,T4酶连接纯化产物,随后转化至DH5α感受态细胞,接种、挑菌及测序方法同“1.2.2”,最后使用限制性内切酶d Ⅲ 和Ⅰ对重组的pcDNA3.1-10质粒进行酶切后电泳,即双酶切鉴定。山羊siRNA序列和Negative control序列由广州吉赛生物科技股份有限公司合成,见表3。siRNA经12 000 r·min离心10 min,并溶解于125 μL DEPC水,最终浓度为20 μmol·L。
1.2.5 山羊肌内脂肪细胞培养及转染 37 ℃水浴解冻本实验室冻存的山羊肌内前体脂肪细胞,将细胞接种于装有双抗及10 mL· L胎牛血清的DEME/F-12培养基的培养瓶中进行培养,待F3代细胞生长至80%时,将细胞接种至12和24孔板中,每孔细胞生长至80%时转染。山羊10过表达组设置pcDNA 3.1-10组和pcDNA3.1阴性对照组。按转染试剂的说明书配制预混液,即pcDNA 3.1-10质粒1 μg,转染试剂4 μL及200 mL的无血清培养基,轻微震荡混匀后,室温孵育15 min。将孵育好的预混液均匀滴加到细胞中,振荡混匀并置于培养箱中培养12 h后,使用油酸诱导细胞分化,2 d后利用TRizol收集12孔板的细胞,提取细胞RNA后反转录,将cDNA置于-20 ℃冰箱保存。山羊10干扰组设置siSRSF10-1、siSRSF10-2和Negative control(阴性对照组),转染方法同过表达组。
1.2.6 油红O染色和Bodipy染色 用于染色的细胞接种于24孔板,处理方式同“1.2.5”。10 mL·L甲醛固定诱导2 d的细胞30 min,在固定细胞前后各用PBS缓冲液清洗,油红O染色:利用适量油红O工作液染色30 min,PBS洗去油红O工作液,使用显微镜观察脂滴情况并拍照,拍照结束后,每孔加入1 mL异丙醇溶解油红O,混合均匀后迅速放于酶标仪中检测吸光度(OD)。Bodipy染色:向1 mL PBS中加入1 μL Bodipy染料配置成Bodipy工作液,每孔加入200 μL,避光染色20 min,荧光显微镜下观察并拍照。
1.2.7 qPCR检测过表达和干扰效率及脂肪细胞分化标志基因的表达 以“1.2.5”中得到的cDNA作为模板,利用qPCR检测山羊10过表达和干扰的转染效率以及脂肪细胞分化标志基因的表达差异,以基因作为内参基因。qPCR引物信息见表1。

表1 引物信息
1.2.8 数据统计与分析 以与作为内参基因,采用2法对qPCR数据进行分析。使用SPSS 20.0软件中的One-way ANOVA方法分析数据差异显著性,Duncan法对时序数据进行多重比较,使用GraphPad Prism5.0绘制表达谱,参照Duncan 法分析结果对数据进行差异显著性标记。
2 结 果
2.1 山羊SRSF10基因克隆
RT-PCR扩增获得10基因的目的条带(图1A)。分析测序结果发现,10基因由1 026 bp 的核苷酸序列组成,其中包括CDS区552 bp, 5′UTR序列99 bp,3′UTR序列398 bp,共编码183个氨基酸(图1B)。经NCBI数据库得到山羊10基因的GenBank登录号为MZ055377。
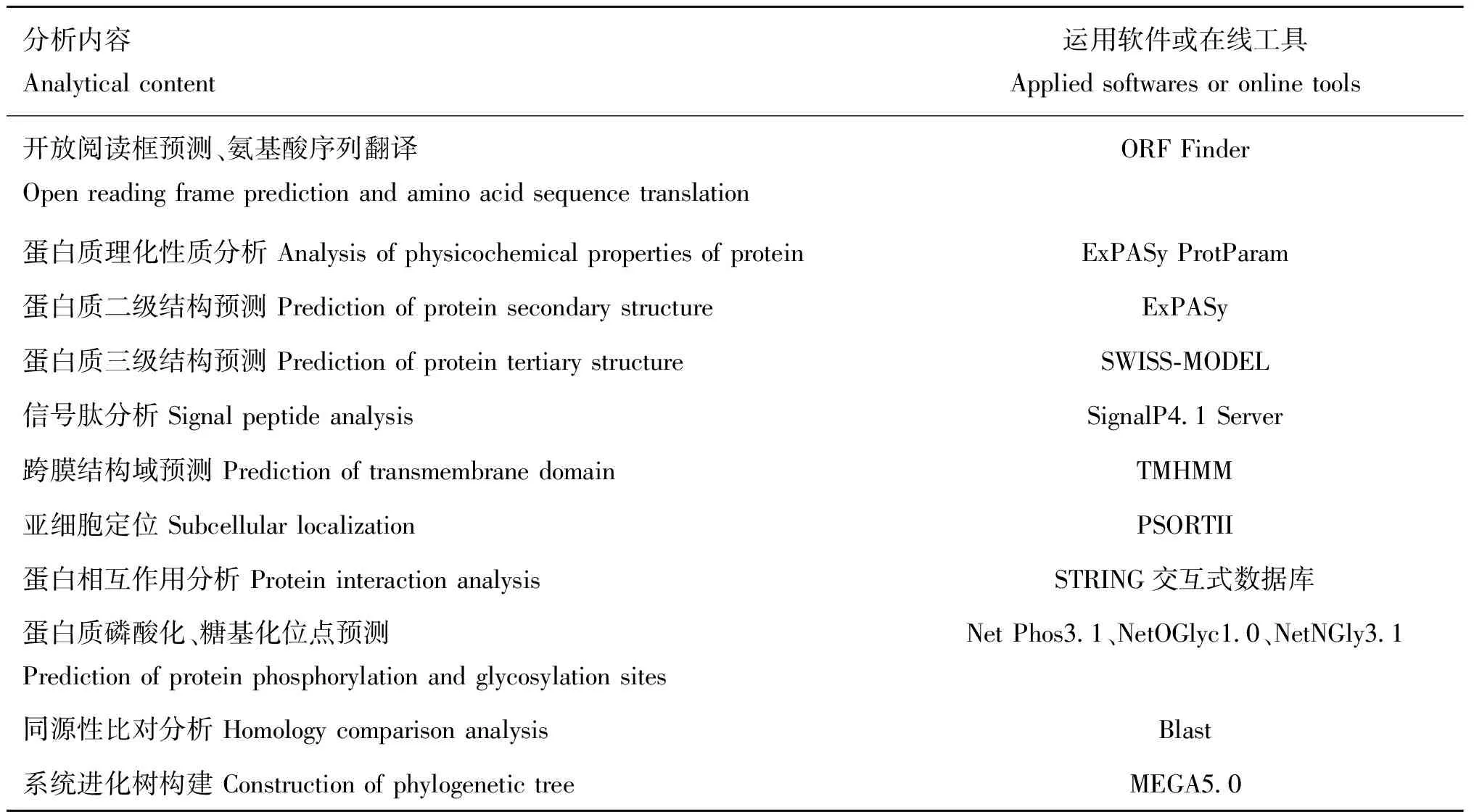
表2 分析内容及相应分析工具

表3 山羊SRSF10基因的siRNA序列
2.2 SRSF10的生物信息学分析
2.2.1 基本理化性质分析 在线网站(表2)预测山羊SRSF10 蛋白的基本理化性质,预测结果见表4。
2.2.2 蛋白质结构分析 Conserved Domains预测发现SRSF10具有超家族RRMSF结构(图2A)。根据ExPASy预测SRSF10二级结构,发现其包含了α螺旋(Hh)、延伸链(Ee)、β转角(Tt)及无规卷曲(Cc)4种结构,组成这些结构的氨基酸数及占比分别为42(23.50%)、25(13.66%)、12(6.56%)及103(56.28%)(图2B);利用SWISS-MODEL预测SRSF10三级结构,获得由α螺旋、延伸链、β转角和无规卷曲四者交替出现的结构图,结果与二级结构预测一致(图2C);使用STRING对SRSF10进行蛋白互作分析并构建蛋白互作网,结果显示,SRSF10可能与SRSF1、SRSF4、SFPQ、RBM24、RBM25、MBNL1和PHGDH等蛋白存在互作关系(图2D)。
2.3 山羊SRSF10基因时序表达谱的构建
山羊10基因在诱导分化的0~120 h肌内脂肪细胞中均存在表达,且在诱导分化96 h后表达水平最高,极显著高于未诱导分化之前表达水平(<0.01,图3)。
2.4 山羊SRSF10对肌内前体脂肪细胞分化的影响
2.4.1 基因过表达载体构建 琼脂糖凝胶电泳图中出现两条符合pcDNA3.1(5 427 bp)和10(553 bp)长度的条带(图4),测序结果与预期一致,即过表达载体构建成功。
2.4.210的过表达和干扰效率检测 qPCR检测结果显示,过表达10基因后的表达效率约为对照组的119.87倍(<0.01,图5A);干扰10(siSRSF10-1和siSRSF10-2)后其相对表达量均极显著低于对照组(<0.01),干扰效率分别为80.60%和67.03%(图6A)。

A.山羊SRSF10基因扩增:M. DNA相对分子质量标准;1.SRSF10。B.山羊SRSF10基因核苷酸及推测的氨基酸序列:ATG为起始密码子;*.终止密码子;星形为苏氨酸(Thr)磷酸化位点;圆形为丝氨酸(Ser)磷酸化位点;阴影框为功能结构域A.Amplification of SRSF10 gene in Capra hircus: M.DL2000 DNA Marker; 1. SRSF10 gene. B.The nucleotide sequence and the deduced amino acid sequence of SRSF10 in goat: ATG is the start codon; *. The stop codon; The phosphorylation site of threonine(Thr)is star; Circles are the phosphorylation site of serine(Ser); The shadow box is functional domain图1 山羊 SRSF10 基因克隆Fig.1 Cloning of SRSF10 in goat

表4 SRSF10基本理化性质
2.4.3 形态学观察 观察油红O和Bodipy染色发现,OESRSF10组荧光增多、脂滴积累增加(图5C);利用异丙醇提取并检测两组细胞,发现OESRSF10组与Negative Control组的OD值变化显著(图5B,<0.05);干扰10后的结果与之相反(图6B-C)。

A.SRSF10蛋白生物学功能的预测;B.山羊SRSF10蛋白二级结构预测;C.山羊SRSF10蛋白三级结构;D.山羊SRSF10蛋白互作分析A.Prediction of biological function of SRSF10 protein; B.Prediction of SRSF10 protein secondary structure in goats; C.Prediction of goat SRSF10 protein tertiary structure; D.Interaction analysis of SRSF10 protein in goat图2 山羊 SRSF10蛋白质结构分析Fig.2 Structural analysis of goat SRSF10 protein
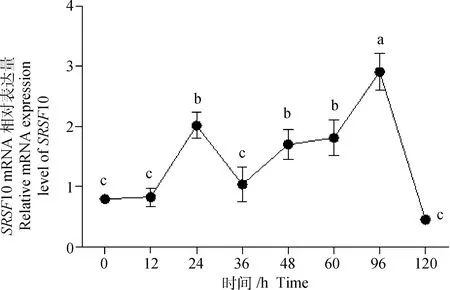
不同小写字母表示差异极显著(P<0.01)Different lowercase letters indicate extremely significant difference(P<0.01)图3 SRSF10基因在山羊肌内前体脂肪细胞分化过程中的相对表达水平Fig.3 Relative expression level of SRSF10 during the differentiation of intramuscular preadipocytes in goat
2.5 过表达与干扰山羊SRSF10对脂肪细胞分化标志基因表达的影响
过表达山羊10后,脂肪细胞分化标志基因1、和基因的表达水平呈极显著上升(<0.01);1和表达量极显著降低(<0.01);相对表达水平显著降低(<0.05,图7A);而干扰10后,分化标志基因表现为极显著下调趋势(<0.01,图7B)。
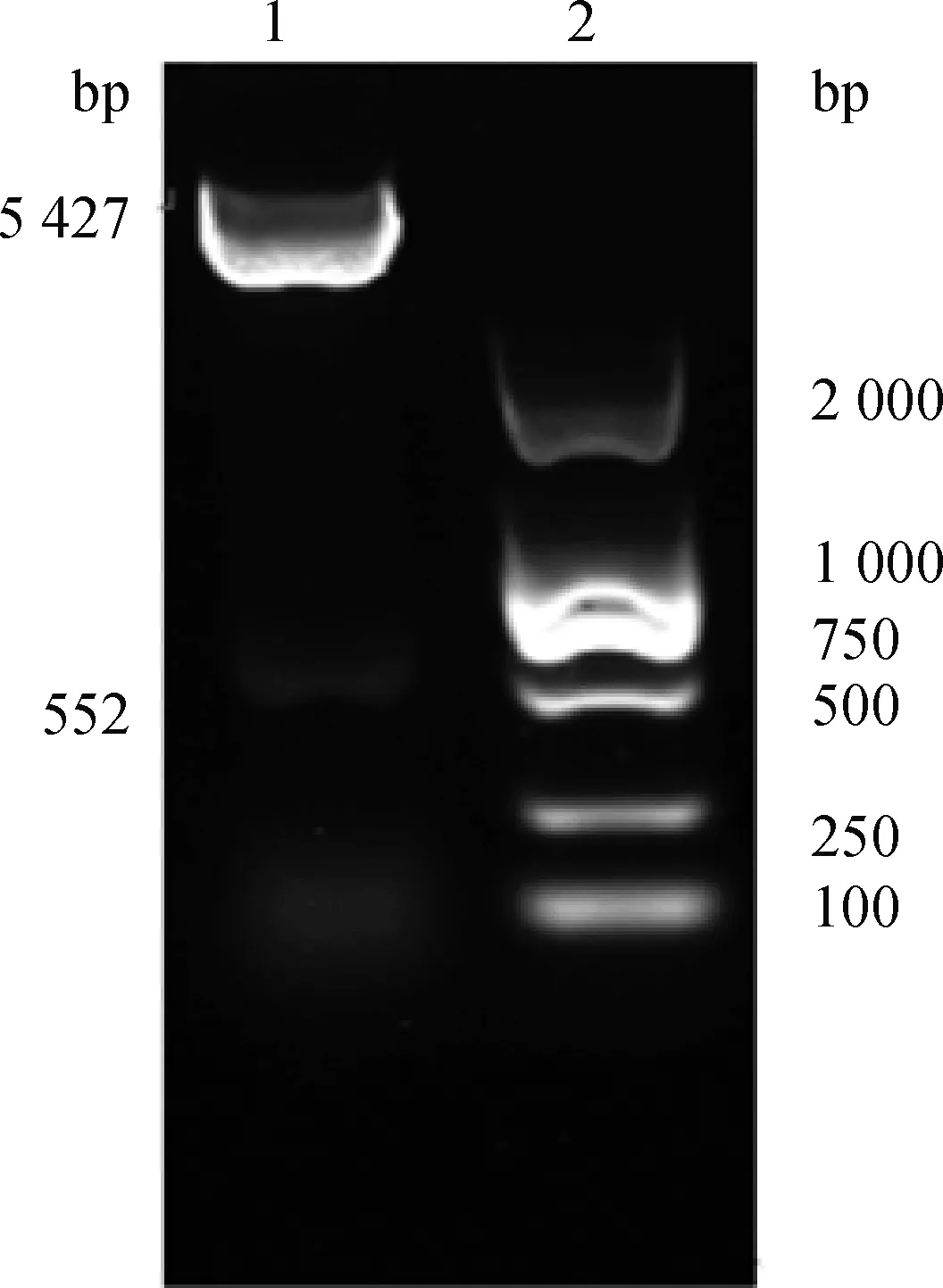
1.pcDNA3.1-SRSF10;2.DNA Marker图4 pcDNA3.1-SRSF10双酶切鉴定Fig.4 Double digestion identification of pcDNA3.1-SRSF10
3 讨 论
可变剪接作为一种调控基因表达的机制在动物脂肪细胞分化中也备受重视,研究发现与脂肪细胞分化有关的可变剪接因子有过氧化物酶体增殖物激活受体γ(PPARγ)、脂肪与肥胖相关蛋白(FTO)和锌指蛋白638(zinc finger protein 638, ZNF638)等。10作为本实验室前期筛选出的山羊肌内脂肪细胞分化前后的差异因子,也属于可变剪接因子。研究发现,可变剪接可通过调节动物脂肪代谢和甘油三酯代谢等生物学过程来影响猪、牛和鸡等动物的肉质。为了明确基因10对肌内脂肪细胞分化的调控作用,本试验通过RT-PCR克隆得到10基因,通过分析发现山羊10基因具有6个磷酸化位点和12个O-糖基化位点,这些位点有助于细胞转录和蛋白分子生物活性的表达,从而促进10的转录调控作用。此外,本试验还发现山羊10具有RRM_SF超家族结构,RRM结构是SRs十二个成员(SRSF1-12)共有的一个结构特征,存在于N端,具有附属结构域SR。RRM结构域可以识别RNA并确定RNA与10的绑定特异性,而附属结构域SR则介导磷酸化调节的多种蛋白-蛋白互作和蛋白-RNA互作。

A.SRSF10基因过表达效率,**为P<0.01,下同;B.油红O染色检测OD490 nm值,*为P<0.05,下同;C.油红O(上图)和Bodipy染色(下图)分析(200×)A.The overexpression efficiency of SRSF10 gene,**.P<0.01, the same as below; B.The OD490 nm value detected by Oil red O staining,*.P<0.05, the same as below; C.Oil red O(up figure)and Bodipy staining analysis(down figure)(200×)图5 过表达山羊SRSF10对肌内前体脂肪细胞分化的影响Fig.5 The effect of SRSF10 overexpression on differentiation of intramuscular preadipocyte in goat

A.SRSF10基因干扰效率;B.油红O染色检测OD490 nm值;C.油红O(上图)和Bodipy染色(下图)分析(100×)A.The interference efficiency of SRSF10 gene; B.The OD490 nm value detected by Oil red O staining; C.Oil red O(up figure)and Bodipy staining analysis(down figure)(100×)图6 干扰山羊SRSF10对肌内前体脂肪细胞分化的影响Fig.6 The effect of SRSF10 interference on differentiation of intramuscular preadipocyte in goat
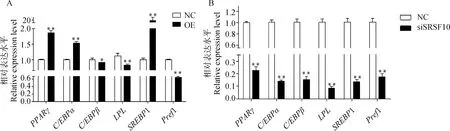
图7 脂肪细胞分化标志基因表达水平Fig.7 Expression levels of adipocyte differentiation marker genes
本试验进一步检测了10在山羊肌内脂肪细胞分化0~120 h的表达情况,发现在分化过程中均存在表达,且在诱导分化的96 h表达水平达到峰值,显著高于未分化前体脂肪细胞中的表达水平。为了最终阐明山羊10基因对肌内脂肪细胞分化的调控作用,本试验利用过表达和干扰手段对其进行深入研究,油红O染色和Bobipy染色结果均显示,过表达10基因显著促进山羊肌内脂肪细胞的脂滴积聚,干扰10基因后脂滴积聚明显减少,这与Li等在小鼠中的研究结果类似。为进一步阐明其作用方式及分子机制,对过表达和干扰10后山羊脂肪细胞分化标志基因变化进行检测。研究发现,过表达和干扰10后,脂肪细胞分化标志基因1、和发生了相应的变化。和被认为是脂肪生成的主要调节因子,1同为脂肪生成的主要调节因子,且为正调节脂肪细胞分化因子。然而研究发现,作为脂肪细胞分化标志基因的负调控因子1和正调控因子没有发生相应的变化,有研究显示在3T3-L1细胞中增加1的表达量可抑制和的表达,本试验中出现这样的结果可能是因为干扰时存在一种负反馈机制降低了1表达水平,具体作用机制需进一步研究。是脂肪生成早期的关键转录因子,在脂肪细胞分化过程中可激活和基因的表达,本试验过表达山羊10时发现该基因表达水平下降,原因可能为三者之间存在负反馈机制。综合过表达和干扰结果,山羊10基因可能通过上调1、和的表达,从而促进了脂肪细胞分化。但完全阐明山羊10调控肌内脂肪细胞分化的分子机制仍需进一步利用高通量测序、双荧光素酶报告系统等试验进行诠释。
4 结 论
本研究克隆得到山羊10基因序列1 026 bp(GenBank登录号为MZ055377)。山羊10在肌内脂肪细胞诱导分化0~120 h均存在表达,在诱导分化96 h表达量达到峰值,显著高于未诱导分化的前体脂肪细胞的表达水平。过表达和干扰山羊10基因分别会促进和抑制肌内脂肪细胞脂滴积聚,并且这种作用可能是通过调控、和1的表达来实现的。
