敲低mGluR5通过激活PI3K/AKT信号通路减轻阿尔茨海默病相关病变*
2022-07-06魏雪敏陈秋旋陈玉钊张一霖吴美建张珂珂魏伟
魏雪敏, 陈秋旋, 陈玉钊, 张一霖, 吴美建, 张珂珂, 魏伟△
·论著·
敲低通过激活PI3K/AKT信号通路减轻阿尔茨海默病相关病变*
魏雪敏1, 陈秋旋1, 陈玉钊1, 张一霖1, 吴美建1,2, 张珂珂1, 魏伟1△
(1暨南大学基础医学与公共卫生学院病理生理学系,国家中医药管理局病理生理科研实验室,广东 广州 510632;2广州医科大学附属第二医院转化医学中心,广东 广州 510260)
探讨敲低代谢型谷氨酸受体5(metabotropic gultamate receptor 5,)对6月龄5xFAD小鼠β-淀粉样蛋白(amyloid β-protein, Aβ)病变、突触结构和神经炎症的影响及其潜在机制。选取2、6和12月龄的野生型(wild-type, WT)和5xFAD小鼠,用Western blot检测不同阶段小鼠海马组织中mGluR5蛋白的表达情况。取6月龄的WT、5xFAD、mGluR5和5xFAD/mGluR5小鼠脑组织,免疫荧光染色检测Aβ斑块的聚集,Western blot检测海马组织中淀粉样前体蛋白(amyloid precursor protein, APP)和p-APP蛋白水平,海马组织透射电子显微镜观察突触的超微结构,Western blot检测海马组织中突触蛋白、炎症因子和mGluR5下游磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/AKT信号通路相关蛋白的表达。(1)随着月龄的增加,5xFAD小鼠海马组织中mGluR5的表达显著增加(<0.01);(2)敲低减少了5xFAD小鼠海马区Aβ斑块,降低了APP和p-APP蛋白水平(<0.05);(3)敲低减轻了5xFAD小鼠海马的突触结构损伤,5xFAD/mGluR5小鼠突触前标志物突触小泡蛋白(synaptophysin, SYP)和突触后标志物突触后致密蛋白95(postsynaptic density protein 95, PSD95)表达显著高于5xFAD小鼠(<0.05),而树突标志物微管相关蛋白2(microtubule-associated protein 2, MAP2)和神经元标志物神经元核抗原(neuronal nuclear antigen, NeuN)表达无显著差异;(4)敲低可降低5xFAD小鼠的神经炎症反应,减少炎症因子的释放;(5)5xFAD小鼠敲低可通过激活PI3K/AKT信号通路发挥神经保护作用,还通过抑制糖原合成酶激酶3β(glycogen synthetase kinase-3β, GSK-3β)/κB抑制因子激酶(inhibitor of κB kinase, IKK)/核因子κB(nuclear factor-κB, NF-κB)炎症信号通路减轻神经炎症反应。敲低可以减轻6月龄5xFAD小鼠的Aβ病变、突触结构损伤和神经炎症,其机制可能与PI3K/AKT及其下游GSK-3β/IKK/NF-κB信号通路有关。
阿尔茨海默病;代谢型谷氨酸受体5;β-淀粉样蛋白;神经炎症;突触
阿尔茨海默病(Alzheimer disease, AD)是最常见的痴呆形式,是一种慢性进行性发展的中枢神经系统退行性疾病,表现为记忆损失,认知障碍,行为能力减退并伴有各种情绪改变等症状[1]。2021年世界阿尔茨海默病协会报告显示,全球超过8 000万人患痴呆症,预计到了2050年,患痴呆症人数将达到1.52亿。目前,中国是全球AD患者人数最多的地区,是全球增长速度最快的地区之一。AD已成为严重威胁老龄人的常见疾病,这给亲属和社会都带来了沉重的负担。细胞外β-淀粉样蛋白(amyloid β-protein, Aβ)聚集形成的老年斑和细胞内tau蛋白过度磷酸化形成的神经原纤维缠结(neurofibrillary tangles, NFTs)[2-3],以及伴随的突触功能障碍和胶质细胞增生[4],构成了AD的神经病理学特征。
谷氨酸是哺乳动物中枢神经系统中最丰富的兴奋性神经递质,调节学习记忆、突触可塑性和神经元发育。谷氨酸受体有两种类型:离子型谷氨酸受体和代谢型谷氨酸受体。离子型谷氨酸受体主要包括NMDA受体和AMPA受体,针对离子型谷氨酸受体在AD的病理生理过程中的机制已有大量的研究。其中,NMDA受体拮抗剂“美金刚”已作为AD的治疗用药,但该药物也存在一些不足,长期使用会引起记忆丧失、镇静、共济失调并且损害兴奋性突触传递[5]。而代谢型谷氨酸受体在AD发病过程中的作用仍需进一步研究。
代谢型谷氨酸受体(metabotropic gultamate receptors, mGluRs)可被分成3个亚组,包括Ⅰ组(mGluR1和mGluR5)、Ⅱ组(mGluR2和mGluR3)和Ⅲ组(mGluR4、6、7和8)。在这8个mGluRs中,mGluR5在脑皮质和海马中高度表达[6],提示其在AD等认知功能障碍相关疾病中具有重要作用。研究表明,mGluR5可以作为Aβ/细胞朊病毒蛋白(cellular prion protein, PrPc)复合物的细胞外支架,导致细胞内Ca2+的过度释放和神经毒性[7]。在AD模型小鼠中,mGluR5药物抑制可防止记忆丧失,减少Aβ相关神经病理发生[8]。综上,提示mGluR5在AD发病机制中是一个不可忽视的因素,但仍缺少证据阐明mGluR5与AD病理变化的关系。本研究主要观察mGluR5在AD模型不同阶段的表达变化,并通过敲低探讨其对AD模型小鼠Aβ病理、突触结构和神经炎症的作用,为AD的治疗提供参考资料。
材料和方法
1 实验动物
5xFAD小鼠是携带5个家族性基因突变的转基因AD模型小鼠。这一品系的小鼠具有高淀粉样前体蛋白(amyloid precursor protein, APP)表达,并伴有Aβ的加速聚集。SPF级C57BL/6背景的5xFAD小鼠,由深圳市疾病控制与研究中心馈赠;SPF级B6.129-tm1Rod/J小鼠,是C57BL/6背景的基因敲低小鼠,其缺乏(以下简称mGluR5小鼠),购自Jackson Laboratory,许可证号为:AA1119000057;SPF级C57BL/6小鼠作为野生型(wild-type, WT)对照小鼠,购自福贝斯(北京)生物科技有限公司,许可证号为SCXK(京)2019-0010;5xFAD小鼠与B6.129-tm1Rod/J小鼠杂交,通过基因鉴定获得5xFAD/mGluR5小鼠。动物饲养于暨南大学实验动物中心,自由饮水进食,室温为(22±2) ℃,相对湿度为40%~60%,光照/黑暗周期为12 h(8:00~20:00)。实验操作严格按照暨南大学实验动物伦理委员会的相关规定进行。
2 主要仪器及试剂
主要仪器:透射电子显微镜(HITACHI);智能倒置荧光显微镜(Leica)。主要试剂:鼠尾直接PCR试剂盒(Bimake);DAPI(Thermo Scientific);Alexa Flour 647荧光Ⅱ抗和Alexa Fluor 488荧光Ⅱ抗(Millipore);抗APP、p-APP、突触后致密蛋白95(postsynaptic density protein 95, PSD95)、突触小泡蛋白(synaptophysin, SYP)、微管相关蛋白2(microtubule-associated protein 2, MAP2)、神经元核抗原(neuronal nuclear antigen, NeuN)、胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)、离子钙结合接头分子1(ionized calcium-binding adaptor molecule-1, IBA-1)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素1β(interleukin-1β, IL-1β)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、PI3K P110、PI3K P85、AKT、p-AKT、糖原合成酶激酶3β(glycogen synthetase kinase-3β, GSK-3β)、p-GSK-3β、κB抑制因子激酶(inhibitor of κB kinase, IKK)、p-IKK、核因子κB(nuclear factor-κB, NF-κB) P65、p-P65及GAPDH抗体均购自Cell Signaling Technology;辣根过氧化酶标记的羊抗兔和羊抗鼠Ⅱ抗(鼎国生物科技有限公司)。
3 实验分组
为了研究不同阶段小鼠海马组织中mGluR5蛋白的表达情况,将动物分为6组:2月龄[体重(20±2.5) g]、6月龄[体重(28±2.5) g]和12月龄[体重(30±2.5) g]雄性WT或5xFAD小鼠,每组3只。动物分组遵循对照和随机的原则。
为了研究敲低对6月龄5xFAD小鼠的影响,将动物随机分为4组:WT、mGluR5、5xFAD和5xFAD/mGluR5,每组9只,体重(28±2.5) g,分别用于免疫荧光检测、透射电子显微镜制片及观察和Western blot实验,动物分组遵循对照和随机的原则。
4 实验方法
4.1基因鉴定(1)消化组织:剪小鼠鼠尾3 mm,剪碎组织,加入配好的消化液50 µL,55 ℃水浴消化30 min,消化完成后再95 ℃水浴5 min灭活蛋白酶,4 ℃离心10 min,取上清于-20 ℃保存。(2)PCR扩增:配制PCR 50 µL反应体系。反应条件为:94 ℃ 2 min;94 ℃ 30 s,54 ℃ 1 min,72 ℃ 1 min,循环36次。(3)琼脂糖凝胶电泳:提前配制好琼脂糖凝胶,PCR完成后,取出样品,每个孔10 µL点样,280 V恒压电泳,20 min。(4)用凝胶成像仪或紫外成像仪观察结果。
4.2冰冻切片小鼠经异氟烷吸入麻醉后,固定在手术台上,剪开胸腔暴露心脏,心脏灌注常温的生理盐水,观察灌流液的颜色从深红逐渐变浅直至无色透明时灌注完成;剪开小鼠脑部皮肤及硬脑膜暴露出脑组织,取出全脑组织放入4%多聚甲醛溶液中浸泡固定48 h,再分别用梯度10%、20%和30%的蔗糖溶液脱水各24 h;取出脱水完成的脑组织吸干水分,用OCT包埋,冰冻切片机提前预冷置至-20 ℃,矢状切面,切片厚度为20 μm,从海马组织出现开始连续切片,至第8张开始连续切片20张,贴片保存。
4.3免疫荧光取具有相同部位的组织切片,室温复温30 min,加入1% TritonX-100溶液室温破膜30 min,PBS洗3次,3% BSA室温封闭1 h,PBS洗3次,加入相应Ⅰ抗均匀覆盖脑片,4 ℃冰箱中孵育过夜,PBS洗3次,加入Ⅱ抗室温避光孵育1 h,PBS洗3次,加入DAPI染核5 min,PBS洗3次,滴加防淬灭剂,封片保存,显微镜下观察。
4.4透射电镜制片及观察(1)取材固定:取新鲜小鼠海马组织,迅速浸没在电镜固定液中,4 ℃固定3 h,0.1 mol/L磷酸缓冲液漂洗3次,每次15 min。(2)后固定:在1%锇酸室温固定2 h;0.1 mol/L磷酸缓冲液漂洗3次,每次15 min。(3)脱水:组织依次放入50%、70%、80%、90%、95%、100%乙醇、100%丙酮、100%丙酮溶液中进行脱水,每次15 min。(5)浸透:将组织置于丙酮∶包埋剂=1∶1,室温3 h;丙酮∶包埋剂=1∶2,室温渗透过夜;纯包埋剂,室温7 h;将纯包埋剂倒入包埋板,将样品插入包埋板后于37 ℃烤箱中过夜。(6)聚合:将组织置于60 ℃烤箱中聚合48 h。(7)切片:用超薄切片机切成60~80 nm超薄切片。(8)染色:铀铅双染色(2%醋酸铀饱和乙醇溶液,枸橼酸铅,各染色15 min),切片室温干燥过夜。(9)透射电子显微镜下观察,采集图像分析。
4.5Western blot实验取小鼠海马组织,加入500 µL裂解液充分裂解组织,将样品放入组织匀浆机中研磨5次,每次120 s,每次间隔10 s,频率60 Hz;4 ℃离心10 min,取上清液,使用BCA法检测蛋白浓度,调整蛋白浓度,加入上样缓冲液,100 ℃ 10 min后于-20 ℃保存,或直接用于Western blot实验;样品经8%、10%或12%的SDS-PAGE分离,NC膜转膜,5%脱脂牛奶室温封闭1 h,4 ℃环境下Ⅰ抗孵育过夜,TBST洗3次,每次10 min,使用相应的Ⅱ抗室温孵育1 h,TBST洗3次,每次10 min,ECL化学发光法显影,ImageJ图像分析软件测量条带灰度值。
5 统计学处理
实验数据以均数±标准差(mean±SD)表示。使用软件GraphPad Prism 9.0进行统计及图表绘制。采用Kolmogorov-Smirnov检验确定数据的正态性。两组之间比较采用检验,多组之间比较采用单因素方差分析(one-way ANOVA)和Tukey多重比较检验。以<0.05为差异有统计学意义。
结果
1 5xFAD小鼠mGluR5的表达随着年龄的增加而增加
不同月龄小鼠海马组织中mGluR5的表达如图1A所示。随着月龄的增加,mGluR5的表达呈现增加的趋势。在6月龄和12月龄时,5xFAD小鼠mGluR5的表达相较于同龄WT小鼠显著升高(<0.01)。敲低后其蛋白的表达如图1B所示。相较于WT小鼠,mGluR5小鼠mGluR5的表达显著降低(<0.01);较于5xFAD小鼠,5xFAD/mGluR5小鼠mGluR5的表达同样显著降低(<0.01)。
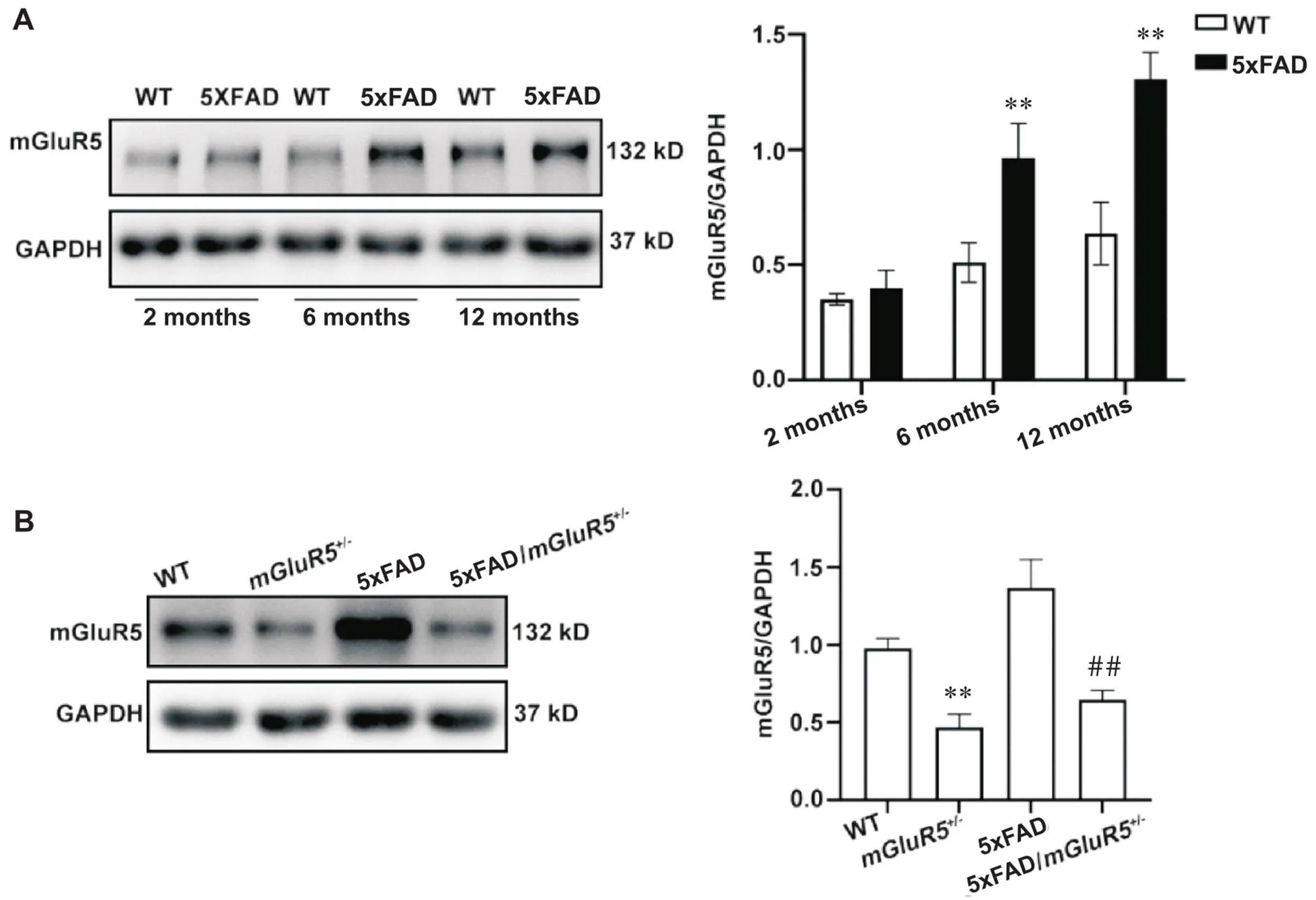
Figure 1. The expression of mGluR5 in different stages of 5xFAD mice. A: the expression of mGluR5 in the hippocampus of 2-, 6- and 12-month-old 5xFAD and WT mice; B: the expression of mGluR5 in the hippocampus of 6-month-old WT,mGluR5+/-, 5xFAD and 5xFAD/mGluR5+/- mice. Mean±SD. n=3. **P<0.01 vs WT group;##P<0.01 vs 5xFAD group.
2 敲低mGluR5减少5xFAD小鼠Aβ的聚集
敲低对5xFAD小鼠Aβ病变影响的结果如图2A所示。WT和mGluR5小鼠海马区均无Aβ的表达,但在5xFAD小鼠海马区检测到有大量Aβ斑块聚集,而5xFAD/mGluR5小鼠海马区Aβ斑块面积相较于5xFAD小鼠显著缩小(<0.01)。小鼠海马组织中APP的表达和磷酸化修饰情况如图2B所示。与5xFAD小鼠相比,5xFAD/mGluR5小鼠APP和p-APP(Thr688)的蛋白水平显著降低(<0.05)。
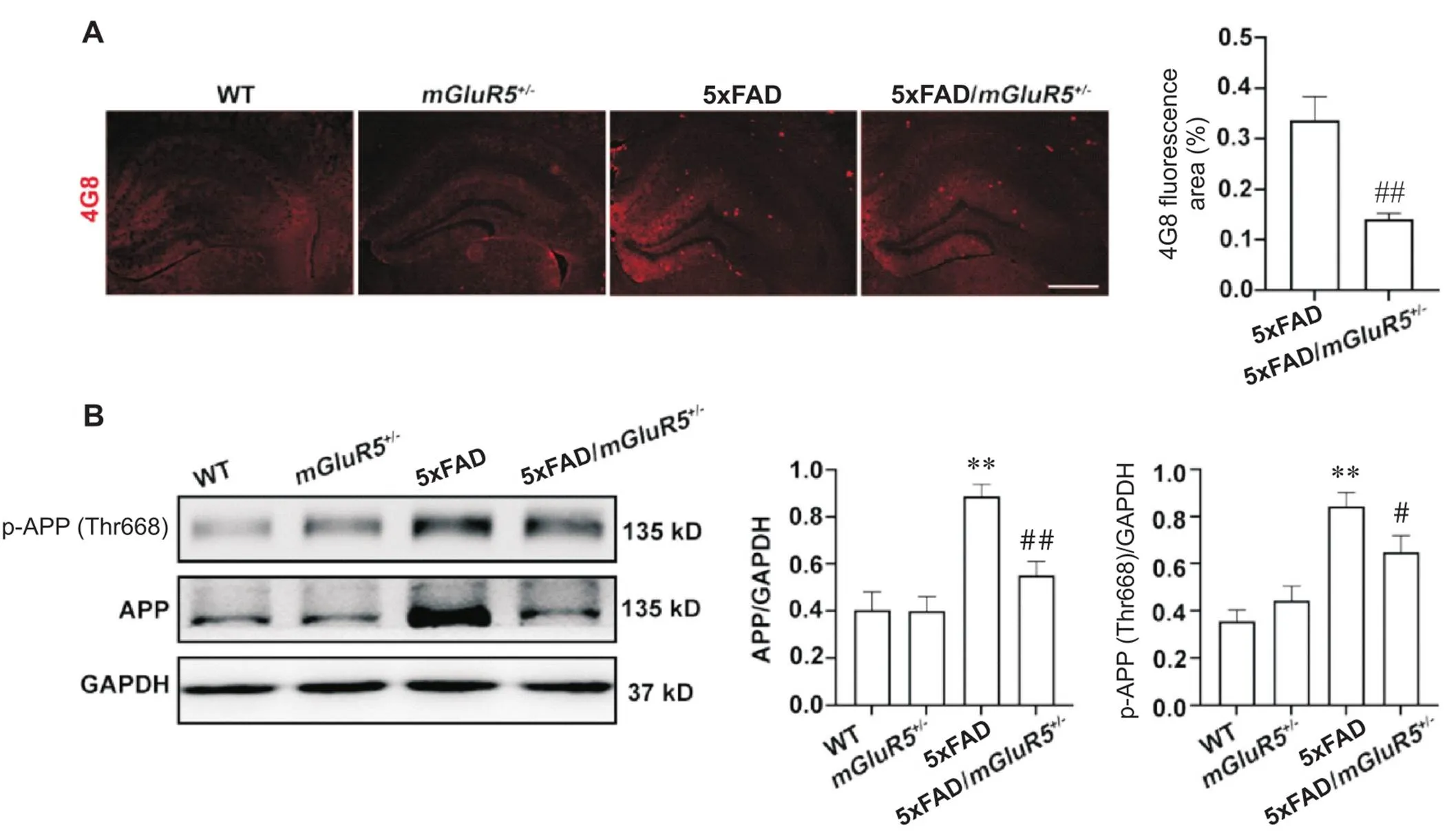
Figure 2. Knockdown of mGluR5 reduced Aβ aggregation in the hippocampus of 6-month-old 5xFAD mice. A: Aβ plaques (4G8, red) decreased in the hippocampus of 6-month-old 5xFAD/mGluR5+/- mice compared with 5xFAD mice (scale bar=250 μm); B: the protein levels of APP and p-APP (Thr688) in the hippocampus of 6-month-old WT,mGluR5+/-, 5xFAD and 5xFAD/mGluR5+/- mice. Mean±SD. n=3. **P<0.01 vs WT group;#P<0.05,##P<0.01 vs 5xFAD group.
3 敲低mGluR5改善5xFAD小鼠的突触结构
电子显微镜观察小鼠海马的突触结构如图3A所示。WT小鼠突触基本结构清晰,突触小泡丰富,前膜、后膜清晰,突触间隙宽度适中;mGluR5小鼠突触基本结构略模糊,突触小泡数量一般,前膜、后膜大部分略模糊,突触间隙宽度适中;而5xFAD小鼠突触基本结构模糊,突触小泡不丰富,前膜、后膜模糊不清,突触间隙不可见;5xFAD/mGluR5小鼠的突触结构和突触间隙均有一定程度的改善,其突触基本结构清晰,突触小泡丰富,前膜、后膜大部分清晰,突触间隙宽度适中。如图3B所示,与WT小鼠相比,5xFAD小鼠中突触前标志物SYP和突触后标志物PSD95的表达均显著降低(<0.01);与5xFAD小鼠相比,5xFAD/mGluR5小鼠SYP和PSD95的表达均显著升高(<0.05)。神经元标志物NeuN和树突标志物MAP2的表达在各组小鼠之间均无显著差异,见图3B。
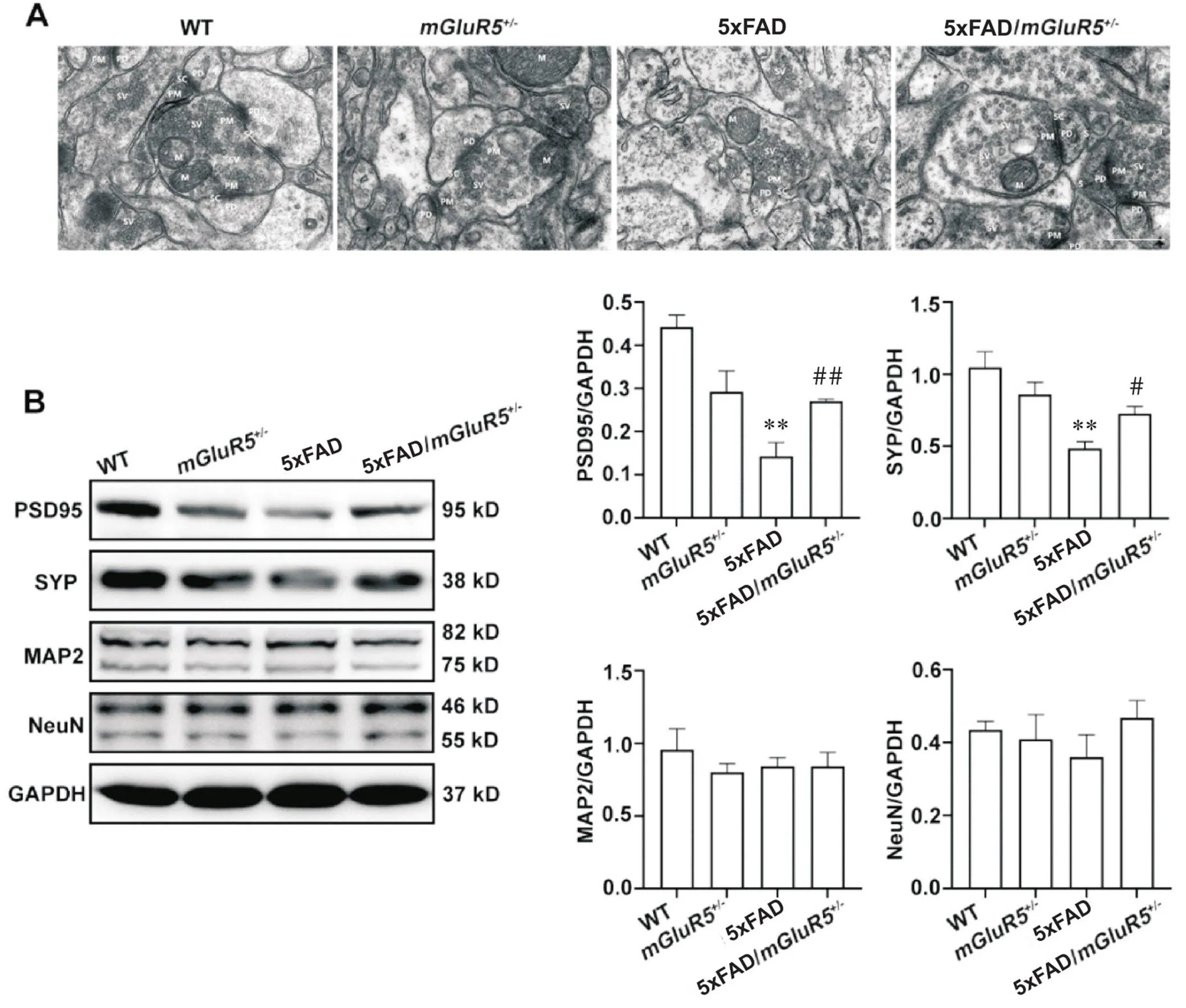
Figure 3. Knockdown of mGluR5 attenuated damage to synaptic structure in 6-month-old 5xFAD mice. A: high-magnification electron micrographs showed that the synaptic structure and the synaptic gap in 5xFAD/mGluR5+/- mice were recovered (PD: postsynaptic membrane; SC: synaptic cleft; M: mitochondria; PM: presynaptic membrane; SV: synaptic vesicles; SJ: synaptic corpuscles; scale bar=500 nm); B: the expression of PSD95, SYP, MAP2 and NeuN in the hippocampus of 6-month-old WT,mGluR5+/-, 5xFAD and 5xFAD/mGluR5+/- mice. Mean±SD. n=3. **P<0.01 vs WT group;#P<0.05,##P<0.01 vs 5xFAD group.
4 敲低mGluR5减轻5xFAD小鼠的神经炎症反应
星形胶质细胞标志物GFAP、小胶质细胞标志物IBA-1及炎症因子TNF-α和IL-1β的表达如图4A所示。与WT小鼠相比,5xFAD小鼠的GFAP、IBA-1、TNF-α和IL-1β的表达均显著升高(<0.01);然而相较于5xFAD小鼠,5xFAD/mGluR5小鼠的GFAP、IBA-1、TNF-α和IL-1β表达均显著降低(<0.05)。小鼠脑组织中GFAP的形态变化如图4B所示。相较于WT小鼠,5xFAD小鼠GFAP的荧光面积显著升高(<0.01);与5xFAD小鼠相比,5xFAD/mGluR5小鼠GFAP表达降低(<0.05)。
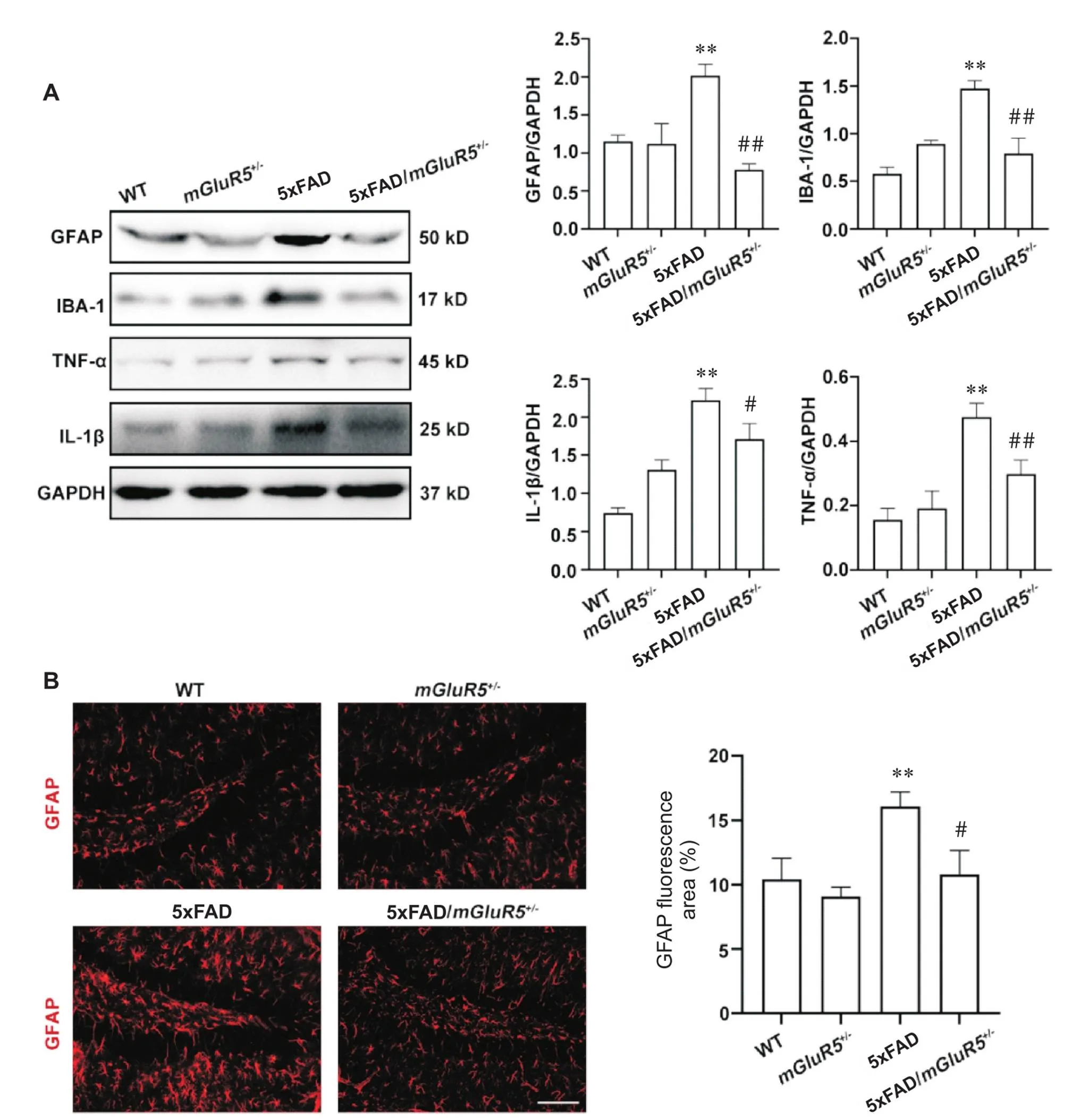
Figure 4. Knockdown of mGluR5 reduced neuroinflammation in 6-month-old 5xFAD mice. A: the expression of GFAP, IBA-1, TNF-α and IL-1β in 6-month-old WT,mGluR5+/-, 5xFAD and 5xFAD/mGluR5+/- mice; B: GFAP (red) immunofluorescence in the hippocampus of 6-month-old mice (scale bar=100 μm). Mean±SD. n=3. **P<0.05 vs WT group;#P<0.05,##P<0.01 vs 5xFAD group.
5 敲低mGluR5激活5xFAD小鼠PI3K/AKT信号通路,抑制炎症通路
mGluR5下游相关信号通路PI3K/AKT的表达和修饰如图5A所示。与5xFAD小鼠相比,5xFAD/mGluR5小鼠中PI3K调节亚基P85和AKT的磷酸化水平均显著升高(<0.01),然而PI3K催化亚基P110的表达无显著差异。GSK-3β、IKK和NF-κB P65的表达和修饰如图5B所示。与5xFAD小鼠相比,5xFAD/mGluR5小鼠p-GSK-3β (Tyr216)的蛋白水平显著降低(<0.01);与5xFAD小鼠相比,5xFAD/mGluR5小鼠p-IKK和p-P65的蛋白水平均显著降低(<0.01)。
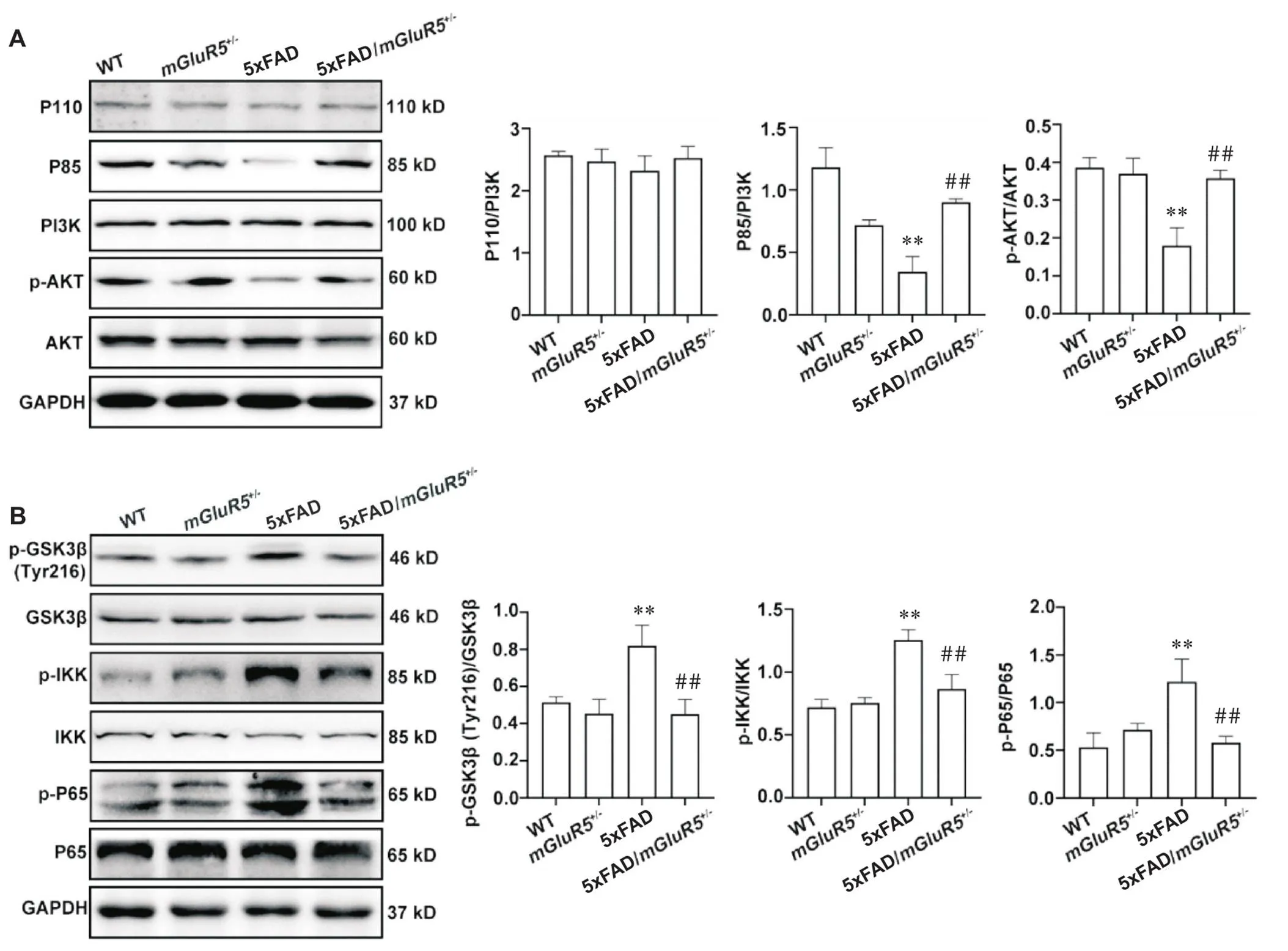
Figure 5. Knockdown of mGluR5 activated PI3K/AKT signaling pathway and inhibited inflammatory in 5xFAD mice. A: the protein levels of P110, P85, PI3K, p-AKT and AKT in the hippocampus of 6-month-old WT,mGluR5+/-,5xFAD and 5xFAD/mGluR5+/- mice; B: the protein levels of p-GSK3β, GSK3β, p-IKK, IKK, p-P65 and P65 in 6-month-old WT,mGluR5+/-,5xFAD and 5xFAD/mGluR5+/- mice. Mean±SD. n=3. **P<0.01 vs WT group;##P<0.01 vs 5xFAD group.
讨论
谷氨酸是一种兴奋性神经递质,在记忆,突触可塑性和神经元发育中起重要作用。NMDA受体拮抗剂“美金刚”已被用于中度至重度AD的治疗,但是一些副作用无法避免。mGluR5在大脑海马高表达,同时可以通过朊病毒蛋白与Aβ结合并激活细胞内FYN激酶以损害突触功能。有研究通过正电子发射断层扫描技术检测到在5xFAD小鼠中mGluR5表达增加[9],我们的实验观察到mGluR5随着5xFAD小鼠月龄的增加而呈现Aβ的聚集增加,在6月龄后表达显著高于同龄野生对照小鼠,因此本研究选取6月龄小鼠展开实验。有研究报道,的遗传缺失可以改善APP/PS1ΔE9模型小鼠的认知功能并降低Aβ斑块和Aβ寡聚体浓度[10]。但我们观察到,完全敲除会引起小鼠重度抑郁并过早死亡。因此,本研究在5xFAD模型小鼠中敲低,研究其对AD相关病理是否有影响。
APP是由100多个氨基酸组成的蛋白,存在于生物体的多种组织中。Aβ是由APP经β-分泌酶和γ-分泌酶异常水解产生的,而APP在Thr668位点的磷酸化会加速这种生成[11]。Aβ的产生增加和聚集引起的神经毒性作用会损害神经系统的正常功能,导致学习记忆和认知功能障碍[12-13]。本研究观察到,6月龄5xFAD/mGluR5小鼠海马区APP磷酸化减少,Aβ斑块显著改善。APP的磷酸化修饰受GSK3β的调节,同时GSK3β的激活会导致β-分泌酶蛋白水平增加,磷酸化的APP被β-分泌酶错误切割产生过量Aβ[14]。本研究中5xFAD小鼠敲低mGluR5后GSK3β的活性抑制是Aβ斑块减少的可能机制。
AD患者脑内比神经元损伤更严重的是突触损伤和缺失,这是AD患者认知功能下降的一个病理特征[15]。电镜观察结果显示5xFAD小鼠的突触结构严重损伤,而在敲低后突触的形态结构有很大的改善。同时,5xFAD小鼠敲低后其突触蛋白SYP和PSD95的表达增高,而神经元和树突本身并未被影响。
PI3K/AKT信号通路是一条与增殖,分化和凋亡相关的信号通路,可以响应包括胰岛素、生长因子和细胞因子等各种刺激,发挥神经保护作用[16-17]。在AD脑中,Aβ的产生和聚集降低PI3K/AKT信号的磷酸化和活性[18]。本研究检测到5xFAD/mGluR5小鼠中该条通路被有效逆转,这可能是改善神经元突触结构,发挥神经保护作用的机制。
神经炎症被认为是包括AD在内的神经退行性疾病发病机制的一部分[19-20]。神经炎症的主要参与者是星形胶质细胞和小胶质细胞[21],当它们激活后,这些细胞会产生炎症细胞因子和趋化因子,从而维持和增强炎症状况。异常的胶质细胞增生会激活NF-κB,从而产生更多的神经炎症因子导致神经退行性变和认知功能障碍[22]。本研究显示,5xFAD/mGluR5小鼠海马组织中炎症因子TNF-α和IL-1β的表达显著低于5xFAD小鼠,同时GFAP和IBA-1的表达也显著低于5xFAD小鼠。免疫荧光检测也观察到5xFAD/mGluR5小鼠相较于5xFAD小鼠,海马区GFAP的形态有所改善。这些结果表明,敲低5xFAD小鼠可以抑制胶质细胞的活化,下调炎症因子的表达,从而减轻神经炎症反应。
NF-κB是一种核转录因子,参与机体的炎症反应和免疫应答,调节细胞凋亡;IKK是NF-κB信号通路的主要调节因子,其受AKT的调控并可以激活NF-κB信号[23]。研究表明,GSK-3β可以通过IKK参与NF-κB信号通路[24],同时GSK-3β也是PI3K/AKT信号通路的下游组分,研究表明PI3K/AKT信号通路激活后,抑制GSK3β,产生抗炎反应,而GSK3β在Tyr216位点的磷酸化增加,其活性状态促进NF-κB的活化,导致炎症因子的产生[25]。本研究观察到敲低后,6月龄5xFAD小鼠PI3K/AKT信号通路激活导致GSK-3β抑制,Try216位点磷酸化减少,抑制其下游的IKK/NF-κB炎症信号通路,减少TNF-α和IL-1β等炎症因子的释放,产生抗炎反应减少神经炎症。
综上所述,敲低5xFAD小鼠可显著减轻其在6月龄时的Aβ病变、突触结构损伤及神经炎症,这可能是通过激活PI3K/AKT信号通路和抑制GSK-3β/IKK/NF-κB信号通路分别参与发挥神经保护作用和抗炎反应实现的。
[1] Iqbal K, Grundke-Iqbal I. Alzheimer's disease, a multifactorial disorder seeking multitherapies[J]. Alzheimers Dement, 2010, 6(5):420-424.
[2] Glenner GG, Wong CW. Alzheimer's disease: initial report of the purification and characterization of a novel cerebrovascular amyloid protein[J]. Biochem Biophys Res Commun, 1984, 120(3):885-890.
[3] Grundke-Iqbal I, Iqbal K, Tung YC, et al. Abnormal phosphorylation of the microtubule-associated protein τ (tau) in Alzheimer cytoskeletal pathology[J]. Proc Natl Acad Sci U S A, 1986, 83(13):4913-4917.
[4] Selkoe DJ, Hardy J. The amyloid hypothesis of Alzheimer's disease at 25years[J]. EMBO Mol Med, 2016, 8(6):595-608.
[5] Folch J, Busquets O, Ettcheto M, et al. Memantine for the treatment of dementia: areview on its current and future applications[J]. J Alzheimers Dis, 2018, 62(3):1223-1240.
[6] Daggett LP, Sacaan AI, Akong M, et al. Molecular and functional characterization of recombinant human metabotropic glutamate receptor subtype 5[J]. Neuropharmacology, 1995, 34(8):871-886.
[7] Um JW, Kaufman AC, Kostylev M, et al. Metabotropic glutamate receptor 5 is a coreceptor for Alzheimer Aβ oligomer bound to cellular prion protein[J]. Neuron, 2013, 79(5):887-902.
[8] Hamilton A, Vasefi M, Vander Tuin C, et al. Chronic pharmacological mGluR5 inhibition prevents cognitive impairment and reduces pathogenesis in an Alzheimer disease mouse model[J]. Cell Rep, 2016, 15(9):1859-1865.
[9] Lee M, Lee HJ, Jeong YJ, et al. Age dependency of mGluR5 availability in 5xFAD mice measured by PET[J]. Neurobiol Aging, 2019, 84:208-216.
[10] Hamilton A, Esseltine JL, Devries RA, et al. Metabotropic glutamate receptor 5 knockout reduces cognitive impairment and pathogenesis in a mouse model of Alzheimer's disease[J]. Mol Brain, 2014, 7:40.
[11] Beyreuther K, Masters CL. Amyloid precursor protein (APP) and βA4 amyloid in the etiology of Alzheimer's disease: precursor-product relationships in the derangement of neuronal function[J]. Brain Pathol, 1991, 1(4):241-251.
[12] Citron M. Alzheimer's disease: strategies for disease modification[J]. Nat Rev Drug Discov, 2010, 9(5):387-398.
[13] 王锋,韩柏,郭建红,等. 脑内Aβ沉积与AD模型大鼠学习记忆能力关系的研究[J]. 中国病理生理杂志, 2010, 26(3):584-586.
Wang F, Han B, Guo JH, et al. Relationship of study ability and expression of Aβ in rats brain with Alzheimer disease[J]. Chin J Pathophysiol, 2010, 26(3):584-586.
[14] Beurel E, Grieco SF, Jope RS. Glycogen synthase kinase-3 (GSK3): regulation, actions, and diseases[J]. Pharmacol Ther, 2015, 148:114-131.
[15] Davies CA, Mann DM, Sumpter PQ, et al. A quantitative morphometric analysis of the neuronal and synaptic content of the frontal and temporal cortex in patients with Alzheimer's disease[J]. J Neurol Sci, 1987, 78(2):151-164.
[16] Kumar M, Bansal N. Implications of phosphoinositide 3-kinase-Akt (PI3K-Akt) pathway in the pathogenesis of Alzheimer's disease[J]. Mol Neurobiol, 2022, 59(1):354-385.
[17] Rai SN, Dilnashin H, Birla H, et al. The role of PI3K/Akt and ERK in neurodegenerative disorders[J]. Neurotox Res, 2019, 35(3):775-795.
[18] Lee HK, Kumar P, Fu Q, et al. The insulin/Akt signaling pathway is targeted by intracellular β-amyloid[J]. Mol Biol Cell, 2009, 20(5):1533-1544.
[19] Yang QQ, Zhou JW. Neuroinflammation in the central nervous system: symphony of glial cells[J]. Glia, 2019, 67(6):1017-1035.
[20] Craft JM, Watterson DM, Van Eldik LJ. Human amyloid beta-induced neuroinflammation is an early event in neurodegeneration[J]. Glia, 2006, 53(5):484-490.
[21] O'callaghan JP, Sriram K. Glial fibrillary acidic protein and related glial proteins as biomarkers of neurotoxicity[J]. Expert Opin Drug Saf, 2005, 4(3):433-442.
[22] Provenzano F, Pérez MJ, Deleidi M. Redefining microglial identity in health and disease at single-cell resolution[J]. Trends Mol Med, 2021, 27(1):47-59.
[23] Gilmore TD. Introduction to NF-kappaB: players, pathways, perspectives[J]. Oncogene, 2006, 25(51):6680-6684.
[24] Souder DC, Anderson RM. An expanding GSK3 network: implications for aging research[J]. Geroscience, 2019, 41(4):369-382.
[25] Ko R, Lee SY. Glycogen synthase kinase 3β in Toll-like receptor signaling[J]. BMB Rep, 2016, 49(6):305-310.
knockdown attenuates Alzheimer disease-related pathology by activating PI3K/AKT signaling pathway
WEI Xue-min1, CHEN Qiu-xuan1, CHEN Yu-zhao1, ZHANG Yi-lin1, WU Mei-jian1,2, ZHANG Ke-ke1, WEI Wei1△
(1,,,,,510632,;2,,,510260,)
To explore the effects of metabotropic glutamate receptor 5 () knockdown on amyloid β-protein (Aβ) pathology, synaptic structure and neuroinflammation in 6-month-old 5xFAD mice and its underlying mechanism.Wild-type (WT) and 5xFAD mice aged 2, 6 and 12 months were selected to detect the expression of mGluR5 protein in the hippocampus by Western blot. Six-month-old WT, 5xFAD,mGluR5and 5xFAD/mGluR5mice were selected to explore the role of mGluR5 in Alzheimer disease-related pathology. The expression and aggregation of Aβ plaques were detected by immunofluorescence. The protein levels of amyloid precursor protein (APP) and p-APP in hippocampus were detected by Western blot. The ultrastructure of the synapse was observed by transmission electron microscopy. The expression levels of synaptic proteins, inflammatory factors and phosphatidylinositol 3-kinase (PI3K)/AKT signaling pathway-related proteins in hippocampus were detected by Western blot.(1) The expression of mGluR5 in the hippocampus of 5xFAD mice increased with age (<0.01). (2) Knockdown ofreduced Aβ plaques (<0.01), and decreased the protein levels of APP and p-APP in the hippocampus of 5xFAD mice(<0.05).(3) Knockdown ofattenuated synaptic structural damage in the hippocampus of 5xFAD mice. The expression levels of presynaptic marker synaptophysin (SYP) and postsynaptic marker postsynaptic density protein 95 (PSD95) in 5xFAD/mGluR5mice were significantly higher than those in 5xFAD mice (<0.05), while the expression of dendritic marker microtubule-associated protein 2 (MAP2) and neuron marker neuronal nuclear antigen (NeuN) had no statistically significant difference. (4) Knockdown ofreduced neuroinflammation in 5xFAD mice. (5) Knockdown ofin 5xFAD mice exerted neuroprotective effect by activating PI3K/AKT signaling pathway, and reduced neuroinflammation by inhibiting glycogen synthetase kinase-3β (GSK-3β)/inhibitor of κB kinase (IKK)/nuclear factor-κB (NF-κB) signaling pathway.Knockdown ofattenuated Aβ pathology, synaptic damage and neuroinflammation in 6-month-old 5xFAD mice, and its mechanism may be related to PI3K/AKT and its downstream GSK-3β/IKK/NF-κB signaling pathways.
Alzheimer disease; Metabotropic glutamate receptor 5; Amyloid β-protein; Neuroinflammation; Synapse
R749.1+6; R363
A
10.3969/j.issn.1000-4718.2022.06.001
1000-4718(2022)06-0961-09
2022-02-28
2022-05-24
国家自然科学基金资助项目(No. 81100944);广东省自然科学基金资助项目(No. 2018A030313565);广州市科技计划项目(No. 201904010040)
Tel: 020-85526259; E-mail: rocky1240@163.com
(责任编辑:李淑媛,余小慧)
