在线HPLC-DPPH指导反相液相色谱从沙棘中分离一种DPPH抑制剂
2022-07-06陈湘宏
余 松,刘 悦,袁 晨,陈湘宏,杨 芳
(1.青海大学医学院,青海 西宁 810001;2.烟台大学,山东 烟台 264005)
沙棘(HippophaerhamnoidesLinn.)作为一种药食同源植物,具有利肺止咳、利心脏血脉、开胃舒胸、活血化瘀、壮阴升阳等功效,具有很高的应用价值[1].沙棘主要生长在青海、新疆、甘肃、西藏、宁夏等16个省[2-3].据报道,沙棘在抗氧化、免疫调节、抗炎、降血糖等方面具有良好的药理活性,特别是沙棘黄酮具有良好抗氧化作用[4-8].人体在代谢过程中会产生大量的自由基,这些自由基会对细胞和组织造成氧化损伤,进而导致炎症性疾病、心血管疾病和衰老等疾病发生[9-11].而自由基抑制剂可能是预防或延缓这些疾病的重要手段.因此,从天然来源中分离出自由基抑制剂将有助于探索氧化应激与人类疾病之间的关系.本研究以DPPH自由基为靶标,采用在线HPLC-DPPH活性筛选系统,高效快速地从沙棘中快速分离纯化具有抗氧化活性的黄酮类化合物.
1 仪器与材料
1.1 主要仪器
在线HPLC-DPPH检测系统使用岛津LC10AD和LC-16两台仪器.制备型高效液相系统(江苏汉邦科技有限公司);Waters ZQ 2000质谱仪(美国沃特斯仪器公司);BrukerAvance 600 MHz 核磁共振仪(德国布鲁克仪器公司).
1.2 实验材料
DPPH购于Sigma-Aldrich(Steinheim,Germany).沙棘果实采自青海省同仁市同仁县,由青海大学杨仕兵副教授鉴定为沙棘(HippophaerhamnoidesLinn.).该标本(编号6323210517002LY)保存在青海大学药学系标本室.
2 方法
2.1 色谱条件
样品前处理色谱条件为:流动相由水和甲醇组成,0~270 min,0~100%甲醇,流速57 mL/min,检测波长210 nm.Fr4在LC16上色谱条件设置:流动相由0.1%甲酸水和甲醇组成,流速为1 mL/min,梯度洗脱为0~60 min,10%~65%甲醇.Fr4-1在LC16上色谱条件设置:流动相由0.1%甲酸水和甲醇组成,流速为1 mL/min,梯度洗脱为0~30 min,40%~90%甲醇.Fr4-1制备色谱条件:流动相由0.1%甲酸水和甲醇组成,等度洗脱为0~30 min,38%甲醇,流速19 mL/min.
2.2 提取与分离
将采集的果实经榨汁过滤,滤渣烘干后用70%乙醇采用超声提取30分钟后离心,取上清液减压浓缩干燥.取提取物60 g用甲醇溶解,将其与聚酰胺(120 g)混合,在烘箱中干燥.使用聚酰胺中压色谱柱(49×460 mm)对最终干燥的聚酰胺混合物进行前处理,得到目标馏分Fr4.使用在线HPLC-DPPH系统和ReproSil-Pur C18 AQ(4.6×250 mm,5 μm)分析柱对Fr4中的活性峰进行识别.样品溶液经岛津LC16在210 nm波长下检测后流入LC10AD并与DPPH混合.由于样品溶液中存在的自由基抑制剂对DPPH的清除作用会造成在517 nm处吸收值降低从而形成倒峰.根据文献进行优化后[12],确定LC10AD以DPPH浓度为25 μg/mL乙醇溶液为流动相,流速为0.8 mL/min.色谱数据在210 nm波长下记录,抗氧化活性数据在517 nm波长下记录.在确定Fr4中的活性峰后,使用ReproSil-Pur C18 AQ(20×250 mm,5 μm)制备柱,在汉邦制备型高效液相上对Fr4中的活性峰进行分离制备.制备色谱条件与分析条件相同,制备色谱流速19 mL/min.得到的目标馏分Fr4-1在ACE C18 Amide(4.6×250 mm,5 μm)分析柱上对其进行活性筛选.色谱数据在210 nm波长下记录.LC10AD的色谱条件与上述相同.
在确定Fr4-1中的活性峰后,采用岛津高效液相对Fr4-1制备条件进行优化.根据优化的色谱条件在汉邦制备型高效液相上对Fr4-1中活性峰进行分离制备,色谱柱为ACE C18 Amide(20×250 mm,5 μm)制备柱.Fr4-1经制备后得到Fr4-1-1.之后使用ACE C18 Amide分析柱对Fr4-1-1的纯度及自由基抑制剂活性进行验证.Fr4-1-1色谱条件与Fr4-1活性筛选条件相同.
3 结果
3.1 沙棘提取物经中压色谱的前处理
利用聚酰胺中压柱对沙棘提取物进行预处理,可以使目标成分得到较好的富集.同时,其成本低并且上样量大,可提高分离效率,使之后的分离任务更加简单.最终得到目标馏分Fr4(2.28 g).分离装置和分离色谱图如图1.
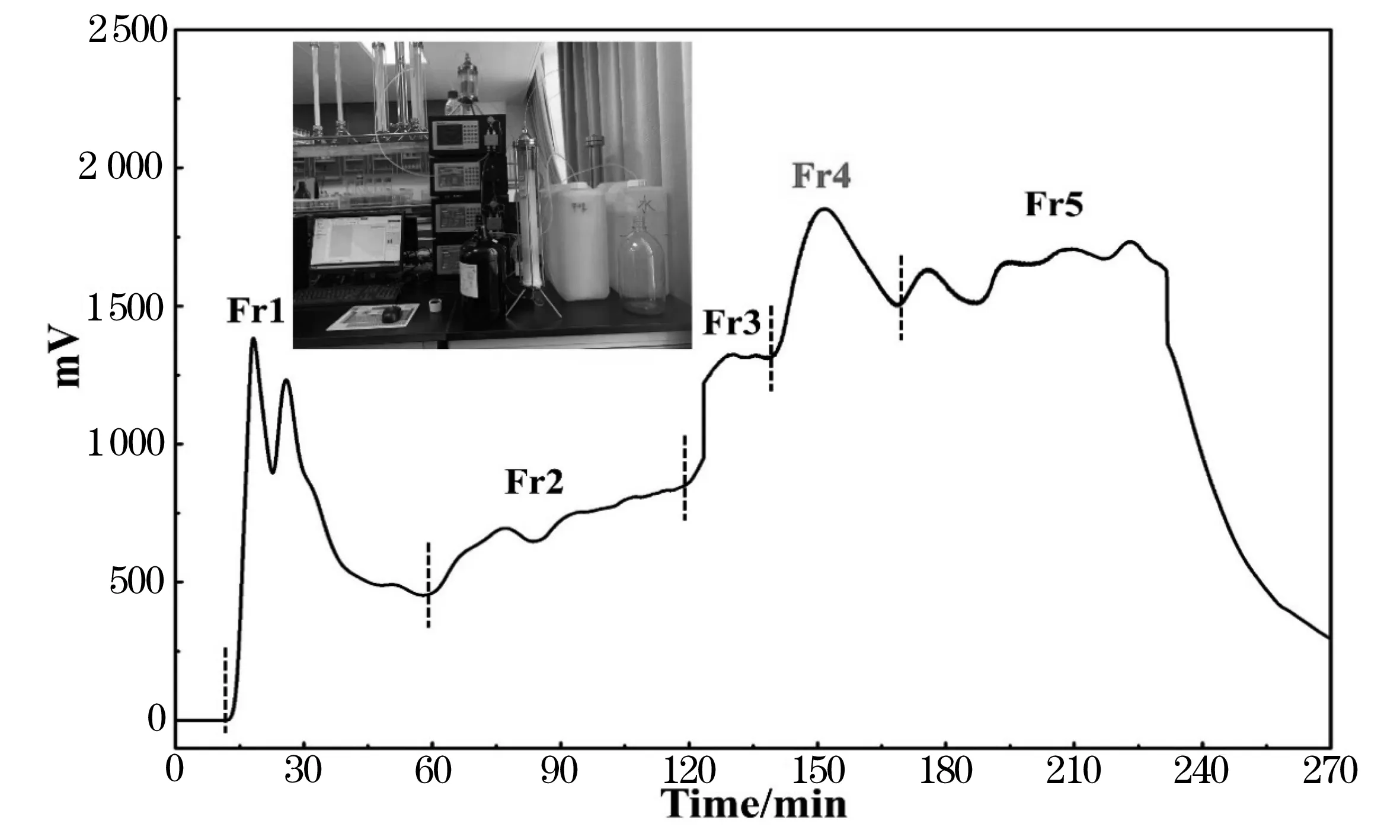
图1 中压色谱分离装置图和聚酰胺中压色谱对粗提物前处理色谱图
3.2 在线生物活性指导下的分离制备
通过在线HPLC-DPPH系统与制备型高效液相结合,从而能够准确识别并快速分离Fr4中的活性峰.其活性筛选色谱图和分离制备色谱图如图2、图3.
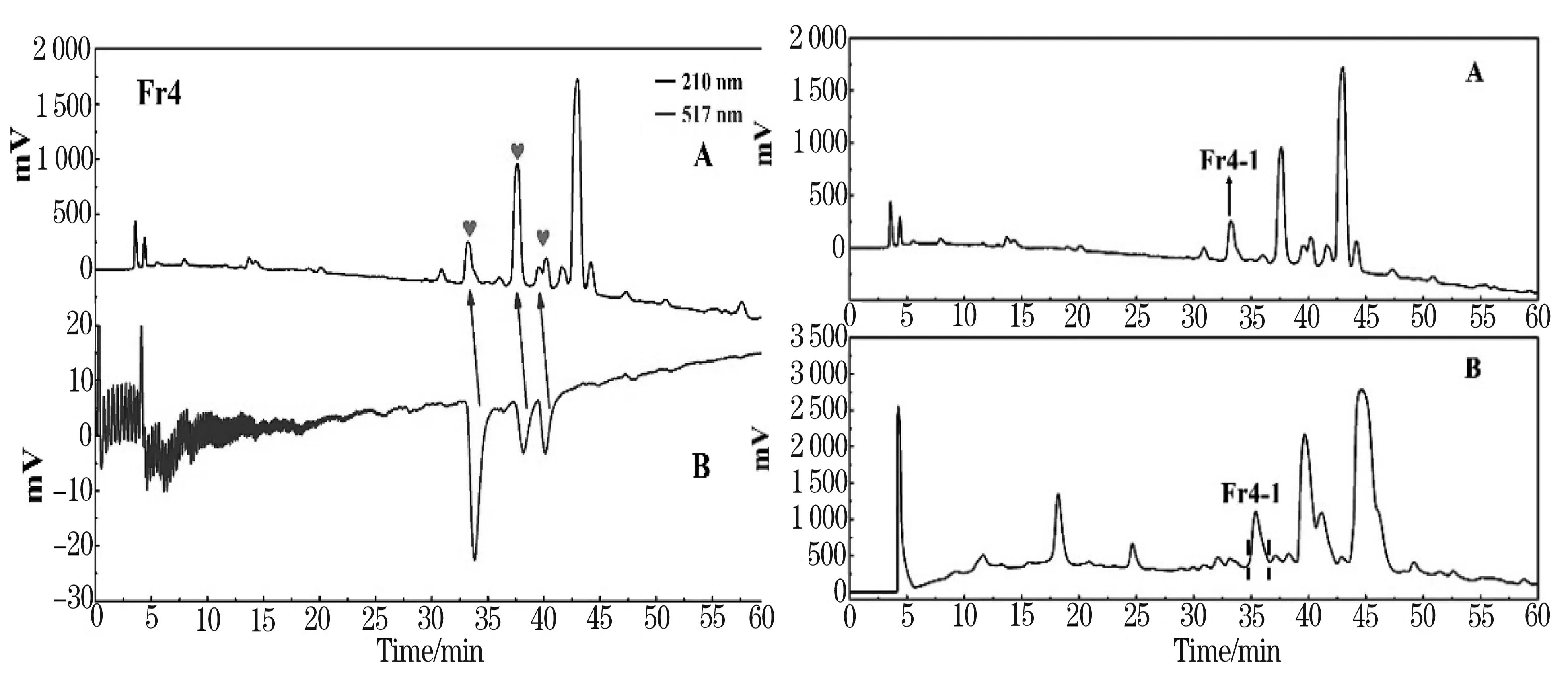
图2 A、B分别为Fr4的分析色图谱(210 nm)及自由基清除图谱(517 nm) 图3 A、B分别为Fr4的分析色谱图(210 nm)和制备色谱图(210 nm)
经过制备后得到馏分Fr4-1(65.04 mg),利用在线HPLC-DPPH筛选系统对Fr4-1活性峰进行快速识别(如图4).之后对Fr4-1制备色谱条件进行优化,并结合在线活性筛选结果将其中的活性峰分离纯化(如图5).最终得到纯度较高的DPPH抑制剂Fr4-1-1(18.06 mg).

图4 A、B分别为Fr4-1的分析图谱(210 nm)及自由基清除图谱(517 nm) 图5 A、B分别为Fr4-1的分析色谱图(210 nm)和制备色谱图(210 nm)
3.3 自由基抑制剂的纯度评估和结构鉴定
通过纯度与活性验证可知化合物Fr4-1-1的纯度大于95%,且对DPPH具有抑制作用(图6).把ESI-MS和NMR数据与文献中公布的数据进行比较,并对Fr4-1-1进行结构鉴定及波谱信息归属.

图6 A、B分别为化合物Fr4-1-1分析图谱(210 nm)及自由基清除图谱(517 nm)
化合物Fr4-1-1:黄色粉末;ESI-MSm/z:625.30 [M-H]-,分子式C27H30O17;1H-NMR (DMSO-d6,600 MHz):δH7.16 (2H,s,H-2',H-6'),6.34 (1H,d,J=2.0 Hz,H-8),6.17 (1H,d,J=2.0 Hz,H-6);3-glc:5.39 (1H,d,J=7.8 Hz,H-1''),3.73 (1H,br d,J=11.4 Hz,H-6''a);6''-rha:4.39 (1H,d,J=1.5 Hz,H-1'''),3.37 (1H,dd,J= 3.3,1.5 Hz,H-2'''),1.00 (3H,d,J= 6.2 Hz,H-6''').13C-NMR (DMSO-d6,150 MHz):δC177.3 (C-4),164.1 (C-7),161.2 (C-5),156.4 (C-9),156.3 (C-2),145.4 (C-3',C-5'),136.6 (C-4'),133.4 (C-3),120.1 (C-1'),108.5 (C-2',C-6'),103.9 (C-10),98.6 (C-6),93.4 (C-8);3-glc:100.9 (C-1''),73.9 (C-2''),76.5 (C-3''),70.0 (C-4''),76.1 (C-5''),67.1 (C-6'');6''-rha:100.7 (C-1'''),70.4 (C-2'''),70.5 (C-3'''),71.8 (C-4'''),68.2 (C-5'''),17.7 (C-6''').上述数据与文献报道一致[13],故鉴定化合物Fr4-1-1为Myricetin 3-O-rutinoside.
4 结论
本研究以在线HPLC-DPPH活性筛选系统为导向并结合反相液相色谱,进而快速高效地从沙棘中识别并分离纯化得到DPPH抑制剂.采用ESI-MS和NMR对其结构进行鉴定,为植物药理活性进一步研究和从天然产物中快速制备具有抗氧化活性的黄酮类化合物提供参考.
