剑麻叶片纤维细胞形态结构差异分析
2022-07-06黄显雅杨祥燕李菊馨彭欣怡
黄显雅 覃 旭 杨祥燕 李菊馨 彭欣怡 吴 密 金 刚 陈 涛
(广西壮族自治区亚热带作物研究所,530001,广西南宁)
剑麻(Agave sisalana)为龙舌兰科龙舌兰属多年生草本植物,是重要的硬质叶纤维作物。我国剑麻种植始于20世纪50年代初,据国家农业农村部农垦局统计,2019年我国剑麻种植面积1.87万hm2,纤维产量7.23万t,总产值达6.48亿元[1],是我国热带地区重要的经济作物之一。与其他植物纤维相比,剑麻纤维具有纤维长、质地硬、耐腐蚀、耐摩擦和拉力大等特点,在渔业、航海和工矿等领域都表现出巨大的优势和潜力。近年来,随着世界资源危机日益严重,人类环保意识增强,天然可再生纤维资源越来越受重视,剑麻纤维产业将迎来更广阔的利用空间。早期人们认为栽培技术是影响纤维品质的关键因素,但随着对植物纤维细胞发育研究的深入,人们发现从纤维发育生理学角度探索和提高植物纤维产量和质量,才是进一步改进和完善现有栽培技术的关键[2]。此后人们逐渐从探索各种自然条件和栽培措施对植物纤维产量的影响,转到深入研究植物纤维的生长发育规律及其影响因素。剑麻纤维在叶片中呈带状排布[3]。有报道[4-5]指出,剑麻纤维束是由多个不含原生质体的细胞以“Steiner树状结构”相连的中空微纤维构成。高洸等[6]在观察剑麻纤维结构时发现,剑麻纤维次生壁外层(S1)原纤的排列走向与次生壁中层(S2)不同,S2与次生壁内层(S3)的原纤排列走向也不同,说明剑麻纤维的形成是一个动态过程。剑麻纤维细胞的研究较棉花和竹子等作物滞后,目前关于剑麻纤维细胞形态和结构特征的研究鲜见报道,这制约了剑麻纤维发育细胞机制研究的进程。透射电镜(TEM)分辨率高,可直观地展示生物细胞的显微结构和亚显微结构,常应用于观察植物组织的超微结构,研究植物生命过程中细胞内部结构变化的特点与生理功能关系[7]。本研究运用透射电镜技术观察分析剑麻叶片纤维细胞形态结构特征,及确定用于研究纤维细胞发育研究的取样部位,为剑麻纤维细胞结构特征和发育规律等相关研究提供基础性和实验性的参考。
1 材料与方法
1.1 试验材料
剑麻H.11648取自广西壮族自治区亚热带作物研究所南宁剑麻试验站剑麻种植示范基地。选取定植苗(大田定植1年的剑麻种苗)和3刀麻(开割3年的剑麻)的叶片为研究对象[8]。
1.2 试验方法
1.2.1 确定剑麻叶片取样部位 标准化种植的剑麻定植苗和3刀麻的单叶长度可分别达到60和120cm,单株叶片量分别约20和100片,为确定用于纤维细胞形态观察的理想部位,需将其进行划分后再进行采样观察分析,具体划分方法见表1,示意图见图1。
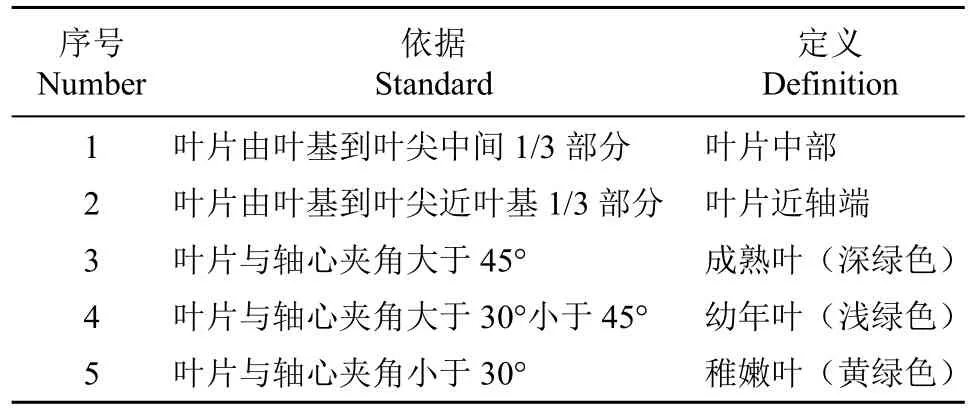
表1 剑麻叶片划分和成熟度定义取样划分Table 1 The division and maturity definition sampling division of sisal leaves
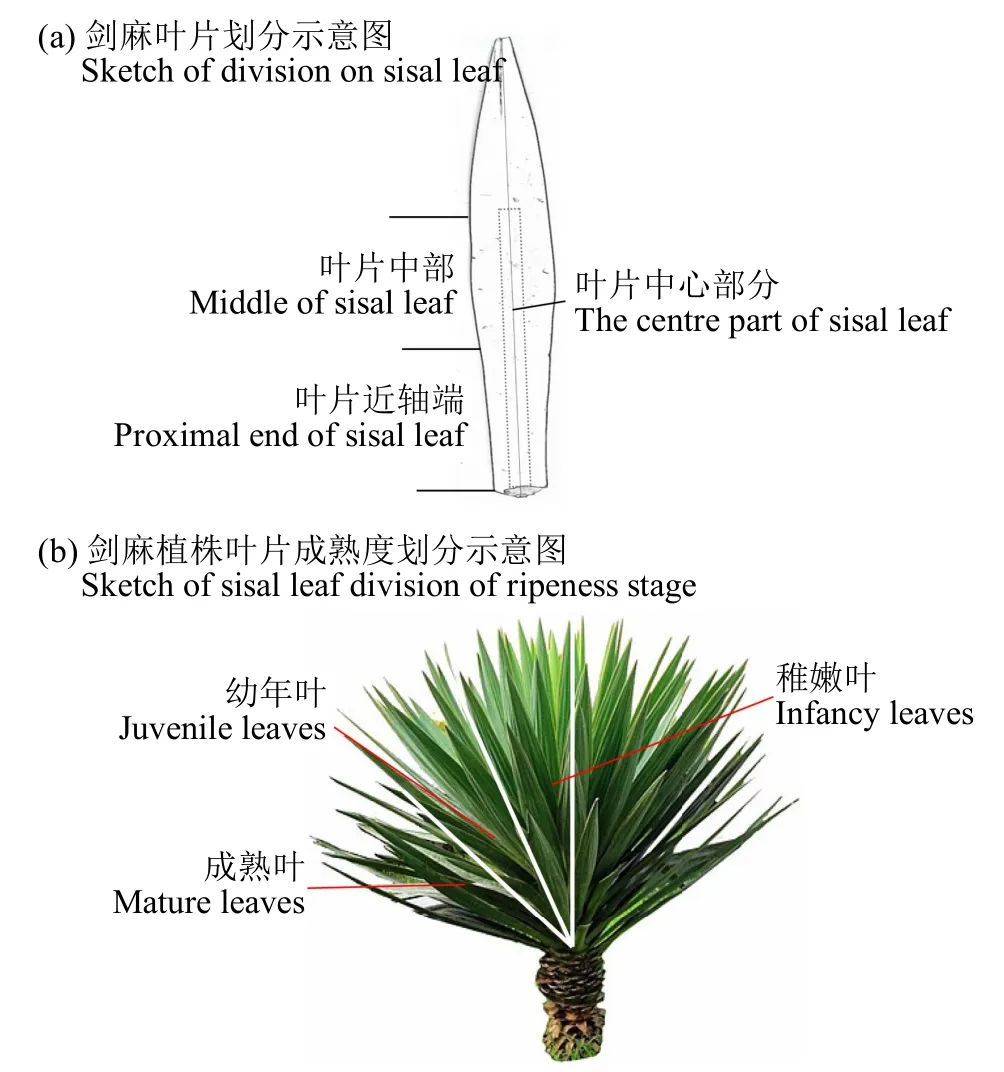
图1 剑麻叶片划分示意图Fig.1 Sketch of sisal leaf division
1.2.2 取样 剑麻叶片不同部位纤维细胞结构差异:以定植苗和3刀麻的成熟叶为研究对象,分别取叶片中部和近轴端;剑麻不同成熟阶段叶片纤维细胞结构差异:以3刀麻为研究对象,分别取成熟叶、幼年叶和稚嫩叶的叶片近轴端。取叶片中心部分,割成0.5cm×0.5cm大小的组织块,迅速置于预冷的3%戊二醛固定液中,并用真空泵抽气至样品完全沉入固定液里,进行透射电镜观察。
1.2.3 透射电镜观察 将剑麻叶片样品置于1%四氧化锇中进行再固定,然后经过丙酮逐级脱水,脱水剂浓度梯度为30%→50%→70%→80%→90%→95%→100%(100%浓度换3次)。将脱水后的样品用环氧树脂进行包埋。将渗透好的样品块放到适当模具中,灌上包埋液经过加温聚合形成固体包埋块。采用超薄切片机(徕卡)将包埋块切割成约50nm的超薄切片,漂浮于刀槽液面上,再捞至铜网。分别用醋酸铀和柠檬酸铅染色,室温条件下染色15~20min。最后用JEM-1400PLUS透射电镜(日本)进行观察。
2 结果与分析
2.1 剑麻叶片不同部位纤维细胞的结构差异
电镜下可观察定植苗叶片近轴端(图2a)细胞膜和细胞壁结构完整清晰,细胞胞浆中各细胞器均匀分布,细胞核、线粒体和内质网等结构完整清晰。3刀麻叶片近轴端(图2b)细胞膜和细胞壁结构完整清晰,与定植苗(图2a)相比细胞体积大,各种细胞器数量变少并被液泡挤压到细胞边缘。而电镜下剑麻定植苗和3刀麻的叶片中部(图2c、d)大部分是不含细胞质的细胞壁,只能观察到少量存在原生质体的细胞。由观察结果可知,与叶片中部区域的纤维细胞相比,近轴端的纤维细胞更具有 发育活力。
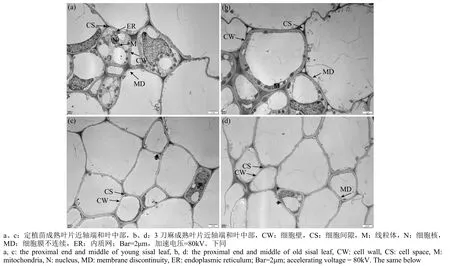
图2 剑麻定植苗和3刀麻的成熟叶片近轴端和中部的纤维束细胞透射电镜图Fig.2 Transmission electron microscopy of fiber bundle cells in the proximal end and middle of mature leaves of young and three knife sisal
2.2 剑麻不同成熟阶段叶片纤维细胞的结构差异
进一步观察了3刀麻不同成熟阶段的叶片束纤维细胞形态结构特点,发现不论叶片发育程度如何,在近轴端均能观察到含有完整原生质体的活纤维细胞(图3)。由图3可知,3个叶片成熟阶段的叶束纤维细胞中各种细胞器被液泡挤压到细胞的边缘,其中叶绿体是最突出的细胞器,有少量嗜锇颗粒分布于叶绿体表面。成熟叶(图3a~c)和幼年叶(图3d~f)的细胞壁结构完整清晰,内部细胞器均贴壁分布,细胞核以常染色质为主,叶绿体多呈梭形,外膜完整,可见较清晰的片层结构和垛叠区,在成熟叶(图3c)和幼年叶(图3f)中还分别观察到叶绿体膨胀变圆、细胞膜不连续和存在空泡的现象。与其他成熟阶段相比,稚嫩叶(图3g~i)细胞内叶绿体出现皱缩及片层结构排列较紊乱、线粒体肿胀、胞浆内出现空泡(图3g)、细胞核中异染色质增多(图3h)和质壁分离(图3i)的现象。

图3 不同成熟阶段的剑麻叶片束纤维细胞透射电镜图Fig.3 Transmission electron microscopy of fiber bundle cells at different ripeness stages of sisal leaves
3 讨论
植物细胞发育是一个典型的细胞程序性死亡过程[9],植物纤维细胞发育大致分成原始纤维细胞形成期、细胞伸长期、细胞初生壁形成期和细胞次生壁形成、增厚期[10-11],虽然相邻时期之间并没有截然区分的界线且有所重叠[12],但每个时期的纤维细胞形态结构都各有特点。早期的植物纤维细胞发育研究报道[13-14]指出,棉花的纤维细胞分化过程中细胞核和细胞质中会出现密集的电子物质,推测暗细胞可能是正在分化的纤维原始细胞,亮细胞则是非纤维原始细胞,但是竹子等多细胞纤维作物的纤维细胞起源尚不明确。当纤维细胞分化完成后,细胞会在液泡的作用下经历非极性伸长(膨胀伸长)和极性伸长[15-16],同时伴随着细胞壁的形成。初生壁形成初期细胞质中的内质网、线粒体和高尔基体等细胞器的数量都显著增多,在液泡的持续挤压下,细胞器被挤压到细胞壁内侧,此时细胞质变得稀薄,透光性增强,细胞壁开始累积木质素进入次生细胞壁形成和增厚阶段[17-19],并启动程序性死亡,且原生质体开始降解[20]。
本研究分别取2个生长时期的不同叶片区域(中部、近轴端)和3个成熟度叶片(稚嫩叶、幼年叶、成熟叶)的组织作为样品,利用TEM观察组织的细胞形态和结构差异。结果显示,叶片中部区域的细胞多为不含原生质体的细胞壁结构,表明叶片中部的纤维细胞多处于发育成熟阶段,不宜作为研究剑麻叶片纤维细胞发育结构形态差异的对象;而叶片近轴端的纤维细胞胞浆中能观察到细胞核、线粒体、叶绿体和内质网等细胞器,且细胞器被液泡挤压到细胞壁的边缘等,在其他作物表现为纤维细胞伸长期或纤维细胞初生壁形成期的特征形态,表明近轴端存在处于发育阶段的纤维细胞。在稚嫩叶近轴端细胞还观察到叶绿体皱缩及片层结构排列较紊乱,线粒体肿胀,胞浆内出现空泡,还存在细胞核中异染色质增多和质壁分离等细胞凋亡的特征,说明稚嫩叶中有处于次生壁增厚期的纤维细胞。
4 结论
综合观察结果可知,剑麻叶片中部的纤维细胞多为不含原生质体的细胞壁结构,表明该区域的纤维细胞处于发育成熟阶段,不具备观察细胞发育结构特点的条件。进一步观察不同成熟度的剑麻叶片近轴端的纤维细胞,发现存在大量含有完整原生质体的活细胞,且能观察到细胞核中异染色质增多和质壁分离等细胞凋亡的特征,表明该区域的纤维细胞仍有生长发育能力,具备观察叶纤维细胞发育细胞结构差异的条件,是观察的理想取样部位。值得注意的是,稚嫩叶中能同时观察到处于初生细胞壁形成期和次生细胞壁形成期的纤维细胞,但是纤维细胞发育活跃程度与叶片成熟程度之间的关系还需进一步研究确认。
