雷贝拉唑与莫沙必利联合用于胃食管反流治疗中的疗效分析
2022-07-06滕月英
滕月英
摘要:目的 探讨将雷贝拉唑与莫沙必利两种药物联合用于胃食管反流(GERD)患者治疗中的疗效与安全性;方法 采取随机表达的方式将86例胃食管反流患者分为联合用药组与单一用药组,单一用药组单纯口服雷贝拉唑钠肠溶片进行治疗,而联合用药组则是雷贝拉唑钠肠溶片+莫沙必利进行治疗,比较两组患者治疗前后症状积分、临床总有效率以及不良反应发生率;结果 治疗4周后,联合用药组烧心、反酸、胸骨后疼痛、反食显著低于单一用药组,临床总有效率93.02%高于单一用药组79.07%,且P<0.05,两组患者用药期间不良反应发生率无显著差异(P>0.05);结论 针对胃食管反流患者,相比于单纯口服雷贝拉唑的用药方式,将其与莫沙必利联合给药治疗后获得的疗效更显著,并且不会增加患者其他不良反应。
关键词:胃食管反流病;雷贝拉唑;莫沙必利;联合用药
【中图分类号】 R571【文献标识码】A 【文章编号】1673-9026(2022)17--01
胃食管反流病在消化内科中比较常见,指的是胃、十二指肠中的内容物反流到咽喉、食管、口腔以及呼吸道等,进而引起机体出现各种不适体征、临床表现以及并发症的疾病,在消化内科中具有较高的发生率[1]。当前,GERD已经被列入了一种全球性疾病,具有发病率高、误诊率高等特征。当前临床上治疗GERD首选保守治疗,但是若患者保守治疗无效,并且并发症严重时便需要行手术治疗[2]。口服用药作为保守治疗的最佳选择,治疗目标是降低患者反流液的PH值,促进胃排空,治疗药物以质子泵抑制剂、胃动力药物为主。但是临床研究发现,单纯应用质子泵抑制剂或者胃动力药物的疗效有限,因此临床上推荐联合应用两种药物进行治疗。近年来,我院针对胃食管反流病患者,给予雷贝拉唑与莫沙必利联合用药的方案治疗,疗效确切,详细情况介绍如下:
1.资料与方法
1.1一般资料
选取2021年1月至2021年12月这段时间在我院治疗的86例胃食管反流患者作为本研究的对象,在计算机辅助下将病例随机分为联合用药组与单一用药组,每组病例总数为43例。联合用药组:男患与女患总例数分别为23例、20例,最小年龄为20岁,最大年龄为62岁,平均年龄为(42.15±2.36)岁,最短病程为2年,最长病程为5年,平均病程为(3.15±1.23)年;单一用药组:男患与女患总例数分别为25例、18例,最小年龄为19岁,最大年龄为65岁,平均年龄为(42.18±2.31)岁,最短病程为1.5年,最长病程为6年,平均病程为(3.17±1.21)年。应用数据统计软件对两组病例的一般资料逐项统计分析,结果得出P值高于0.05,提示一般资料不具备统计学差异,存在可比性。
1.1.1纳入标准。所有病例均≥18岁;均参照2017年颁布的《中国胃食管反流病专家共识意见》中相关标准确诊,即伴有不同程度的胃灼热、反流、背部或者胸骨后疼痛不适、喘息、咳嗽、剑突下顶胀感;所有病例及其家属均对本研究知情,签署了知情同意书。
1.1.2排除标准。排除合并严重心肝肾等重要脏器病变、伴有胃食管手术史、消化性溃疡手术史、胃食管恶性病变、对雷贝拉唑与莫沙必利存在用药禁忌症、妊娠期以及哺乳期的女性。
1.2方法
單一用药组在确诊后口服雷贝拉唑钠肠溶片(生产商:卫材药业有限公司;批准文号:国药准字H20090091 )进行治疗,用法用量如下,2次/d,10mg/次;而联合用药组则是口服雷贝拉唑钠肠溶片+莫沙必利(生产商:Dainippon Sumitomo Pharma Co., Ltd.;批准文号:国药准字J20110022)进行治疗,其中雷贝拉唑钠肠溶片的用法与用量参照单一用药组,莫沙必利的用法如下:3次/d,5mg/次。两组患者均连续4周,在用药期间,提醒劳逸适当,科学作息,睡前2~3h禁止饮食,睡觉时适当将床头抬高,饮食以清淡易消化的食物为主,忌烟酒,不可食用酸甜辣、生冷、巧克力、油炸、咖啡、碳酸饮料、薄荷糖、碳酸饮料等刺激性食物,不可食用高脂饮食。提醒患者用药期间不可服用其他治疗该病的药物。
1.3观察指标
(1)对比在用药之前与用药治疗后两组病例临床症状积分,主要从烧心、反酸、胸骨后疼痛、反食四个方面进行评价,其中将无症状记作1分,将伴有轻度症状,无明显不适判定记作1分,将伴有中度症状,但是不会对日常生活产生影响记作2级;将伴有重度症状,伴有明显不适记作3分[3]。
(2)不同用药方案治疗4周后,统计两组病例的临床总有效率。关于胃食管反流病的疗效判定主要参照治疗前后症状评分进行评定,将治疗后,患者评分下降程度不低于80%判定为显效;将治疗后患者评分下降程度为50%~79%判定为有效;将治疗后患者评分下降程度低于50%判定为无效[4]。将显效率与有效率二者的总和记作总有效率。
(3)比较两组患者用药期间不良反应发生率。
1.4统计学方法
数据的统计分析以spss21.0数据统计软件开展,病例数以n表示,临床症状评分用均数(±)表示,用t检验,临床总有效率与不良反应发生率用百分数(%)表示,用x2检验,当P值低于0.05时,提示差异显著。
2.结果
2.1两组患者治疗前后各临床症状评分比较
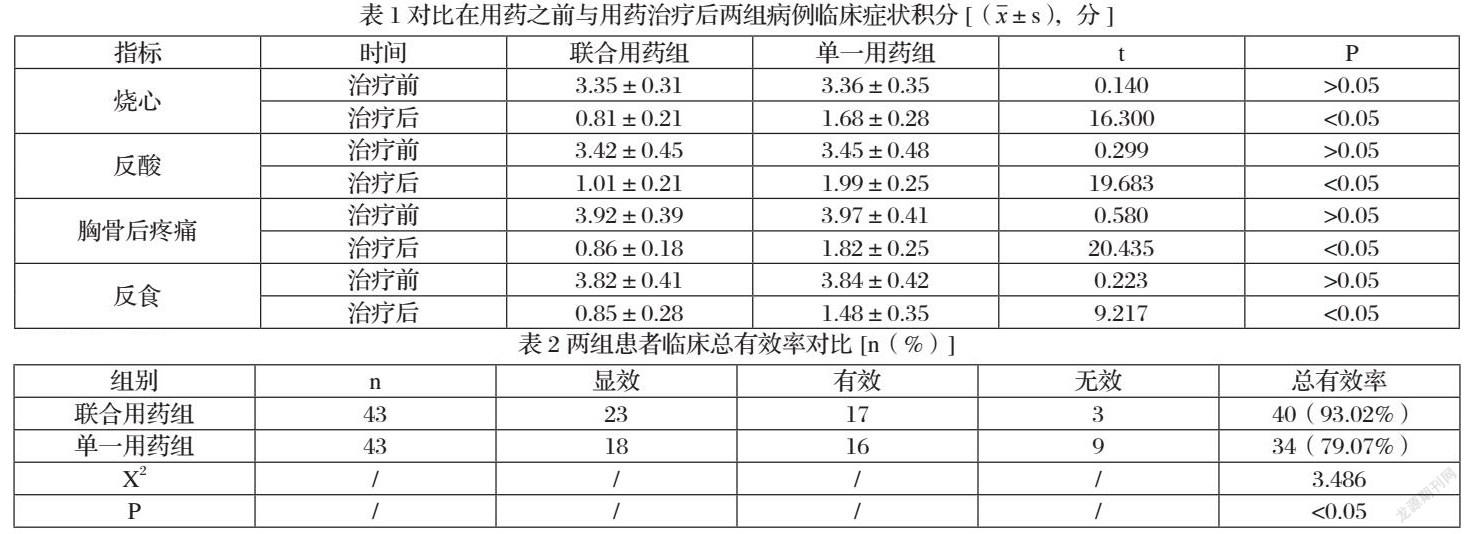
治疗前,单一用药组与联合用药组在烧心、反酸、胸骨后疼痛、反食四个方面的评分无明显差异(P>0.05),用药4周后,两组患者的临床症状评分均有所降低,但是联合用药组烧心、反酸、胸骨后疼痛、反食显著低于单一用药组,且P<0.05,见表1所示:
2.2两组患者临床总有效率对比
联合用药组临床总有效率93.02%高于单一用药组79.07%,且P<0.05,见表2所示:
2.3两组患者不良反应发生率对比
在用药期间,单一用药组有4例患者出现了不良反应,其中便秘1例、头晕2例、恶心1例,不良反应发生率为9.30%;联合用药组有3例出现了不良反应,其中便秘、头晕、恶心各1例,不良反应发生率为6.98%,可见两组患者不良反应发生率无显著差异(P>0.05)。所有不良反应症状轻微,不影响治疗,随着治疗的进行,不良反应消失。
3.讨论
GERD在临床上发病率较高,根据相关统计数据显示,其在我国的发病率约6%左右,而在欧美等国家中的发病率高达25.9%~27.8%,当前临床上治疗该病主要以内科保守治疗为主,但是若保守治疗无效或者患者伴有严重并发症时,便需要行手术治疗。当前临床上关于保守治疗主要采取综合性与个性化治疗,即在生活方式干预的基础上,抑制胃酸分泌或者中和胃酸,通过这一途径促进患者临床症状逐步消失,最终达到控制病情紧张的目的。当前临床治疗胃食管反流的首选药物为质子泵抑制剂,具有抑酸迅速、药效长等优点,但是单一用药起效慢,用药时间长,因此临床上推荐将质子泵抑制剂与促胃动力药联合使用。
在本文,分析了在胃食管反流病的治疗中单纯口服雷贝拉唑与雷贝拉唑+莫沙必利联合治疗的临床效果,结果显示:联合用药的患者治疗后在烧心、反酸、胸骨后疼痛、反食四个临床症状方面的评分显著低于单一服用雷贝拉唑治疗的患者,雷贝拉唑+莫沙必利治疗后的临床总有效率93.02%高于单一服用雷贝拉唑治疗的患者,79.07%,且P<0.05,肯定了联合用药改善患者临床症状更显著,疗效更高。其中雷贝拉唑作为第二代质子泵抑制剂的代表之一,其拥有无抗胆碱能与抗H2组胺的特性,其发挥抑制胃酸的功能主要是通过依附在胃壁细胞的表面,对H+/K+—ATP酶的活性进行抑制。与第一代质子泵抑制剂相比,第二代质子泵抑制剂的半衰期更长,抑酸作用迅速且持久。临床研究发现,经口服雷贝拉唑钠肠溶片后,药物主要在肠道中内被吸收,通常在用药后3.5h便血药浓度便可以达到最大值,最后经蕉叶或者其他代谢物排出剩余的药物。但是部分研究发现,由于胃食管反流患者食管蠕动力未得到改善,所以无法从根本上阻断胃酸反流途径,致使整体治疗效果不够理想[5]。 因此,探寻一种有效且安全的治疗方案强化胃食管反流患者的治疗效果十分必要。而莫沙必利属于一类新型肠胃促动力药物,是高选择的5-羧色胺受体激动剂,在口服后能够迅速被人体所吸收,发挥促进乙酰胆碱释放的功能,加速胃腸的蠕动。当前莫沙必利主要被应用在肠胃反流病、胃轻瘫、反流性食管炎等疾病的治疗中,在缓解腹痛、胃肠蠕动、打嗝等临床症状方面效果显著[6]。而将雷贝拉唑钠肠溶片与莫沙必利联合应用在胃食管反流的治疗中,二者发挥协同作用,在抑制胃酸的基础上,发挥促进胃肠蠕动的作用,二者共同减轻胃食管反流患者胃部反酸与消化功能不足等问题。通过对比两组患者不良反应发生率,结果显示:雷贝拉唑+莫沙必利不良反应发生率6.98%与单纯服用雷贝拉唑不良反应发生率9.30%无显著差异(P>0.05),证实在雷贝拉唑钠肠溶片治疗的基础上联合莫沙必利,不会引起患者额外的不良反应。
综上所述,针对胃食管反流患者,采取雷贝拉唑、莫沙必利两种药物联合用药的烦恼那个时,能够使患者的临床症状迅速得以缓解,并且不会导致患者额外的不良反应增加,具有较高的安全性。
参考文献:
[1]应春兰.雷贝拉唑联合莫沙必利对胃食管反流患者VIP、MOT和GAS水平的影响[J].特别健康,2021(9):105.
[2]易胜冬,李莉.莫沙必利联合雷贝拉唑在胃食管反流中的应用效果研究[J].世界复合医学,2021,7(1):178-180.
[3]臧延伟.雷贝拉唑联合莫沙必利治疗胃食管反流性咽喉炎效果分析[J].特别健康,2021(6):93.
[4]焦璐,韦虹,张娟,等.雷贝拉唑联合莫沙必利治疗老年胃食管反流患者的临床价值研究[J].海峡药学,2021,33(12):177-179.
[5]马博洋,王越.雷贝拉唑联合莫沙必利治疗老年胃食管反流的效果评价[J].中国保健营养,2021,31(36):195.
[6]李丹昱.雷贝拉唑联合莫沙必利治疗老年胃食管反流病的疗效观察[J].中国医药指南,2021,19(2):94-95.
