头花蓼对土壤中锑的累积特征及健康风险评价
2022-07-05杨爱江
胡 霞 王 丽 田 怡 刘 吉 杨爱江*
(1.贵州大学 资源与环境工程学院,喀斯特地质资源与环境教育部重点实验室,贵阳 550025;2.贵州大学 喀斯特环境生态系统教育部野外科学观测研究站,贵阳 550025;3.贵州大学 环境工程规划设计研究所,贵阳 550025;4.贵州贵安新区绿兴环保有限责任公司,贵阳 550025;5.贵州贵达元亨环保科技有限公司,贵阳 550025)
近年来,我国中药材存在大量的重金属超标问题[1],这对中药材的药用价值和国际地位造成了很大的影响,从而限制了中药的发展。研究发现,重金属在人体内会与蛋白质、核酸等有机物质结合,从而导致多器官损伤、致突变、致癌等[2-3]。由于中草药重金属超标是人类摄入重金属最主要的来源,对人类健康构成了巨大的威胁,因此研究重金属污染土壤中的中药材对重金属的吸收累积特征及含量控制尤为重要。头花蓼(PolygonumcapitatumBuch.-Ham.exD.Don)为蓼科廖属植物,是贵州常见的苗药,具有较高的药用价值和经济价值,不仅可以入药,还可供动物食用,具有清热解毒、利尿通淋、活血止痛等功效[4],民间常用其干燥全草或地上部入药。
我国拥有全球最大的锑(Sb)矿资源,其储量、产量在全球都是第一[5],但多年的锑矿开采和冶炼导致矿区污染严重,环境介质中的Sb浓度升高,土壤Sb污染问题日益严重[6]。在湖南、贵州、云南和广西等锑矿相对集中地区[7],土壤中Sb含量最高可达5 045 mg/kg[8]。并且Sb可通过食物链进入动物和人体难以排出[9],过量Sb会引发多种疾病[10]。在某些条件下,植物能大量吸收与富集Sb[11-12],有研究在锑矿山周边发现,10种蔬菜中Sb的浓度为6.65~29.31 mg/kg[13];锡矿场周围的水稻(OryzasativaL.)也被发现有大量 Sb的富集,其中水稻根部、茎叶、种子的 Sb含量分别为225.34、18.78和5.79 mg/kg[14];在对独山锑矿区进行野外调研时,发现该区广泛分布着头花蓼,其对Sb污染的土壤表现出较强的耐受性[15]。
本研究以头花蓼为实验对象,通过盆栽实验,对生长在受到不同浓度锑污染土壤中的头花蓼进行研究,分析了头花蓼各个器官对重金属Sb吸收的累积规律,并评价了受到重金属Sb污染的头花蓼对人体的危害,为有效控制头花蓼重金属污染问题、保障头花蓼药用安全提供科学依据。
1 材料与方法
1.1 实验材料
材料为头花蓼;土壤取自贵州大学西校区,土壤的基本理化指标为:pH=6.02,有机质37.90 g/kg,全N 2.02 g/kg,速效N 354.03 mg/kg,速效P 4.03 mg/kg,速效K 224.51 mg/kg,土壤Sb背景值2.18 mg/kg。以K(SbO)C4H4O6·1/2H2O为实验药剂(天津市致远化学试剂有限公司)
1.2 实验方法
对所采集的头花蓼种子进行播种、育苗。待三叶一心(30 d)后,筛选出长势好、生长稳定的头花蓼幼苗后开始进行盆栽实验。实验土壤在使用前需要在自然条件下风干后人为捣碎后剔除其中杂物,然后取少部分通过2 mm筛过滤后,对其进行基本理化指标分析;剩余土壤过5 mm筛后称重,取1.5 kg装入15 mm×15 mm的塑料桶中,将外源重金属Sb以固体的形式加入,并按0(CK)、100(T1)、200(T2)、500(T3)、1 500(T5)、1 500(T5)、2 000(T6) mg/kg的浓度梯度进行实验,每个实验组重复3次,将外源重金属 Sb完全与土壤接触1个月,在此过程中,每日浇水,搅拌,确保添加的外源 Sb与土壤完全混合。当土壤中的重金属Sb达到平衡状态后,将筛选出的头花蓼的幼苗移植到土壤中,每盆种植10株。在植物生长的过程中,要视土壤的水分情况而不定时的进行灌溉,以保证土壤的湿润,在整个生长周期中不使用化肥。100 d后采收,测定其根、茎、叶各器官的干重和重金属含量。
1.3 样品制备及测试方法
将头花蓼采收后,用去离子水冲洗,除去表层土壤及残留物,将根放入20 mmol/L的EDTA-Na2溶液中15 min,除去表面的重金属,然后用去离子水于超声波清洗机(KQ5200DB,昆山市超声仪器有限公司)中振荡3次,取出后将其分成根、茎、叶三部分,在105 ℃下杀青30 min后于60 ℃烘箱中干燥至恒重,然后用研磨碾细后过2 mm筛备用。
参考土壤农化常规分析法[16]对实验土壤进行理化性质分析测试,具体过程如下:首先用分析天平称取0.1 g(精确至0.000 1 g)土壤样品,放入聚四氟乙烯微波消解管中,然后加入6.0 mL硝酸待浸泡12 h以后,再加入2.0 mL氢氟酸在微波消解仪中消解,待样品消解完毕后取出,在电热板上赶酸后转移至容量瓶定容。采用ICP-MS法对土壤中的重金属含量进行检测[17]。
植物样品重金属Sb的总含量测试:将0.1 g(精确到0.000 1 g)的植物试样添加到微波消解管中,并加入4.0 mL硝酸和2.0 mL过氧化氢(分析纯,天津市致远化工材料有限公司),放入微波消解仪中消解。待消解完成后,将消解液转移至25 mL容量瓶,定容。利用ICP-MS法检测头花蓼中的重金属 Sb。
实验过程中均设置3个平行样和空白对照样用于质量控制。
1.4 数据处理与分析
耐性指数(Tolerance index,Ti)=处理后的生长参数/CK的生长参数,平均耐性系数为各参数的Ti均值[18](本研究以生物量作为衡量)。
生物富集系数(BCF,Bio-concentration factors)=地上部分或根系重金属浓度/土壤重金属浓度[19]。
转移系数(TF,Translocation factors)地上部分重金属浓度/根系重金属浓度[20]。
重金属迁移总量=植物重金属含量×生物量[21]。
本研究中所有实验数据均利用 Excel 2003进行处理,并通过 Origin8.5进行图形绘制、采用 DPS9.0对数据的差异性进行分析。文中图形均采用算术平均值±标准差的形式,n=3;同一植株组织在不同处理之间的差异用不同字母表示(P<0.05)。
2 结果与讨论
2.1 不同Sb处理对头花蓼生物量的影响
头花蓼的整个生长周期内没有出现植株死亡现象,除 CK、T1、T2实验组在前20 d内生长较好,其他实验组都有不同程度的影响,主要表现为头花蓼的生长缓慢且植株普遍矮小,并且这些实验组的头花蓼到40 d后叶片都出现了褶皱,失绿的现象,60 d以后,土壤中添加了外源Sb的实验组,生长的头花蓼叶片都变得扭曲、变形和皱缩。80 d以后,T5和T6实验组的头花蓼停止生长,叶片也出现了萎缩,并且逐渐脱落的现象。该现象表明,当土壤中的Sb浓度超过一定限值后会对培养的头花蓼产生毒害作用。
生物量的改变程度可用来表示植物耐受性的大小[22]。从图1和图2可以看出,随着土壤中重金属Sb浓度的增加,头花蓼各个部分的生物量和耐性系数都在不断降低。头花蓼各部分的生物量干重在不同处理组中表现出的均是叶最大,其次是茎和根,并且与对照组相比,头花蓼的平均耐性指数随着土壤中添加的外源Sb浓度的增加而降低。在T4、T5和T6三个实验组中生长的头花蓼,根部的生物量都有所降低,分别比对照组减少了21.96%、41.82%和71.07%,茎的生物量比对照组减少了26.30%、36.23%和42.86%,叶的生物量比对照组减少了19.05%、27.21%和42.06%,显著低于对照组(P<0.05)。这表示土壤重金属 Sb污染会对头花蓼生物量积累产生一定的抑制作用,并且随着土壤重金属 Sb污染浓度的增加,抑制效果也会随之加强。

图1 头花蓼在不同Sb处理下的生物量Figure 1 Biomass of Polygonum capitatum growing in Sb-spiked soils.

图2 不同Sb处理下头花蓼生物量耐性指数Figure 2 Biomass tolerance index of Polygonum capitatum growing in Sb-spiked soils.
有研究发现,在不同浓度的重金属Sb 胁迫下,会抑制玉米生物量的增长,并且随着Sb浓度的增加,玉米的生物量随之下降[23],与上述研究结果相同,本实验中Sb污染在一定程度上抑制了头花蓼的生物量的增长。另外,也有研究表明,一定范围浓度的Sb对植物的生长有促进作用,例如当土壤中Sb浓度小于500 mg/kg时能够促进向日葵的生长,但高于1 000 mg/kg则会抑制其生长,降低叶绿素含量,导致光合能力降低[24]。本实验中并未发现与上述研究结果相同的现象,这可能是由于本实验土壤中Sb主要以可溶态为主,超过了头花蓼良好生长的限度,或者与头花蓼本身的特点有关。
2.2 Sb在头花蓼体内的分布规律
从图3可以看出,头花蓼各个部位所含Sb的量均随着Sb添加量的增加而增加。虽然各个处理组之间的头花蓼根部Sb含量有显著性差异(P<0.05),但是均明显高于空白对照组;除了T1实验组之外,其余实验组头花蓼的叶、茎中所检出的Sb含量均明显高于对照组,各个实验组之间存在显著性差异(P<0.05);T6实验组中的头花蓼根、茎、叶Sb含量均达到了最高值,分别为2 343.73、218.02和341.24 mg/kg,相比在对照组中生长的头花蓼根、茎、叶Sb含量,增高了2 023.32倍、850.24倍和1 141.35倍。生长在锑矿区的头花蓼,在自然条件下从土壤中吸收的Sb主要存在于根部[15],这与本实验的结果相同,可能是因为Sb从头花蓼根部转移到地上部分的速率比较慢,也与 Sb在头花蓼体内的转运途径及效率有一定关系[25]。

图3 不同浓度Sb处理下头花蓼各部位Sb含量Figure 3 Effects of Sb treatment on the Sb concentrations in roots,stems and leavesof Polygonum capitatum.
2.3 富集与转移系数
富集系数(Bioconcentration Factors,BCF)是表达植物对重金属累积能力的一个重要指标,富集系数越高说明植物对重金属的吸收能力越强[26]。 如图4(a)所示,头花蓼根部和地上部的富集系数随着土壤中添加的Sb浓度增加表现出先增后降的趋势,并且可以看出所有实验组的头花蓼根部Sb的富集系数都远高于地上部的富集系数,其中T2处理组生长的头花蓼根部和地上部的富集系数都达到了最大值,与其他处理组相比具有显著性差异(P<0.05),之后头花蓼的富集系数逐渐减小,说明了头花蓼对Sb的抗性能力是有限的。这可能是由于头花蓼生长在高浓度的Sb污染土壤中时,能够通过减少对Sb的富集能力来防止其细胞受损[27]。根据以往的研究结果表明,矿区生长的头花蓼根部富集系数为0.128,而盆栽实验中头花蓼根部的Sb富集系数远高于这个数值[15],这可能与土壤中Sb的可利用态相关。一般来说,锑矿区周围土壤中可利用态的Sb含量是极少的[28],所以头花蓼生长在矿区时对Sb的富集能力并不高,但是在本盆栽实验中添加的外源Sb在水中易溶,因此实验用土壤中可利用态Sb较多,容易被头花蓼所吸收,从而使其根部Sb的含量增加。
植物把重金属从土壤传输至地面的能力可以用转移系数(TF)来表示,并且转移系数越大说明植物将重金属从根部向地上部分转运的能力越强[29]。如图4(b)所示,随着处理浓度的增加,不同处理组生长的头花蓼对Sb的转运系数不断减小,说明头花蓼对Sb的转移能力会随着土壤中Sb浓度的增加而逐渐降低,这也表明了头花蓼对Sb的抗性能力有一定的限度,可能是由于头花蓼在高浓度的Sb污染土壤中长时间生长时,为了减少重金属对植物地上部分的危害,通过自身抑制重金属向地上部分转移,从而缓解Sb对地上部的毒害[30]。

图4 头花蓼对Sb的富集系数与转移系数Figure 4 BCF and TF of Sb in Polygonum capitatum.
2.4 头花蓼中重金属的累积总量
从图5、6中可以看出,随着Sb浓度的增加,头花蓼的各个部位的Sb累积量均表现出先增后减的趋势,其中头花蓼各部位的Sb累积量所占百分比为:根(55.17%~59.91%)>叶(32.62%~41.70%)>茎(7.47%~14.73%)。在T5(1 500 mg/kg)实验组中,头花蓼中根、茎、叶中的Sb累积量均达到了最大值,分别为0.707 2、0.103 4和0.421 2 mg,与对照组、T1、T2、T3实验组相比具有显著差异(P<0.05),分别是对照组的1 039.76倍、477.80倍和737.60倍。头花蓼根部中Sb的累积量是其茎、叶累积量的3.14~8.00倍(平均值为6.21倍)、1.12~1.83倍(平均值为1.45倍),虽然在重金属Sb的胁迫下,头花蓼生物量大小表现为叶>茎>根,但是因为头花蓼根部的重金属含量远远高于茎部和叶部,从而导致了头花蓼根部存在大量的重金属Sb,所以食用头花蓼根部对人体的危害较大。

图5 不同浓度Sb处理下头花蓼根、茎、叶中Sb累积量Figure 5 Effects of Sb treatment on the accumulations in roots,stems and leaves of Polygonum capitatum.
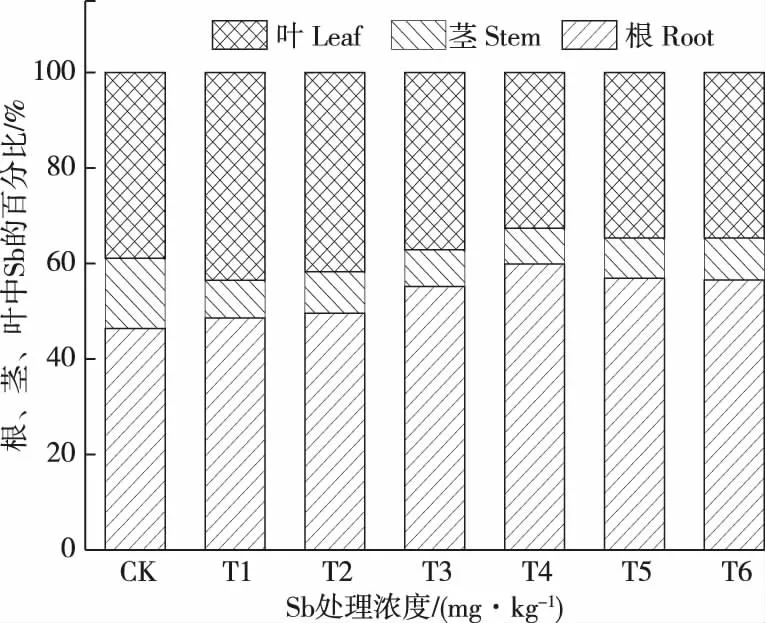
图6 不同浓度Sb处理下头花蓼体内Sb的累积分布特征Figure 6 Cumulative distribution of Sb in different tissues of Polygonum capitatum growing in Sb-spiked soils.
2.5 头花蓼中Sb对人体的健康风险评价
重金属Sb被植物的根系所吸收后在植物中不断富集,然后通过食物链进入到人体,威胁人们的健康,主要表现为损坏人体的心脏、肝脏、神经系统等[30]。关于如何控制头花蓼中重金属Sb,《贵州省中药材民族药材质量标准》和《中国药典》(CHP)并没有提及,也并未提出关于Sb浓度的限量要求,因此,本研究参照了《美国药典》(USP)中对Sb的限制含量(2 mg/kg)及允许日暴露量(PED)(20 μg/d)。按照药材-准-药智所显示的数据,头花蓼的日摄入量最多为30 g(干重),根据此剂量计算出头花蓼中Sb的暴露量,将其与《美国药典》规定的允许日暴露量值相比较,可以得到安全边缘系数MOS(Margins of safety)。如果安全边缘系数≥1时,则所诉物质对摄入的安全风险是在可以接受的范围的;但是,若安全边缘系数<1时,则该物质对摄入的安全风险将会超过人体可承受的限度,需要采取相应的风险管理措施[31],表1给出了计算结果。随着对土壤施加Sb处理浓度不断增加,头花蓼各个部位的重金属Sb日暴露量明显增高,MOS降低,说明种植在高浓度土壤中,头花蓼对人体的健康风险增大。

表1 不同浓度Sb处理下头花蓼各部位Sb日暴露量及MOS值
如图7所示,将头花蓼各个部位的Sb日暴露剂量(y)与相应的土壤中所含重金属Sb浓度(x)进行拟合,再根据《美国药典》的标准,算出头花蓼可安全食用时土壤中对应的Sb含量。结果表明,如果需要将头花蓼的根、茎、叶单独入药,则其所对应的土壤中Sb含量分别为2.09、8.72、6.41 mg/kg,才能达到该标准的要求。当种植头花蓼土壤Sb浓度小于2.09 mg/kg的情况下,食用头花蓼各个部位均没有风险;当种植头花蓼土壤Sb浓度在2.08~6.41 mg/kg之间时,除头花蓼根部外都可安全食用;当种植头花蓼土壤中Sb浓度在6.41~8.72 mg/kg时,头花蓼的根部和叶不能安全食用;当种植头花蓼的土壤Sb浓度高于8.72 mg/kg时,所有头花蓼的部位都不能安全食用。所以不宜在Sb含量高于8.72 mg/kg的土壤中,种植具有药用价值的头花蓼。

图7 不同浓度Sb处理下头花蓼各部位日暴露剂量曲线拟合模型Figure 7 Daily exposure dose in different tissues models of Polygonum capitatum under different Sb concentrations.
3 结论
随着土壤中Sb浓度的增加,头花蓼各个部位的生物量出现了下降的趋势。除了对照组以外,其余实验组在60 d后,均不同程度地受到了重金属Sb的影响,并且头花蓼叶片表现出了扭曲、皱缩现象。同时,随着土壤中添加的Sb浓度升高,头花蓼各个器官中重金属Sb的含量都在不断升高,其中根部的重金属含量最高,其次是叶和茎,而头花蓼对重金属Sb的富集系数则是表现出先增加后降低的趋势,并且在Sb处理浓度达200 mg/kg时,头花蓼的根部和地上部的富集系数均升到了最高值,分别为1.76和0.36;头花蓼对Sb的转运系数为0.13~0.24(平均值为0.18)说明头花蓼不易将Sb从根部向地上部转移。结果表明,头花蓼根、茎、叶可安全食用的土壤Sb浓度限值分别为2.09、8.72、6.41 mg/kg;当土壤Sb浓度高于8.72 mg/kg时,头花蓼的各部位在食用时都存在一定的安全隐患。
