猪圆环病毒2型病毒样颗粒和塞内卡病毒灭活二联疫苗免疫效力实验
2022-07-05段卫同王海伟孙明霞王尚辉蔡雪辉涂亚斌
段卫同,王海伟,孙明霞,王尚辉,王 刚,于 力,蔡雪辉,涂亚斌
(中国农业科学院哈尔滨兽医研究所,黑龙江 哈尔滨 150069)
猪圆环病毒2 型(Porcine circovirus type 2,PCV2)感染可引起猪的断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎肾病综合征(PDNS)、猪呼吸道综合征(PRDC)、仔猪先天性震颤(CT)、圆环病毒相关性肠炎等,给全球养猪业造成重大的经济损失[1]。PCV2主要侵害猪的免疫系统,降低免疫力,进而产生免疫抑制,常与其他病原体混合感染[2]。目前针对猪PCV2 感染仍缺少行之有效的治疗方案,疫苗免疫已被证明是最有效的防控手段。大量研究表明,PCV2 ORF2 基因编码的Cap 蛋白包含重要的病毒中和抗原表位,其能够诱导机体产生保护性免疫应答。此外,Cap 蛋白是病毒的主要结构蛋白,在体外能够自组 装 成 病 毒 样 颗 粒(Virus-like particles,VLP)[3]。VLP 具有与天然病毒完全一致的形态结构,由于缺乏DNA 或RNA 等遗传物质,因此不具有感染性,但其能够诱导机体产生体液免疫和细胞免疫反应,从而产生有效的免疫保护[4]。目前,已有的商品化疫苗中由PCV2 Cap 蛋白自组装而成的基因工程亚单位疫苗(PCV2-VLP)与PCV2 灭活疫苗相比,前者具有更好的免疫保护作用[5]。
塞内卡病毒(Seneca valley virus,SVV)又被称为A 型塞内卡病毒(Seneca virus A,SVA)。 2002 年美国研究人员首次在污染的人胚胎视网膜细胞(PER.C6)中分离出该病毒,将其命名为SVV-001[6]。2015年,我国首次在广东省某猪场检测并分离到SVV,命名为CH-01-2015,此后陆续在湖北、辽宁、河南、上海、福建、黑龙江和甘肃等省份检测到SVV[7]。SVV 感染引起的临床症状与猪口蹄疫、猪水疱病以及水疱性口炎临床症状极为相似,急性感染期主要表现为鼻镜、口腔、舌、蹄冠等部位皮肤或者黏膜出现水疱,轻者表现为发热、嗜睡、厌食等临床症状,重者死亡[8]。目前, SVV 虽不像口蹄疫病毒(FMDV)一样能够引起公共卫生危害和造成巨大的经济损失,但随着对SVV 研究的不断深入,其对宿主的致病性和流行的规模性已呈现逐渐增强趋势[9]。但到目前为止我国临床上尚无可用的商品化SVV 疫苗,这不利于我国对该病原感染的防控。
基于此,本研究将PCV2-VLP 亚单位疫苗和SVV灭活疫苗混合制成二联疫苗,进行仔猪的免疫保护试验,评价该二联疫苗的免疫效力,为PCV2 和SVV二联疫苗的研发提供参考依据。
1 材料与方法
1.1 主要实验材料PCV2、SVV、PAM 细胞、BHK-21 细胞均由中国农业科学院哈尔滨兽医研究所鉴定、制备、保存;PCV2-VLP 及SVV 全病毒二联灭活疫苗(批号为2020001)、PCV2-VLP 疫苗及SVV灭活疫苗均由中国农业科学院哈尔滨兽医研究所制备;PCV2-dCap-ELISA 抗体检测试剂盒购自北京金诺百泰生物技术有限公司;ISA201 佐剂购自赛彼科(上海)特殊化学品有限公司。21 日龄~28 日龄健康仔猪(PCV2、SVV 抗原抗体阴性猪),由中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.2 实验设计将21 日龄~28 日龄健康仔猪35 头,随机分为7 组,每组5 头,其中阴性对照组1 组;攻毒对照组两组,分别感染PCV2、SVV;其他4 组为免疫攻毒组,各组仔猪采用相应的疫苗按照1 mL/头接种,14 d 后加强免疫一次,对照组接种灭菌生理盐水,1 mL/头。所有仔猪均于相同条件下隔离饲养(表1)。
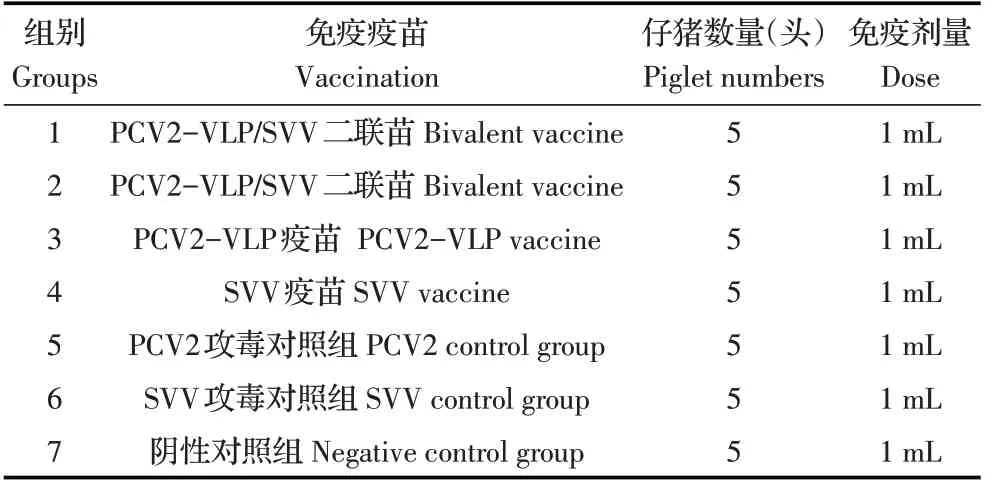
表1 免疫接种试验方案Table 1 Immunization program
1.3 各组猪血清PCV2抗体的ELISA检测在首免后14 d、21 d、28 d、35 d分别对各实验组仔猪采血,分离血清,采用PCV2抗体检测试剂盒检测各组仔猪血清中PCV2 抗体水平。实验有效性判定标准为:阳性对照OD450nm平均值>0.4,阴性对照OD450nm平均值<0.3。判定标准:S/P值≥0.4判为阳性;S/P值<0.4判为阴性;0.3≤S/P值<0.4判为可疑。S/P=[(样品OD450nm值-阴性OD450nm均值)/(阳性OD450nm均值-阴性OD450nm均值)]。
1.4 各组猪血清SVV 中和抗体检测在首免后7 d、14 d、21 d、28 d 分别对各实验组仔猪采血,分离血清并作2倍倍比稀释(21~28)后,分别与等量200 TCID50的SVV 孵育。选用BHK-21 细胞为感染细胞,采用Reed 和Muench 两氏法计算细胞病变(CPE)数,以50%细胞孔不产生CPE 的血清稀释度为该份血清的中和抗体效价。
1.5 PCV2 攻毒试验二免后14 d(首免后28 d),1、3、5 组仔猪用PCV2 强毒攻毒,每头滴鼻2 mL,肌肉注射2 mL(105TCID50/mL)。攻毒后连续观察28 d后迫杀,采集肺脏,以鼠抗PCV2-Cap 蛋白(1∶10)为一抗,HRB 标记的兔抗鼠IgG(1∶10)为二抗,采用免疫组织化学(IHC)检测PCV2 抗原,根据体温、平均日增重和IHC PCV2 抗原检测结果综合判定结果。仔猪发病判定指标如下:a、体温升高(≥40 ℃),持续3 d以上;b、免疫组仔猪平均日增重高于攻毒对照组(P<0.05),日增重=(攻毒后第28 d体重-攻毒首日体重)/28,免疫组与阴性对照组间平均日增重差异显著即判为发病;c、IHC检测肺部PCV2抗原;上述3项指标符合任意2 项即判定为发病。阴性对照组仔猪应全部正常、攻毒对照组仔猪至少4 头发病、疫苗免疫仔猪至少4头正常,即可以认为实验结果合理可靠。
1.6 SVV攻毒试验二免后14 d(首免后28 d),第2、4、6 组仔猪用SVV 强毒攻毒,每头滴鼻2 mL,肌肉注射2 mL(109.5TCID50/mL)。攻毒后每天观察临床症状,以鼻镜、口腔、舌、蹄冠等部位皮肤或者黏膜出现典型的水疱症状即判为发病。阴性对照组仔猪应全部正常、攻毒对照组仔猪至少4 头发病、疫苗免疫组仔猪至少4 头正常,即可以认为实验结果合理可靠。
2 结 果
2.1 PCV2 特异性抗体检测结果将二联疫苗和PCV2 单苗免疫仔猪后每周采血分离血清,利用间接ELISA检测仔猪血清中PCV2 Cap蛋白特异性抗体,结果显示:首免后14 d,PCV2-VLP 单苗及二联疫苗免疫组仔猪均能检测到PCV2 特异性抗体;首免后21 d这两组猪的抗体均为阳性,并且随着免疫时间延长抗体效价持续上升,35 d 达到最高值(OD450nm=1.52);单苗免疫组PCV2 特异性抗体高于二联疫苗免疫组,但二者无显著差异(P>0.05);阴性对照组仔猪PCV2 特异性抗体无明显上升趋势,全部为阴性(图1)。表明二联疫苗及PCV2-VLP 单苗均能够诱导机体产生较高水平的PCV2特异性抗体。

图1 免疫仔猪血清PCV2抗体检测结果Fig.1 The results of PCV2 antibody detection in serum
2.2 SVV 中和抗体的测定结果将二联疫苗和SVV单苗免疫仔猪后每周采血分离血清,检测免疫后仔猪血清中的SVV 中和抗体。结果显示:二联疫苗免疫组与SVV单苗免疫组仔猪SVV中和抗体效价相当,首免后14 d各免疫组仔猪SVV中和抗体效价达到1∶50以上,并且随着免疫时间延长中和抗体效价持续上升,28 d 达到峰值(1∶204);单苗免疫组SVV 中和性抗体高于二联疫苗免疫组,但二者无显著差异(P>0.05);PBS 对照组仔猪SVV 中和抗体检测结果均为阴性(图2)。表明二联疫苗在刺激机体产生SVV 中和抗体能力方面与SVV 单苗相当。
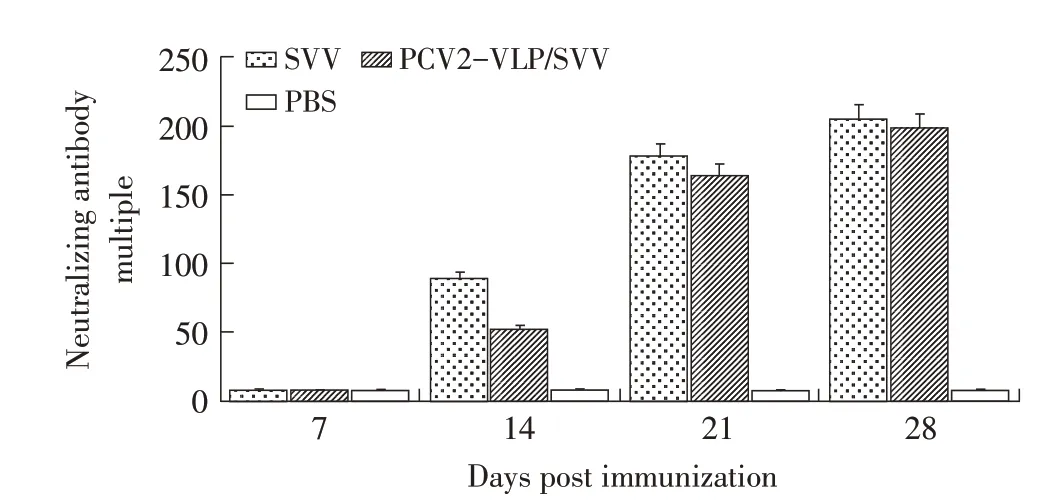
图2 免疫仔猪血清SVV中和抗体测定结果Fig.2 The results of SVV neutralizing antibody detection
2.3 PCV2 攻毒试验结果首免后28 d 对1、3、5组PCV2 攻毒后仔猪体温、平均日增重和PCV2 抗原进行检测,结果显示二联疫苗组和PCV2 单苗组均有1 头仔猪连续3 d 以上体温≥40 ℃,并且IHC 结果为阳性;PCV2 攻毒对照组有4 头仔猪连续3 d 以上体温≥40 ℃,并且IHC 结果为阳性;PCV2 单苗免疫组平均日增重与阴性对照组相当,但显著高于二联疫苗组和PCV2 攻毒对照组(P<0.05)。二联疫苗组和PCV2 单苗组对仔猪的免疫保护率均为80%,详细结果见表2。表明二联疫苗与PCV2-VLP 单苗对仔猪PCV2 感染均能够提供相同效果的免疫保护。

表2 PCV2攻毒试验结果Table 2 PCV2 challenge protection efficacy
2.4 SVV 攻毒试验结果首免后28 d 对第2、4、6组仔猪进行SVV 强毒攻毒,观察各组仔猪临床症状,结果显示,攻毒对照组在攻毒后7 d 所有仔猪蹄部均出现典型的水泡样症状,攻毒14 d 后攻毒对照组仔猪蹄部损伤部位出现结痂;二联疫苗免疫组及SVV 单苗疫苗免疫组攻毒后所有仔猪蹄部均无任何病变(图3)。表明二联疫苗及SVV 单苗免疫仔猪均能对SVV 感染提供良好的免疫保护效力。
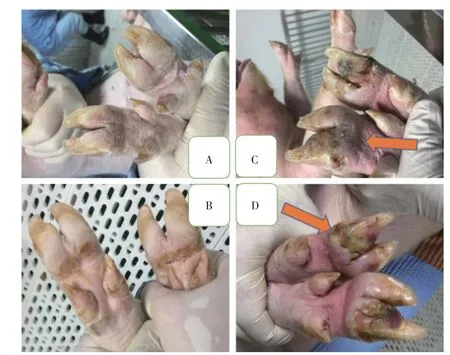
图3 SVV攻毒试验结果Fig.3 SVV challenge protection efficacy
3 讨 论
目前针对PCV2 的VLP 疫苗免疫效果已在临床中得到了验证[10]。有研究表明,PCV2 Cap 蛋白自组装而成的基因工程亚单位疫苗(PCV2-VLP)与PCV2灭活疫苗相比,前者具有更好的免疫保护作用[5]。SVV 是近年在多个国家出现的一种跨境传播病毒,可导致典型的水疱型临床症状,已对多国养猪业造成了不同程度的影响。本研究首次研制了PCV2-VLP和SVV 全病毒灭活二联疫苗,仔猪免疫实验结果证明,该二联疫苗可以有效地刺激机体产生针对这两种病原体的抗体,为二联疫苗研发提供参考依据。
为了在仔猪上评价PCV2-VLP 和SVV 全病毒灭活二联疫苗免疫效果,本研究通过筛选获得PCV2 抗体、SVV 抗体、PCV2 抗原和SVV 抗原均为阴性的健康仔猪,在排除可能影响疫苗免疫效果的外源病原干扰的情况下进行二联疫苗免疫效果评价。
本研究中PCV2-VLP 的免疫原性通过检测PCV2特异性抗体水平进行评价,SVV 灭活苗的免疫原性通过检测SVV 中和抗体效价进行评价,结果显示免疫14 d 后即可检测到PCV2 特异性抗体和SVV 中和抗体,并且随着免疫时间的延长,PCV2 特异性抗体及SVV 中和抗体水平持续上升,而且二联疫苗免疫组中无论PCV2 特异性抗体还是SVV 中和抗体水平均与各自单苗组相当。Koinig 等通过对PCV2-VLP 免疫动物研究发现,其免疫动物后不仅能诱导机体产生特异性抗体,还能诱导机体产生IFN-γ 和TNF-α 的T细胞反应,免疫效果优于灭活疫苗[11]。本研究利用PCV2-VLP 制备的二联疫苗具有良好的免疫原性,并且刺激仔猪产生PCV2 特异性抗体及SVV 中和抗体能力与单独使用PCV2-VLP 疫苗和SVV 全病毒灭活疫苗免疫效果相当。
本研究采用攻毒方法评价PCV2-VLP 和SVV 全病毒灭活二联疫苗的免疫效力,该二联疫苗与PCV2-VLP 疫苗和SVV 全病毒灭活疫苗免疫保护效力相当,对PCV2 的感染达到80%的保护率,对SVV 的感染达到100%的保护率,这与相关研究一致[12]。
综上所述,本研究首次制备的PCV2-VLP 和SVV全病毒灭活二联疫苗效果显著,具有良好的免疫保护作用,为二联疫苗的设计和研发提供了新思路。
