解冻方式对羊肉品质及微观结构的影响
2022-07-05孙佳宁朱明睿刘广娟邢世均黄金鑫王子荣
张 莉 孙佳宁 朱明睿 刘广娟 邢世均 黄金鑫 张 英 王子荣
(新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830000)
我国是肉类生产与消费第一大国。据预测,到2025年肉品年消费量将达到1亿吨[1]。冷冻作为一种应用方便、安全可靠的食品保藏方法,能够有效延长货架期,被广泛应用于肉制品的流通与销售过程中[2]。但肌肉经冷冻、冻藏及解冻后营养物质会随汁液流失,色泽、质地及口味均受到较大影响[3],品质劣变严重,因此,筛选能够延缓肌肉劣变以保持解冻肉品质且经济适用的解冻技术对肉类工业生产具有重大意义。
冷冻肉品常用的解冻方法有室温空气解冻、静水解冻、冷藏解冻及微波解冻等。室温空气解冻是目前使用最广泛的方法,具有操作简单、成本低廉的优点,但解冻耗时长、肉品易氧化、新鲜度较差[4];静水解冻速度略快于室温空气解冻,但易造成营养物质流失、肉品质地变软等问题[5];冷藏解冻具有较低的温度,能够有效抑制微生物生长繁殖,肉品具有较好的新鲜度,但解冻时间较长,能耗成本大[6];微波解冻温度高、效率快,但受热不均匀,易出现部分“熟化”[7]。靳青青等[8]采取热水解冻、冷水解冻、空气解冻和微波解冻对冻结猪肉进行解冻,发现经微波解冻后的猪肉表面色泽、pH值及肉汁液损失率等指标均优于其他解冻方式,能够较好地保持猪肉的品质;张树峰等[9]研究解冻对鱼肉相关品质指标的影响,发现静水解冻后鱼肉的持水性和色泽较好,微波解冻后其咀嚼性显著增大;张春晖等[10]发现低温高湿变温解冻能提高解冻羊肉的品质;Wei等[11]发现冰水解冻对其肌肉的生化特性和微观结构的影响最小;Wang等[12]发现低温解冻后鲤鱼的解冻损失最小,品质较好。
目前针对羊不同部位肌肉解冻的研究较少,羊半膜肌质量占比大,背最长肌具有嫩度好、色泽饱和度高的特点而具有广阔的销售市场[13],因此降低这部分肌肉的品质劣变风险尤为重要。本试验采用室温空气解冻、静水解冻、冷藏解冻、超声波解冻及微波解冻对羊半膜肌及背最长肌进行处理,通过测定其相关理化品质、新鲜度指标及观察微观结构,探究不同解冻方式对肉品品质的影响,并针对羊不同部位肌肉特点进行综合分析,旨在为筛选适合羊肉解冻的方法提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
哈萨克羊(舍饲饲养、未去势、质量约50 kg、14月龄公羊)半膜肌及左右两条背最长肌,新疆乌鲁木齐市米东区新华凌市场;磷酸二氢钾(分析纯),河南云诚化工产品有限公司;磷酸氢二钾(分析纯),廊坊天科生物科技有限公司;硼酸(分析纯),青海利亚达化工厂;氧化镁(分析纯),营口勃瑞镁业有限公司;盐酸(分析纯),广东聚信化工有限公司;无水乙醇(分析纯),河南省新乡市中原有机化学有限责任公司;氯化钠(分析纯)、戊二醛(分析纯),上海阿拉丁生化科技股份有限公司;平板计数琼脂(plate count agar, PCA),青岛海博生物技术有限公司。
1.2 仪器与设备
TESTO 205便携式pH计,德国德图(深圳)有限公司;Al204-IC电子分析天平,梅特勒-托利多仪器(上海)有限公司;JZ-350色彩色差计,深圳市金准仪器设备有限公司;SSW-600-2S电热恒温水槽、BXM-30R立式不锈钢高压蒸汽灭菌锅,上海市博迅实业有限公司;HT-9815热电偶温度计,深圳市鑫思特科技有限公司;HH-M6六孔水浴锅,江苏新春兰科学仪器有限公司;TA-XT2i质构仪,英国Stable Micro Systems公司;11047食品中心温度计,美国Delta TRAK公司;KQ250DE数控超声波清洗器,昆山市超声仪器有限公司;HR40-IIA2生物安全柜、MZ-2011微波炉,青岛海尔特种电器有限公司;FSH-2A可调高速匀浆机,常州天瑞仪器有限公司;SF-GL-16A高速冷冻离心机,上海菲恰尔分析仪器有限公司;T6新世纪紫外分光光度计,北京普析通用仪器有限责任公司;SW-CJ-2 G超净工作台,苏州净化设备有限公司;FD-1A-50冷冻干燥机,上海豫明仪器有限公司;JSM-7610FPlus扫描电镜,捷欧路(北京)科贸有限公司。
1.3 试验方法
1.3.1 原料处理 随机挑选6只饲养条件、年龄相同的哈萨克羊,经放血屠宰后在30 min内取出其背最长肌及半膜肌,置于装有冰袋的保鲜盒内(0~4℃),2 h内运回实验室。将取回的各部分肌肉随机混匀后称重并分别切成15份(共计30份),装入标记好的自封袋内,每份约100±5 g,每种解冻方式各进行3次平行试验。将分好的肉样立即冻藏于-18℃冰箱,3 d后将冻结完全的肉样分别置于室温空气、静水、冷藏、超声波、微波条件下进行解冻,当肉样中心温度到达4℃后进行相关指标测定。
室温空气解冻:将冻结羊肉置于周围无热源的洁净托盘上,以空气(25℃)为介质进行解冻[14];静水解冻:将冻结羊肉用真空包装袋重新包装,置于水浴锅(15℃)中进行解冻;冷藏解冻:将冻结羊肉置于洁净托盘上,放入4℃冰箱进行解冻;微波解冻(波长122 mm、频率2 450 MHz、功率700 W):将冻结羊肉置于微波炉中、调至“按质量解冻”,选择质量为0.1 kg进行解冻;超声波解冻(频率40 kHz,功率250 W,温度20℃):将冻结完全的羊肉用真空包装袋重新包装,置于超声波清洗器内进行解冻。经室温空气解冻、静水解冻、冷藏解冻、超声波解冻及微波解冻所需时间分别为2.500、0.750、9.000、0.200、0.025 h。
1.3.2 解冻复温曲线的绘制 使用热电偶温度计对样品中心温度进行监测,将温度计探头插于样品几何中心,待样品中心温度为4℃,视为解冻完全,绘制解冻复温曲线。
1.3.3 解冻损失的测定 解冻损失按公式(1)计算:

(1)
式中,m1为解冻前羊肉质量,g;m2为解冻后羊肉质量,g。
1.3.4 蒸煮损失的测定 参考Gambuteanu等[15]的方法对蒸煮损失进行测定。将解冻后的羊肉沿肌肉纤维方向切成5 cm×3 cm×2 cm肉块,用滤纸吸干表面水分,称重记为m3后置于蒸煮袋内,将样品置于85℃水浴锅中加热,当肉样中心温度为70±1℃时,立即取出,冷却至室温后取出肉样称重记为m4。按照公式(2)计算蒸煮损失:
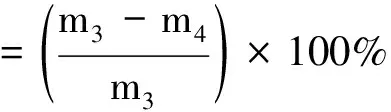
(2)
式中,m3为蒸煮前羊肉质量,g;m4为蒸煮后羊肉质量,g。
1.3.5 pH值的测定 将便携式pH计的探头插入肉样2 cm左右,测定其pH值,待读数稳定,记录结果并取平均值,每个样品随机取6个点进行测试。
1.3.6 色差的测定 将肉样取出后用吸水纸擦干其表面的水分并置于试验台表面,同时对色差仪进行校准,校准完毕测定样品的亮度值(L*值)、红度值(a*值)及黄度值(b*值),每个样品随机选取6个点进行测定,结果取平均值。
1.3.7 高铁肌红蛋白(metmyoglobin, MetMb)含量的测定 参照余文晖等[16]的方法测定MetMb质量分数。准确称取1.00 g切碎的解冻后肉样,加入10 mL预冷的磷酸盐缓冲溶液(0.02 mol·L-1、pH值7.2),在0℃的条件下匀浆1 min,转速为11 000 r·min-1, 然后将匀浆液置于冷冻离心机内,设置参数:转速10 000 r·min-1, 时间10 min,温度4℃。离心结束取上清液,测其在525、545、565、572 nm波长处的吸光度值。按照公式(3)计算高铁肌红蛋白质量分数:
(3)
式中,A525、A545、A565、A572分别为525、545、565、572 nm波长处的吸光度值。
1.3.8 质构的测定 参照Cheng等[17]的方法,并进行适当优化。以硬度(hardness)、弹性(springiness)、内聚性(cohesiveness)、胶黏性(gumminess)、咀嚼性(chewiness)及恢复性(resilience)作为羊肉质构特性的评判指标。将解冻完全的肉样修整为2 cm×2 cm×2 cm的方块,采取质构剖面分析方法(texture profile analysis,TPA)对样品的平行纤维进行测定。每组处理选4个样品,每个样品取3个点进行测定,结果取平均值。
本试验所用参数如下:探头型号为P/36R,测前、测中、测后速度均为1 mm·s-1,样品应变程度50%,两次压缩间隔时间5 s,数据收集200个样/s,触发力5.0 kg,触发类型auto,测试环境温度25℃。
1.3.9 挥发性盐基氮(total volatile basic nitrogen, TVB-N)的测定 参考《GB 5009.228-2016 食品中挥发性盐基氮的测定》[18]采用半微量定氮法测定。每个样品处理3次,最终结果取平均值。
1.3.10 菌落总数的测定 参照《GB 4789.2-2016食品安全国家标准 食品微生物学检验 菌落总数测定》[19]测定解冻后羊肉的菌落总数。
1.3.11 微观结构 参照姜晶丹等[20]的方法。将解冻后的羊肉切成3 mm×3 mm×2 mm大小的薄片,用2.5%戊二醛4℃固定48 h,去除戊二醛溶液,使用磷酸缓冲液(0.1 mol·L-1)漂洗样品5次,将样品利用不同浓度的乙醇溶液(30%、50%、70%、90%、100%)进行梯度脱水,每个梯度处理时间为15 min,最后将处理好的样品进行冷冻干燥,喷金后进行观察,电镜加速电压为5 kV,放大倍数为500倍。
1.4 数据处理
数据采用Microsoft Excel 2013软件整理,运用 SPSS 19.0 软件(Duncan法)分析数据差异性,运用Origin 8.5软件作图。最终结果以平均值±标准差表示。
2 结果与分析
2.1 不同解冻方式下羊肉的复温曲线
不同解冻方式所用的解冻时间如图1所示。不同解冻方式的解冻时间差异显著(P<0.05),其中冷藏解冻时间最长,平均为9 h,微波解冻时间最短,平均为0.025 h。曹荣等[21]也认为冷藏解冻耗时显著高于室温空气解冻、静水解冻。
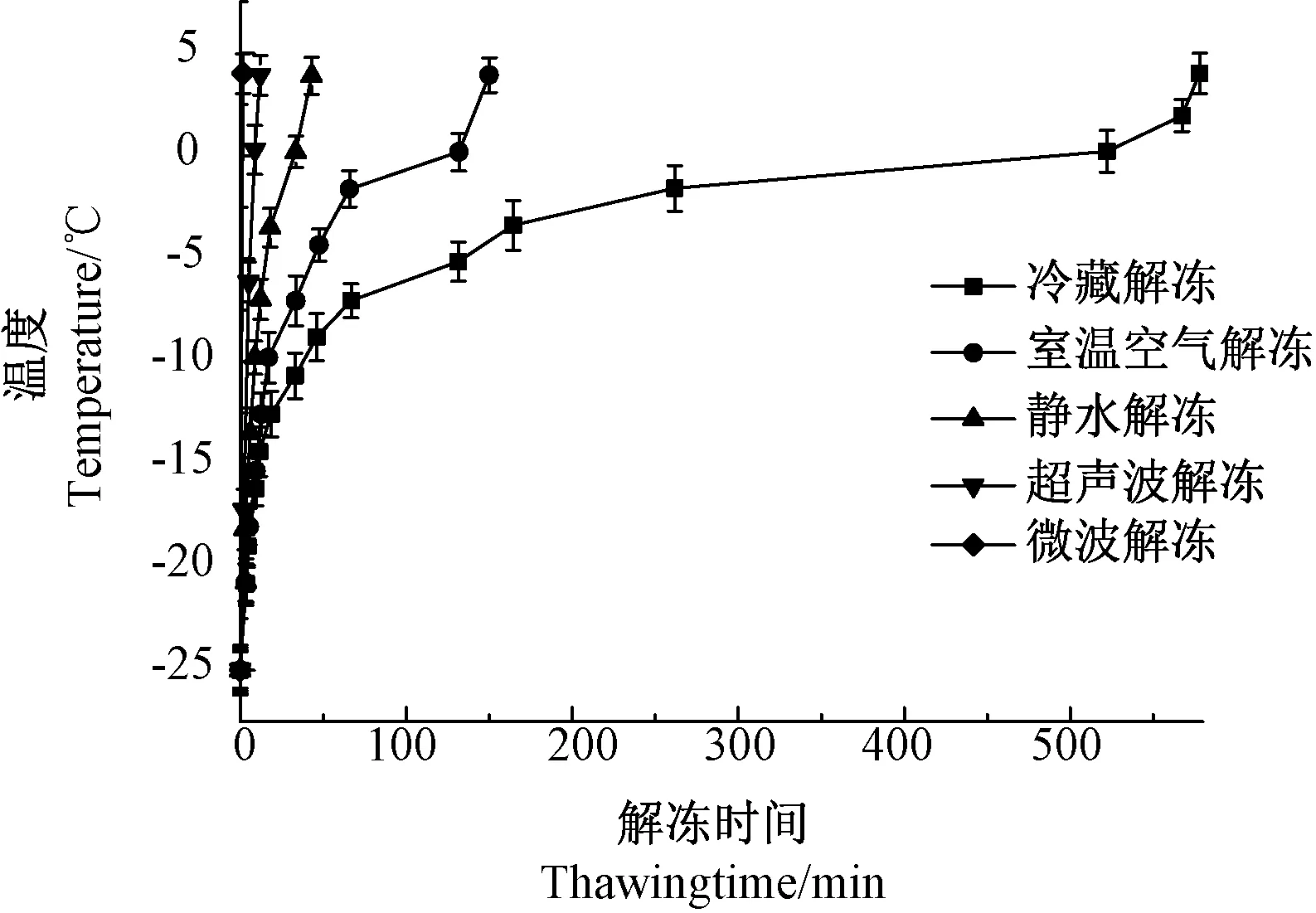
图1 不同解冻方式下冷冻羊肉的复温曲线Fig.1 The rewarming curve of frozen mutton under different thawing methods
2.2 不同解冻方式对羊肉持水性的影响
羊肉的持水性可通过解冻损失率和蒸煮损失率进行综合衡量[22]。解冻方式对羊肉解冻损失的影响如图2所示。不同解冻方式对羊肉的解冻损失影响差异显著(P<0.05)。各处理组间,冷藏解冻组半膜肌与背最长肌的解冻损失最小(1.08%、3.10%)(P<0.05),静水解冻组次之(2.34%、4.18%),而微波解冻组损失最大(7.63%、9.59%)(P<0.05),室温空气解冻组及超声波解冻组的解冻损失介于静水解冻与微波解冻组之间。解冻肉在蒸煮过程中蛋白易发生聚集和热变性,导致持水力降低,蒸煮损失率增加[23]。解冻方式对羊肉蒸煮损失的影响如图3所示。与新鲜肉相比,经室温空气解冻、超声波解冻及微波解冻后,羊肉的蒸煮损失显著增加(P<0.05)。同一解冻方式下,半膜肌的解冻损失均显著小于背最长肌(P<0.05),而蒸煮损失表现为,微波解冻后半膜肌蒸煮损失显著小于背最长肌(P<0.05),其他解冻方式下两种肌肉的蒸煮损失差异不显著(P>0.05)。

注:图中不同小写字母表示差异显著(P<0.05)。下同。Note: Different lowercase letters in the figure indicate significant difference at 0.05 level. The same as following.图2 不同解冻方式对冷冻羊肉解冻损失的影响Fig.2 The effect of different thawing methods on the loss of frozen mutton
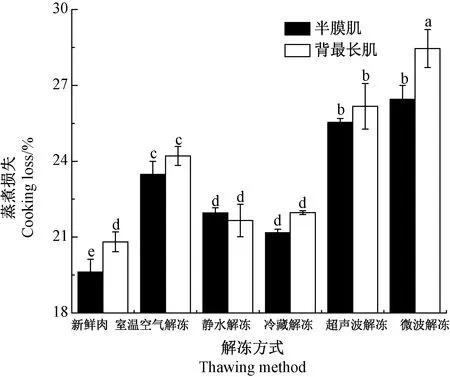
图3 不同解冻方式对冷冻羊肉蒸煮损失的影响Fig.3 The effect of different thawing methods on the cooking loss of frozen mutton
2.3 不同解冻方式对羊肉pH值的影响
pH值对肉的色泽、质构、风味和货架期等均有影响,是衡量肉品质的重要指标之一。不同解冻方式下羊肉的pH值如图4所示。羊肉经5种解冻处理后,pH值均显著下降(P<0.05)。相比其他处理组,微波解冻组半膜肌及背最长肌的pH值最小(5.37、5.38)(P<0.05),静水解冻次之(5.43、5.42),超声波解冻组的pH值最大(5.61、5.65)(P<0.05),室温空气解冻组和冷藏解冻组的pH值介于超声波解冻和静水解冻组之间。同一解冻方式下,除室温空气解冻组及超声波解冻组背最长肌的pH值均显著大于半膜肌(P<0.05)外,其他三组的pH值差异均不显著(P>0.05)。
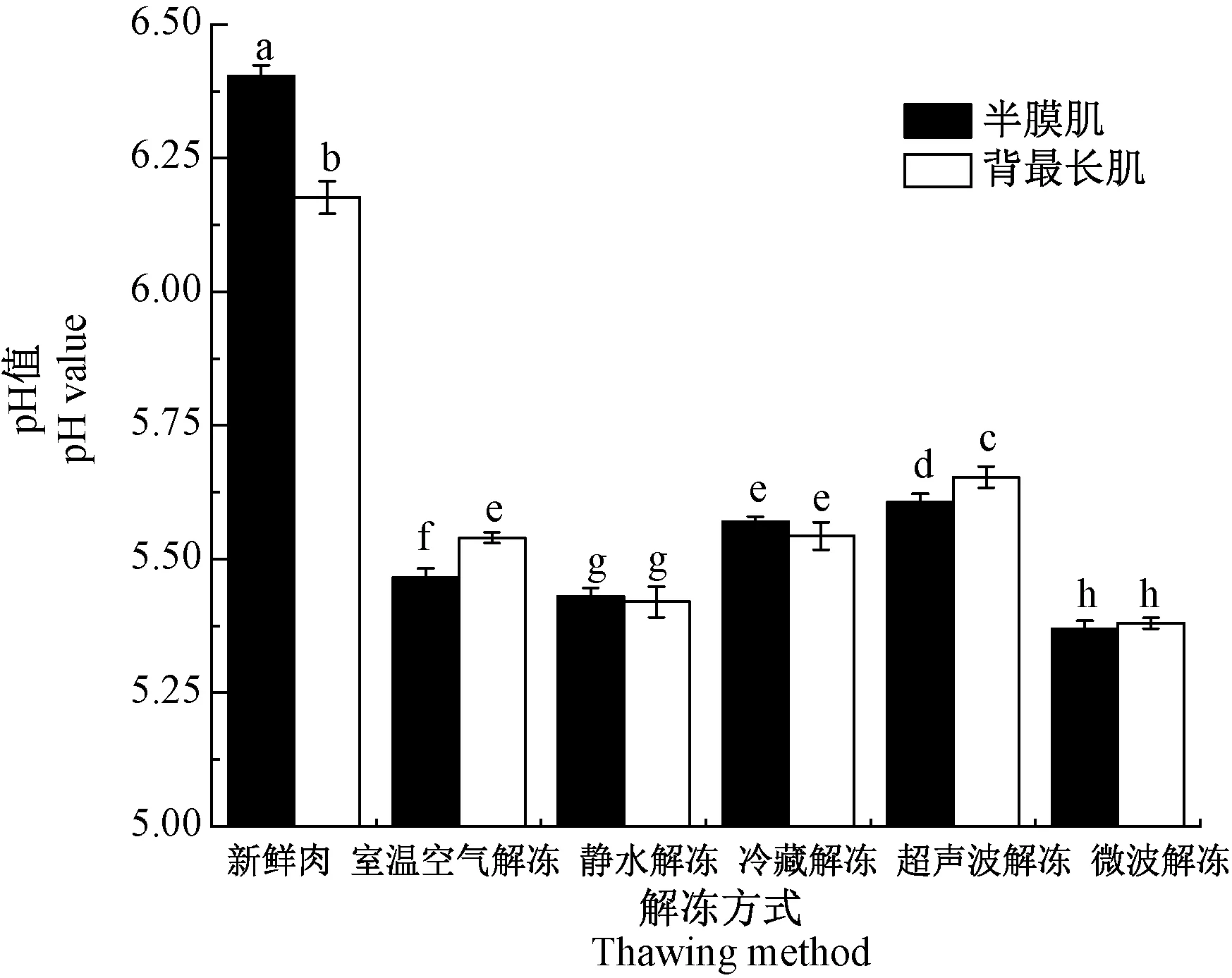
图4 不同解冻方式对冷冻羊肉pH值的影响Fig.4 The effect of different thawing methods on the pH value of frozen mutton
2.4 不同解冻方式对羊肉色差的影响
色泽是评价肉品品质最直观的指标,直接决定着消费者的购买意向。羊肉色泽的变化与氧化及色素降解有很大关系。解冻方式对羊肉肉色的影响如表1所示,羊肉经冻结-解冻后,其L*值、a*值及b*值均发生变化。相比其他处理组,静水解冻组半膜肌的L*值及冷藏解冻组背最长肌的L*值最大(41.24、40.70),超声波解冻组半膜肌的a*值及静水解冻组背最长肌a*值最小(6.44、7.25)(P<0.05),经室温空气解冻后的b*值最大(9.65、10.82)(P<0.05)。同一解冻方式下,静水解冻组、超声波解冻组半膜肌的L*值显著大于背最长肌,而冷藏解冻后半膜肌的L*值显著小于背最长肌;超声波解冻组半膜肌的a*值显著小于背最长肌,室温空气解冻、冷藏解冻半膜肌的b*值显著小于背最长肌(P<0.05),其他解冻方式对两种肌肉作用效果差异不显著(P>0.05)。
2.5 不同解冻方式对羊肉MetMb含量的影响
肉类在冷冻储存和解冻过程中会发生颜色变化,肉的颜色主要取决于肉中还原型肌红蛋白(myoglobin, Mb)、氧合型肌红蛋白(oxymyoglobin, MbO)和MetMb三者比例[24]。解冻方式对羊肉MetMb含量的影响如图5所示,微波解冻后半膜肌与背最长肌的MetMb含量(53.0%、58.0%)显著大于新鲜肉(34.2%、42.1%)(P<0.05),而冷藏解冻肌肉的MetMb含量(36.1%、43.6%)显著低于其他解冻方式,这与色差变化趋势一致。室温空气解冻组(44.5%、50.0%)及静水解冻组(50.7%、52.6%)的MetMb含量介于冷藏解冻和超声波解冻组之间。同一解冻方式下,背最长肌的MetMb含量均显著大于半膜肌(P<0.05)。

表1 不同解冻方式对冷冻羊肉色差的影响Table 1 The effect of different thawing methods on the chromatic aberration of frozen mutton
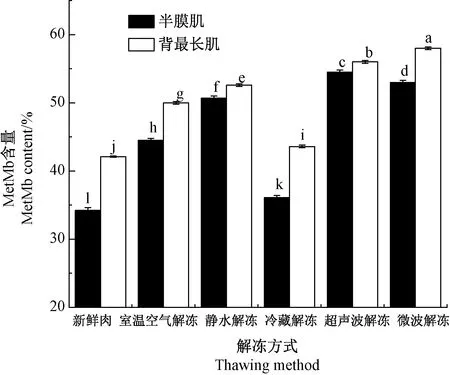
图5 不同解冻方式对冷冻羊肉MetMb含量的影响Fig.5 The effect of different thawing methods on the MetMb content of frozen mutton
2.6 不同解冻方式对羊肉质构的影响
解冻方式对羊肉质构指标的影响如表2所示。与新鲜肉相比,解冻后羊肉的硬度、弹性及咀嚼性指标显著降低(P<0.05),与其他解冻方式相比,两种肌肉经室温空气解冻及微波解冻后其硬度、弹性、胶黏性及咀嚼性等下降程度最大(P<0.05);而半膜肌经净水解冻及冷藏解冻后其硬度、弹性及恢复性较其他解冻方式高(P<0.05),背最长肌经静水解冻及冷藏解冻后其硬度、弹性高于其他解冻方式;冷藏解冻、超声波解冻后两种肌肉的胶黏性及咀嚼性较其他解冻方式高(P<0.05),同一解冻方式下,冷藏解冻组及超声波解冻组半膜肌硬度显著大于背最长肌(P<0.05),静水解冻组半膜肌的硬度、弹性、胶黏性、咀嚼性及恢复性显著大于背最长肌(P<0.05),其他解冻方式对两种肌肉作用效果差异不显著(P>0.05)。
2.7 不同解冻方式对羊肉TVB-N值的影响
TVB-N指氨和胺等碱性含氮物质,是在酶和微生物的作用下分解蛋白质产生的、衡量肉产品腐败变质程度的重要指标[25]。我国对肉类该值的限定要求是低于15 mg·100 g-1[26]。解冻方式对羊肉TVB-N值的影响如图6所示。不同解冻方式对两种肌肉的TVB-N值的影响存在差异,相比其他解冻方式,静水解冻组半膜肌与背最长肌的TVB-N值最大(21.00、23.51 mg·100 g-1), 室温空气解冻组次之(17.50、21.40 mg·100 g-1)(P<0.05),二者均超过15 mg·100 g-1,属二级鲜度[26];微波解冻后半膜肌及冷藏解冻后背最长肌组的TVB-N值最小(7.00、7.45 mg·100 g-1),与同部位新鲜肉差异不显著(P>0.05);超声波解冻组的TVB-N值介于冷藏解冻组和室温空气解冻组之间。同一解冻方式下,除冷藏解冻及超声波解冻对两种肌肉的TVB-N含量影响差异不显著(P>0.05)外,其他解冻方式组半膜肌的TVB-N值均显著小于背最长肌(P<0.05)。

表2 不同解冻方式对冷冻羊肉质构的影响Table 2 The effect of different thawing methods on the texture of frozen mutton
2.8 不同解冻方式对羊肉菌落总数的影响
菌落总数用来衡量食品被细菌污染的程度及其卫生质量,反映食品在生产过程中是否符合卫生要求。解冻方式对羊肉菌落总数的影响如图7所示,解冻后羊肉的菌落总数均显著大于新鲜羊肉(P<0.05)。室温空气解冻组及静水解冻组半膜肌与背最长肌的菌落总数[3.52、3.89及3.46、3.9 lg(CFU·mL-1)]均显著大于其他解冻组(P<0.05);冷藏解冻组及微波解冻组半膜肌与背最长肌的菌落总数[3.09、3.04及2.89、2.98 lg(CFU·mL-1)]显著低于其他3种解冻方式(P<0.05)。同一解冻方式下,除微波解冻组两种肌肉的菌落总数差异不显著(P>0.05)外,其他解冻方式半膜肌的菌落总数均显著小于背最长肌(P<0.05)。
2.9 不同解冻方式对羊肉微观结构的影响
羊肉解冻后肌肉的组织微观结构与其纤维、韧性和持水性有关[27]。解冻过程中,由于蛋白质变性导致肌原纤维结构断裂,可直接影响肌肉的微观结构,解冻方式不当容易造成肌原纤维结构断裂[28]。解冻方式对羊肉微观结构的影响如图8所示。静水解冻、冷藏解冻组两种肌肉的肌原纤维排列整齐,没有明显的间隙,与新鲜肉接近;而室温空气解冻组及超声波解冻组对两种肌肉的肌原纤维影响较大,出现明显间隙,微波解冻组肌原纤维结构破坏程度更大,并出现断裂、卷曲的现象。同一解冻方式下,除超声波解冻组半膜肌肌原纤维结构间隙大于背最长肌,其他解冻方法对两种肌肉的肌原纤维结构影响差异较小。

图6 不同解冻方式对冷冻羊肉TVB-N值的影响Fig.6 The effect of different thawing methods on the TVB-N of frozen mutton

图7 不同解冻方式对冷冻羊肉菌落总数的影响Fig.7 The effect of different thawing methods on the total number of colonies of frozen mutton

图8 扫描电镜观察不同解冻方式对冷冻羊肉微观结构的影响Fig.8 Scanning electron microscope observation of the effect of different thawing methods on the microstructure of frozen mutton
3 讨论
3.1 不同解冻方式对传热速率的影响
本试验发现,不同解冻方式中,冷藏解冻时间最长,其次为空气解冻、静水解冻及超声波解冻,微波解冻组时间最短。解冻时间的差异可以解释为不同介质的传热速率存在差异[29]。冷藏解冻条件下,样品温度与环境温度差异小,空气导热性差,冰晶融化速率慢,因此解冻时间最长;水比热容大于空气,因此静水解冻速率快于室温空气解冻;超声波解冻过程中产生空化效应,显著增大传热系数[30],且超声衰减的声能被羊肉内部组织吸收转化为热能,加快了解冻速率;微波发射的高频磁场可使冻结食品中的水分子发生振荡,分子间剧烈摩擦产热,冻结食品从内到外同时吸收微波能量,大大缩短了解冻时间[31],因此微波解冻时间最短。
3.2 不同解冻方式对肉中冰晶消融的影响
解冻损失及蒸煮损失是反映肌肉保水性的重要指标。本试验中,超声波解冻与微波解冻均具有较差的保水性,而冷藏解冻后肌肉保水性较高,这与解冻过程有很大关系。羊肉在冻结过程中产生的冰晶会刺破肌肉组织,解冻后使得蛋白质的水合作用降低,导致持水能力下降,水分流失[32]。杨明远等[33]研究不同解冻方式对乌鳢品质的影响,发现微波解冻的解冻损失最高,这与微波解冻时温度过高,导致肌肉蛋白聚集和变性的程度加大有关[34-35];超声波解冻损失相对较大可能是超声波振动使肌肉组织破坏,增加了蛋白变性程度,同时与超声波的热效应有关,解冻过程中,超声波在介质中传播时产生的一部分能量经过摩擦以及热传导等过程转化为热能,使得介质温度升高,引起保水性下降[36];而冷藏解冻损失率小,一方面是由于较低的环境温度抑制了微生物生长和生化反应的进行,进而减少蛋白质的变性和降解,另一方面冷藏解冻速率慢,有利于肌肉组织吸收冰晶融化的水,故解冻损失率低[37],这与Xia等[38]的研究结果一致,而Xiong等[39]研究表明,冷藏解冻时表面已解冻的汁液会渗到肌肉内部,可能会发生重结晶,破坏肌肉组织,与本试验结果不一致,说明解冻损失率高低与解冻肉体积大小有关;同一解冻方式下,背最长肌的保水性较差,该部分肌肉蛋白含量高,经冻结解冻过后,蛋白质变性严重,导致肌肉系水力下降。
3.3 不同解冻方式对肉生化反应的调节作用
肉品在解冻过程中,pH值、色差、MetMb含量及质构等指标均与新鲜肉有较大差异。羊经屠宰后供氧停止,但肌肉的糖酵解反应及磷酸肌酐降解反应并未终止,因此会产生乳酸及PO43-等酸性物质,从而使肌肉的pH值降低[40]。本试验中,解冻后肌肉的pH值均显著下降,其中超声产生的空穴效应可能会导致蛋白水解酶和脱氨基酶的释放,提高碱性胺类的利用率[41-42],降低酸性蛋白质基团数量[43],且超声作用使离子从细胞内释放到细胞质中,导致某些离子基团位置发生变化[44],最终导致pH值升高;室温空气解冻温度高、冷藏解冻耗时相对较长,微生物和组织蛋白酶的作用使蛋白质分解产生氨、胺等其他碱性物质,使pH值有一定回升[40];静水解冻时间较短且降低了与氧气接触的几率,使蛋白质不易氧化,因此pH值较低;另外,微波具有一定的杀菌作用,能够降低羊肉表面微生物数量,进而减少碱性代谢物的产生,因此,该方式解冻后的羊肉具有较低的pH值。
其次解冻过程中肌肉L*、a*、b*值均发生变化,肌肉内部渗出汁液导致表面光亮,提高光反射率,引起L*值升高;脂肪氧化引起非酶褐变反应,生成的黄色素导致肌肉b*值升高[45],而a*值的降低与解冻过程中肌肉肌红蛋白的氧化、变性程度有关[46]。本试验中,不同解冻方式下,静水解冻后的半膜肌及冷藏解冻后的背最长肌L*值最高,而微波解冻后两种肌肉L*值最低;室温空气解冻及冷藏解冻后两种肌肉的a*值最高,而超声波解冻后a*值最低;室温空气解冻后两种肌肉的b*值最高,静水解冻后b*值最低。总体而言,静水解冻及冷藏解冻后的肌肉色泽较好。本试验认为,室温空气解冻时间长,羊肉与氧气充分接触,使得脂肪氧化严重,b*值变化明显;静水解冻不仅能隔绝氧气,还能增加肌肉的复水能力,使得肌肉L*值较高、b*值较低;超声波空化效应会导致羊肉表面的肌红蛋白变性,a*值显著降低;微波解冻温度较高,加速肌红蛋白氧化生成褐色的MetMb,导致a*值降低[47],与MetMb含量变化情况一致。解冻后羊肉肌原纤维蛋白变性程度高,细胞间的结合力变小,导致解冻肉硬度低。同一解冻方式下背最长肌的L*、a*值高于半膜肌,可能是该部分肌肉保水性较差,使得肌肉表面光亮,且该部分肌肉富含蛋白质,肌红蛋白含量较高,因而肌肉色泽发生改变。
本试验中室温空气解冻及静水解冻时间长、温度较高,给部分微生物的生长繁殖提供了生存条件,使较多蛋白质被分解为氨及胺类小分子含氮挥发性物质;超声波解冻的空化效应及热效应造成肌肉蛋白结构发生改变,蛋白质变性,从而造成TVB-N值升高[48];冷藏解冻方式的温度较低,且对蛋白质结构破坏程度低,因此新鲜度较高;微波解冻时间短、温度高导致酶失活,阻止蛋白质分解为氨、甲胺等含氮物质,且微波解冻具有一定的杀菌效果,降低了肌肉表面微生物的数量,抑制了羊肉的腐败,与菌落总数结果相对应。同一解冻方式下,背最长肌的TVB-N值及菌落总数含量均高于半膜肌,一方面可能是该部分肌肉蛋白质氧化程度大,使得TVB-N值增大;另一方面,其系水力差,肌肉表面的水分给微生物生长提供了条件,进一步降低了肌肉的新鲜度。
3.4 不同解冻方式对肌肉微观结构的影响
肌肉的微观结构与其保水性及硬度有一定的关系,新鲜羊肉的肌原纤维排列紧密整齐,间隙较小,保水性较好。解冻后肌肉的肌原纤维结构丧失完整性,肌束间隙变大,保水性及硬度随之下降[27]。解冻温度及时长对蛋白质的变性尤其重要。本试验中冷藏解冻组的羊肉肌原纤维结构排列紧密,肌肉微观结构组织破坏最小,李慢等[49]也发现该方式对肌肉的肌纤维结构破坏程度最小;而室温空气解冻组及静水解冻组的微观结构受到一定程度的损害,肌纤维间隙增大;超声波解冻组及微波解冻组肌原纤维蛋白发生变性导致间隙变大,甚至出现卷曲、断裂的现象。从解冻损失、蒸煮损失及硬度指标进一步证实冷藏解冻对肌原纤维结构的影响较小。
4 结论
本研究结果表明,冷藏解冻对羊肉品质的影响最小,而微波解冻的影响最大;与背最长肌相比,解冻后半膜肌保水性、新鲜度等品质较好,这可能受肌肉蛋白含量及肌原纤维排列方式影响。综上,确定冷藏解冻为冻结羊肉的最佳解冻方式。
