黄芪多糖诱导细胞自噬抑制食管癌EC109细胞增殖的研究
2022-07-04常明智张思雨郝艳娇张森露张晓丽河北北方学院河北张家口075000新乡医学院三全学院河南新乡453003
常明智,张思雨,郝艳娇,张森露,张晓丽*(.河北北方学院,河北 张家口 075000;.新乡医学院三全学院,河南 新乡 453003)
食管癌是常见的消化道肿瘤,国际癌症研究机构统计的“2018年全球癌症发病率和病死率”数据显示,在全球恶性肿瘤中食管癌的发病率和病死率分别位居第七位和第六位[1-2]。临床治疗食管癌主要以局部放疗和全身化疗为主,但由于食管癌早期症状隐匿,患者就诊时多已发展至中晚期,导致疗效欠佳且毒副作用明显,严重影响患者预后。因此寻找疗效明显、副作用小的抗食管癌药物成了亟需解决的问题之一。黄芪是我国传统的补气中药之一,含有多种化学成分,具有增强免疫力、抗肿瘤、抗衰老等作用。黄芪多糖是黄芪的主要有效成分之一,相关研究证实了黄芪多糖对多种肿瘤细胞都有抑制作用[3-4]。
自噬是在自噬相关基因的调控下溶酶体自我降解代谢的过程,是包括肿瘤发生、发展、细胞死亡和存活在内的各种生理病理过程中的一个关键机制[5-6]。自噬被证明与凋亡有复杂的关系,特别是在肿瘤细胞系中。正常情况下,自噬在细胞生长,发育和稳态中发挥重要作用,是一种依赖溶酶体对异常的细胞器和蛋白质等物质进行降解的过程,然而,当自噬持续发生时,会引起细胞非程序性死亡从而抑制细胞的增殖[7]。自噬在抗肿瘤作用机制中具有重要意义,但是黄芪多糖抗食管癌的作用机制是否与影响细胞自噬水平有关仍待探索。
本课题组拟通过体外培养食管癌EC109细胞,探讨黄芪多糖能否通过调控食管癌EC109细胞自噬水平进而影响EC109细胞的生物学行为。
1 材料
1.1 细胞
食管癌EC109细胞系(中国科学院典型培养物保藏委员会细胞库)。
1.2 试药
注射用黄芪多糖(批号:210202,天津赛诺制药有限公司,每瓶含黄芪多糖250 mg)。噻唑蓝(MTT)试剂盒和BCA蛋白定量试剂盒(北京索莱宝有限公司);DMEM高糖培养基(美国CORNING公司);胎牛血清(美国Gegrogen公司);胰蛋白酶(南京凯基生物科技有限公司);微管相关蛋白1轻链3(LC3B抗体)和人死骨片1(P62抗体)(美国CST公司);自噬效应蛋白Beclin1(Abcam公司);自噬抑制剂PIK-Ⅲ(Selleck公司)。
1.3 仪器
S-3400N扫描电镜和冷冻干燥机(日本日立公司);流式细胞仪(美国BD公司);二氧化碳恒温孵化器(美国热电公司);电泳仪(北京六一仪器厂);超灵敏多功能成像仪600(美国GE公司)。
2 方法
2.1 细胞培养
复苏后的EC109细胞用DMEM高糖培养基(含10%胎牛血清、青霉素100 U·mL-1、链霉素100 µg·mL-1)培养,置于37℃、5%CO2恒温培养箱中,培养液每24 h更换一次,待细胞融合至80%以上后传代,继续在培养箱中培养。
2.2 黄芪多糖对EC109细胞增殖活性的影响
将处于对数生长期的EC109细胞用0.25%的胰蛋白酶消化后制成细胞悬液,以每孔4×103个细胞接种于96孔板,置于恒温培养箱中培养。24 h后弃掉原培养液,加药,设对照组(0 mg·mL-1)、黄芪多糖药物组(0.5、1.0、1.5、2.0、2.5、3.0 mg·mL-1),每组设立6个复孔,边缘孔内各加入100 µL PBS,继续于培养箱中培养。24 h后每孔加入20 µL MTT(质量浓度为5 mg·mL-1),继续培养4 h后,弃去培养液,每孔加入100 µL的二甲基亚砜(DMSO),避光摇床轻微振荡10 min,使用酶联免疫检测仪检测波长490 nm处的各孔的细胞光密度值(OD值),并对各组的OD值进行比较,计算其抑制率:细胞抑制率(%)=(1-OD实验组/OD对照组)×100%,筛选出低、中、高3个质量浓度(1.0、1.5、2.0 mg·mL-1)的黄芪多糖进行后续实验。
2.3 黄芪多糖抑制EC109细胞增殖与细胞自噬的关系
按照“2.2”项下结果,将细胞分为对照组、高浓度黄芪多糖组(2.0 mg·mL-1)、高浓度黄芪多糖(2.0 mg·mL-1)联 合5 µmol·L-1PIK-Ⅲ(自噬抑制剂)组、自噬抑制剂组。其他步骤同“2.2”项下。
2.4 吖啶橙染色实验观察黄芪多糖对EC109细胞凋亡的影响
取对数生长期的EC109细胞,制成细胞悬液,以每孔2×105个细胞接种于铺好爬片的24孔板中,于5%CO2、37℃培养箱中培养,待其贴壁后,吸弃培养基,PBS洗2遍,每次5 min,分别用不同浓度的黄芪多糖进行处理,继续于培养箱中继续培养24 h,吸弃培养基,PBS洗2遍,晾干,95%乙醇溶液固定5 min,滴加0.01%(1 µg·mL-1)吖啶橙染液染色5 min,于培养箱中培养20 min,小心取出爬片,PBS冲洗2遍,滴加防淬灭封片液,激光共聚焦显微镜下观察。
2.5 流式细胞术检测黄芪多糖对EC109细胞凋亡的影响
消化、离心并收集处于对数生长期的EC109细胞接种于6孔板,计数并调整细胞密度为4×105个·mL-1,24 h后弃培养液,加药,设置对照组,低、中、高浓度(1.0、1.5、2.0 mg·mL-1)黄芪多糖组,继续培养24 h后弃培养液,PBS洗涤2次,无EDTA胰酶消化后离心,收集细胞,加入500 µL 1×Binding Buffer制备成细胞悬液,再加入5 µL PI和5 µL Annexin V-FITC后避光孵育15 min,冰上放置,于1 h内上机检测,FACS Diva 4.1软件对结果进行分析。
2.6 黄芪多糖对EC109细胞表面结构的影响
准备无菌圆形小盖玻片,于37℃、5%CO2恒温培养箱中取出细胞,制成4×104个·mL-1的EC109细胞悬液,24孔板细胞爬片,于细胞培养箱中培养24 h后取出,用PBS缓冲液清洗3次(贴孔壁缓慢加入,避免细胞被冲掉),使用2.5%戊二醛固定样本,于4℃冰箱放置4~6 h,PBS洗3次(每次5 min),乙醇(30%、50%、70%、75%、80%、85%、95%、100%)梯度脱水(每次5 min),叔丁醇置换2次(每次10 min),第二次叔丁醇不吸出,放入冷冻干燥仪中过夜,次日用离子溅射仪喷镀,扫描电子显微镜观察细胞表面结构。
2.7 黄芪多糖对EC109细胞垂直迁移的影响
将处在对数生长期时的EC109细胞饥饿处理12 h,24孔板内加入500 µL含10%胎牛血清的DMEM高糖培养基,将Transwell小室放入加了培养基的孔里,然后将上述饥饿处理过的EC109细胞用0.25%的胰蛋白酶进行消化,离心,PBS重悬细胞,每组细胞数为4.0×104个·mL-1,调整黄芪多糖的浓度为1.0、1.5、2.0 mg·mL-1,用其再次将细胞重悬,24孔板每孔加200 µL的EC109细胞悬液,置于培养箱中培养24 h,取出24孔板,使用移液枪吸出小室中的废液,擦去小室壁上未迁移的细胞,风干,用4%多聚甲醛固定15~20 min,取出小室,再次风干,结晶紫染色15~20 min,PBS清洗3次,倒置显微镜下观察,拍照留存。
2.8 黄芪多糖对EC109细胞侵袭能力的影响
将-20℃ Matrigel胶(基质胶)于4℃解冻过夜,次日,用无血清的DMEM培养基稀释Matrigel胶(基质胶∶无血清DMEM培养基=1∶4),取出4个Transwell小室,每个小室内均匀加入60 µL已稀释的Matrigel胶,置于培养箱中4 h至Matrigel胶凝固,其他步骤同“2.7”项下。
2.9 黄芪多糖对LC3的荧光表达强度的影响
将食管癌EC109细胞按照对照组,低、中、高浓度黄芪多糖药物组分别接种到共聚焦小皿中孵育24 h,加药处理,药物作用24 h后用PBS缓冲液冲洗细胞2次,每次5 min,然后用4%多聚甲醛固定细胞15 min,再用适量0.1% Triton X-100孵育10 min,1% BSA封闭30 min,最后在含有一抗LC3(1∶200)中4℃孵育过夜。孵育完成后用PBS缓冲液洗涤3次,每次5 min,室温避光孵育对应二抗1 h(1∶200),用PBS洗涤3次,每次5 min,DAPI室温避光染色5 min,PBS洗涤3次,每次5 min,双蒸水洗涤1次,滴加防淬灭封片剂进行避光封片,激光共聚焦显微镜下进行成像观察。
2.10 黄芪多糖对自噬相关蛋白Beclin1、P62和LC3B表达水平的影响
不同浓度黄芪多糖处理EC109细胞24 h后,收集各组细胞,按照100 µL RIPA(细胞裂解液)∶1 µL PMSF(蛋白酶抑制剂)∶2 µL NAF(磷酸酶抑制剂)比例提取细胞全蛋白,BCA蛋白定量试剂盒对蛋白浓度进行定量,制备分离胶和浓缩胶(LC3B抗体用15%分离胶和浓缩胶,其余抗体用10%分离胶和浓缩胶),煮蛋白10 min,加样,电泳(电压90 V,电流300 mA,30 min后电压转120 V,电流不变,1 h),转膜(电压100 V,电流恒流250 mA,1 h),转膜结束后,室温下用5%的脱脂牛奶(脱脂奶粉∶1×TBST=1∶20)封闭PVDF膜1 h,一抗(Beclin1、LC3B、P62)用5%的脱脂牛奶稀释(根据抗体说明书)后孵育,4℃过夜;复温后回收一抗,用1×TBST洗膜3次,每次10 min,二抗室温下孵育2 h,再用1× TBST洗膜3次,每次10 min,显色液显色,Amersham Imager 600显影,使用Image J软件分析灰度值。
2.11 统计学处理
实验结果采用SPSS 22.0进行数据分析,计量资料以(±s)表示,多组间数据比较采用单因素方差分析(One-way ANOVA),组间数据两两比较采用t检验,使用GraphPad Prism软件进行绘图,P<0.05为差异具有统计学意义。
3 结果
3.1 黄芪多糖抑制EC109细胞增殖
MTT结果显示,随着黄芪多糖浓度升高,其对EC109细胞的抑制率也越来越高,表明黄芪多糖可以以剂量依赖性方式抑制EC109细胞增殖。与对照组比较,差异均具有统计学意义(P<0.01)。筛选出抑制率分别为28%、45%、56%的低、中、高3个质量浓度(1.0、1.5、2.0 mg·mL-1)的黄芪多糖进行后续实验(见表1)。
表1 黄芪多糖对EC109细胞增殖的影响(±s) Tab 1 Effect of APS on the proliferation of EC109 cells (±s)

表1 黄芪多糖对EC109细胞增殖的影响(±s) Tab 1 Effect of APS on the proliferation of EC109 cells (±s)
注(Note):与对照组(0 mg·mL-1)相比,**P<0.01(Compared with the control group,**P<0.01)。
黄芪多糖药物浓度/(mg·mL-1) OD值 抑制率/%0 0.947±0.02 0 0.5 0.742±0.03** 21 1.0 0.676±0.01** 28 1.5 0.514±0.02** 45 2.0 0.411±0.03** 56 2.5 0.332±0.04** 64 3.0 0.253±0.02** 73
3.2 黄芪多糖可能通过诱导细胞自噬抑制EC109细胞增殖
MTT结果显示,与对照组相比,高浓度黄芪多糖组、高浓度黄芪多糖联合自噬抑制剂组、自噬抑制剂组的细胞抑制率逐渐降低(P<0.01),表明黄芪多糖可能通过诱导细胞自噬进而抑制EC109细胞增殖(见表2)。
表2 黄芪多糖、自噬抑制剂对EC109细胞增殖的影响(±s) Tab 2 Effect of APS and autophagy inhibitor on the proliferation of EC109 cells (±s)
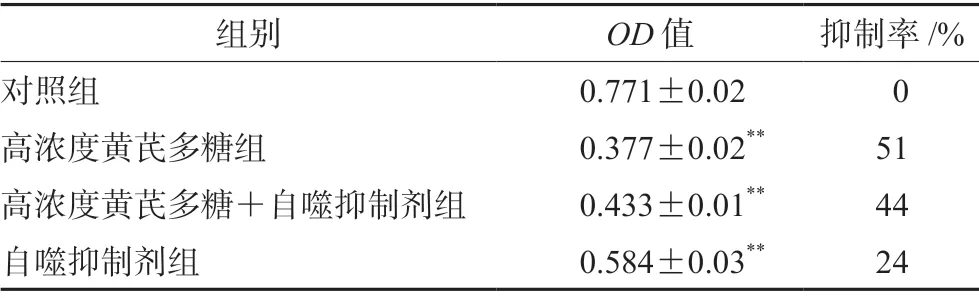
表2 黄芪多糖、自噬抑制剂对EC109细胞增殖的影响(±s) Tab 2 Effect of APS and autophagy inhibitor on the proliferation of EC109 cells (±s)
注(Note):与对照组相比,**P<0.01(Compared with the control group,**P<0.01)。
组别 OD值 抑制率/%对照组 0.771±0.02 0高浓度黄芪多糖组 0.377±0.02** 51高浓度黄芪多糖+自噬抑制剂组 0.433±0.01** 44自噬抑制剂组 0.584±0.03** 24
3.3 黄芪多糖促进EC109细胞凋亡
吖啶橙染色实验结果显示,对照组活细胞核内多呈弥散均匀荧光,随着用药浓度的增加,细胞核内浓染致密的颗粒块状荧光逐渐增多,表明黄芪多糖可以促进EC109细胞凋亡产生程序性的核固缩现象(见图1)。

图1 吖啶橙染色实验检测黄芪多糖组细胞的凋亡程度Fig 1 Degree of apoptosis of EC109 cells determined by acridine orange staining assay in the APS groups
流式细胞术结果显示,以凋亡早期(Q4)和晚期凋亡(Q2)之和为总的凋亡细胞数,其细胞凋亡率随着用药浓度的增加呈现递增趋势,对照组,低、中、高浓度黄芪多糖组的细胞凋亡率分别为:(11.8±0.44)%、(15.9±0.37)%、(28.3±0.41)%、(41.0±0.48)%(见图2)。

图2 流式细胞术检测黄芪多糖组细胞的凋亡程度Fig 2 Degree of apoptosis of EC109 cells determined by flow cytometry in the APS groups
3.4 黄芪多糖破坏EC109细胞表面结构
对照组的EC109细胞可以观察到细胞呈三维立体椭圆形结构,细胞整体形态丰满,表面可见丰富的微绒毛和伪足,且伪足与其他细胞表面的伪足相互连接(见图3A);低浓度黄芪多糖组可见细胞的整体形态变化与对照组相比不太明显,但细胞表面的微绒毛和伪足相对减少且形态上变得更加短小(见图3B);中浓度黄芪多糖组观察到细胞整体形态呈不规则型改变,细胞膜发生轻微的皱缩,细胞表面微绒毛和伪足进一步减少(见图3C);高浓度黄芪多糖组可见细胞膜皱缩明显,细胞表面观察不到明显的微绒毛和伪足的存在(见图3D)。可见,随着黄芪多糖浓度的增加,食管癌EC109细胞表面结构的破坏愈发严重,表明黄芪多糖可能通过破坏EC109细胞的表面结构影响细胞的生长进而抑制其增殖。
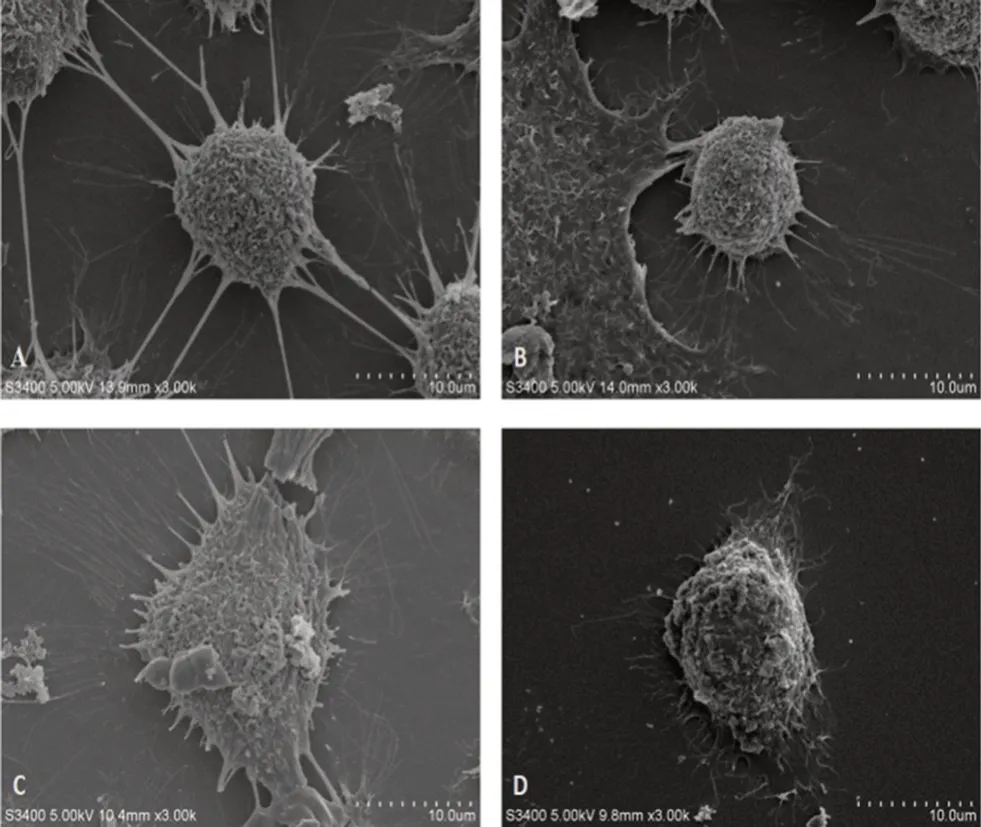
图3 黄芪多糖对EC109细胞表面结构的影响(×3000)Fig 3 Effect of APS on the surface structure of EC109 cells(×3000)
3.5 黄芪多糖抑制EC109细胞迁移能力
Transwell实验结果显示,黄芪多糖能显著抑制EC109细胞的迁移能力(见图4)。随着黄芪多糖浓度的增加,EC109细胞穿膜数逐渐减少,对照组,低、中、高浓度黄芪多糖组迁移细胞数依次是(152±4)、(98±6)、(84±2)、(20±5)。与对照组相比,差异均具有统计学意义(P<0.01)。

图4 黄芪多糖对EC109细胞的迁移能力的影响Fig 4 Effect of APS on the migration capacity of EC109 cells
3.6 黄芪多糖抑制EC109细胞侵袭能力
Transwell实验结果显示,黄芪多糖能显著抑制EC109细胞的侵袭能力(见图5)。随着黄芪多糖浓度的递增,EC109细胞穿胶数逐渐减少。对照组,低、中、高浓度黄芪多糖组侵袭细胞数依次是(109±3)、(68±5)、(53±4)、(17±6)。与对照组相比,差异均具有统计学意义(P<0.01)。

图5 黄芪多糖对EC109细胞的侵袭能力的影响Fig 5 Effect of APS on the invasion capacity of EC109 cells
3.7 黄芪多糖诱导LC3荧光表达强度增强
如图6所示,对照组细胞LC3荧光强度较弱,各给药组细胞LC3荧光染色强度较对照组升高。表明黄芪多糖可能通过诱导LC3蛋白的表达增强进而诱导细胞自噬水平增高。对照组,低、中、高浓度黄芪多糖组LC3的相对荧光强度表达依次为(0.05±0.01)、(0.11±0.02)、(0.24±0.04)、(0.52±0.02)。与对照组相比,差异均具有统计学意义(P<0.01)。
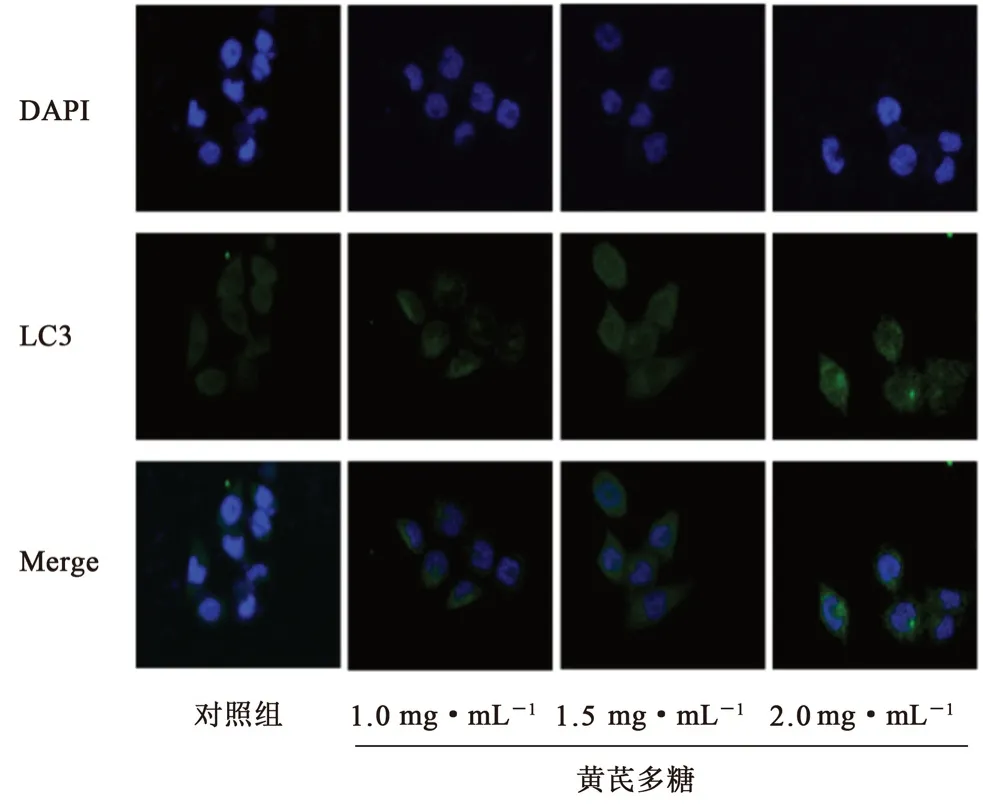
图6 黄芪多糖诱导LC3荧光表达强度增强Fig 6 APS induced an enhanced fluorescence expression intensity of LC3
3.8 黄芪多糖诱导EC109细胞发生自噬
Western blot结果显示,与对照组相比,各给药组P62蛋白表达逐渐下调(P<0.01),Beclin1、LC3B蛋白表达逐渐上调(P<0.05,P<0.01),表明黄芪多糖可以诱导EC109细胞发生自噬(见图7)。

图7 黄芪多糖对EC109细胞自噬相关蛋白的影响Fig 7 Effect of APS on autophagy-related proteins in EC109 cells
4 讨论
食管癌是消化系统肿瘤中侵袭性极强的恶性肿瘤之一,食管癌细胞的快速增殖以及其极强的侵袭能力是导致患者病死率高的重要原因[8]。临床放化疗治疗食管癌的毒副作用较强,患者的生存质量较差,因此研究药效温和,副作用少且可抑制其细胞增殖及侵袭能力的药物具有一定的意义。传统中药因靶点多、毒性低、疗效佳,已成为抗肿瘤药物研究领域的热点话题。作为黄芪最主要的有效成分之一,黄芪多糖药效温和,毒副作用较小,且已被证实在诸多肿瘤治疗中有效,并与细胞自噬关系密切[9-11]。本课题组研究发现,随着黄芪多糖浓度的升高,食管癌EC109细胞增殖率远低于对照组。通过扫描电镜观察其表面结构的变化,发现细胞表面微绒毛和伪足均少于对照组,且细胞膜也发生了皱缩。经吖啶橙染色实验发现,黄芪多糖可以使食管癌EC109细胞发生明显的核固缩现象,流式细胞术结果证明了黄芪多糖可诱导EC109细胞凋亡。LC3荧光强度表达以及免疫蛋白印迹实验验证了黄芪多糖可诱导食管癌EC109细胞自噬水平增强。这表示黄芪多糖对于食管癌的治疗具有一定的临床应用价值。
细胞自噬调控作为一种有效的肿瘤治疗干预策略越来越受到医药工作者的关注。自噬相关蛋白LC3、Beclin1和P62是自噬体形成必不可少的分子,在自噬体形成的不同阶段均有LC3、Beclin1和P62的参与,是检测自噬水平的三种标记蛋白。LC3分为LC3A、LC3B和LC3C三种亚型,其中LC3B亚型与自噬关系最为密切[12],LC3参与自噬体形成到成熟的各个阶段,当自噬发生时,LC3-Ⅰ被活化,结合磷脂酰乙醇胺转变为LC3-Ⅱ,促进自噬体形成及成熟[13],LC3-Ⅱ的变化水平与自噬程度成正相关,故自噬水平的高低可以通过LC3-Ⅱ/LC3-Ⅰ的比值大小进行判断[14]。Beclin1作为参与自噬体形成的一个必需分子,通过对自噬的调节,在肿瘤的发生发展中起着重要作用[15],在自噬过程中Beclin1的表达水平往往会升高。而在自噬过程中,P62蛋白会在细胞质中不断地被降解,如果自噬被抑制,P62蛋白将会在细胞质中不断地积累,因此P62也可作为反映自噬水平的一种标记蛋白[16]。有研究证实在诸多癌症中检测到P62的异常积聚[17-19],提示P62的积聚与肿瘤的进展有关,自噬通过限制P62的积聚而抑制肿瘤的发生[20]。本研究证实黄芪多糖可以通过上调自噬相关蛋白LC3、Beclin1,同时下调P62蛋白的表达诱导细胞自噬水平增高,表明黄芪多糖对食管癌细胞的影响机制与其诱导发生细胞自噬有关。
综上所述,黄芪多糖作为一种具有抗肿瘤作用的中药,在抑制食管癌EC109细胞增殖、迁移和侵袭,促进凋亡方面具有重要意义,其发挥抗肿瘤作用的机制与诱导细胞自噬水平增强有关。生物体内自噬与病理生理的关系复杂,本课题仅论证了黄芪多糖可以通过调控其自噬相关蛋白诱导食管癌EC109细胞自噬水平增强,但其具体机制仍待进一步探索。
