水分解的“救星”:层状双金属氢氧化物的开发及应用
2022-07-02周林楠朱立红杨一思田正芳
周林楠,朱立红,杨一思,田正芳
(黄冈师范学院 化学化工学院,湖北 黄冈438000)
随着化石能源日益消耗,“碳达峰碳中和”理念日益被人们理解并接受,寻找可替代的绿色新能源的需求也越来越迫切。氢气具有高质量能量密度,并且燃烧产物仅为水,是目前热门研究的绿色能源,因此电解水制氢也成为最具潜力的新能源转换技术。近年来,科学技术和创新成果的展示不再局限于“科研圈子”,例如,在2021年高考理科综合全国乙卷中就探究了“液态阳光”项目,采用太阳能发电来分解水制氢,再采用催化剂促进氢气与温室气体二氧化碳反应制备燃料甲醇。这一项目完美阐释“碳中和”的应用。响应新课程改革,教师们关注化学前沿热点,将教材与与科学技术革新和社会生活发展相结合[1]。中学化学教材中《水的组成》这一章节简单介绍了电解水制氢气和氧气的过程,这个实验是当前化学前沿热点“水分解”“燃料电池”科学研究的基础。为了引导中学生更好地了解电解水制氢气和氧气实验如何应用到实际生产中,以及如何使用新型催化剂材料来提升水分解效率,本文介绍了一类非贵金属催化剂材料,即层状双金属氢氧化物(LDH)在电催化水分解领域重要贡献。将化学前沿研究热点及科研成果引入到化学教学中,启发学生关注与化学有关的社会热点问题,认识环境保护和资源合理开发的重要性;深刻理解化学、技术、社会和环境之间的相互关系,赞赏化学对社会发展的重大贡献,能够运用自身的知识和方法来综合分析化学过程对自然可能带来的各种影响,激励学生积极探讨与化学有关的社会决策问题,勇于承担责任,从而将化学学科核心素养贯穿于课堂与生活。
1 中学化学电解水实验
电解水实验是学生必做的基础实验之一,该实验主要目的是让学生探究水是由氢、氧两种元素组成的,是初级中学化学实验中一个重要而有趣的实验,对于培养学生的实验兴趣和创新能力起着积极的促进作用。如图1所示,电解水实验的原理是通入稳定的直流电,在直流电的作用下,纯水在阴极产生氢气(氢析出反应HER),在阳极产生氧气(氧析出反应OER)。在一个标准大气压和室温下,氧气比氢气在水中的溶解度大,1体积的水最多可溶解0.031体积氧气或0.0182体积氢气。因此教师在进行该实验时要加快反应速度,因为反应越快得到氢气与氧气的体积比越接近2∶1,从而成功推断出水分子中氢和氧的原子个数比为2∶1。
在中学课堂实验中,通常采用石墨、铂、镀镍回形针、大头针、铜片等作为电极材料,并且电解水设定电压为3~5 V,远远高于理论电压1.23 V。理论与实践之间的桥梁需要研究者们来构建,因此,研究者们需要解决为什么电解水实验中实际提供的电源要高于理论电压值1.23 V?不同环境下电解水的反应机理是什么? 是否存在一种高效催化剂快速提升产氢产氧速率? 等问题。这些问题的研究能够为科学创新提供方向,同时,研究者们的科学探究精神也能够激发学生探索未知世界的热情,鼓舞学生发展提出问题的意识和能力,拓展分析和解决问题的角度和思路。
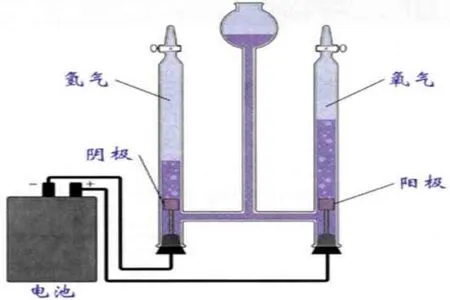
图1 中学化学电解水装置图
2 氧析出反应机理
电催化分解水是生产清洁能源氢气的有效途径之一。OER 是电解水反应中一个关键半反应,标准状况下水分解电压为1.23 V,但在实际反应过程中缓慢的动力学过程阻碍反应进行。研究表明即使是使用昂贵的贵金属氧化物催化剂(氧化铱、氧化钌等)也需要一个额外电势,简称过电位。缓慢的OER 成为整个电催化分解水反应的瓶颈,因此克服OER 过程中过电位产生的能源消耗是研究者们需要解决的问题。经过研究者们的不懈努力,OER 反应机理如图2所示。
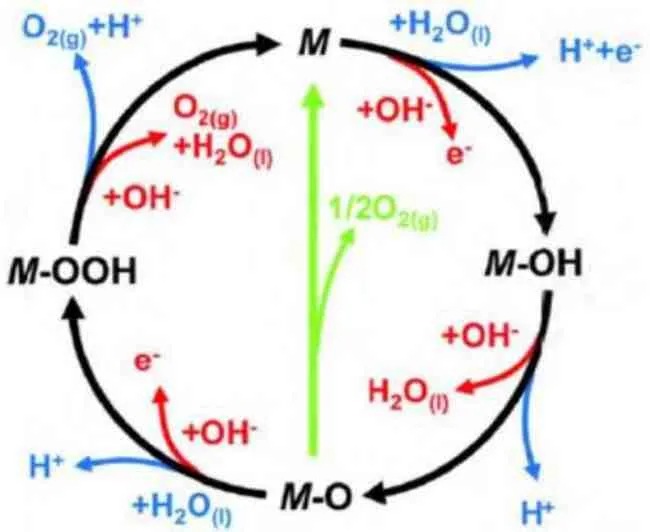
图2 OER 反应在碱性和酸性溶液中的反应机理
由反应机理可知,在碱性电解液中的OER反应历程为溶液中的OH-在阳极失去四个电子,然后被氧化生成O2,总反应方程式为:4OH→2H2O+O2+4 e 。在该过程中,电解液中OH-首先吸附在催化剂表面活性位置M,催化剂失去一个电子形成活性中间体MOH,随后中间体MOH 与溶液中的OH-相结合,并失去一个电子,生成新的中间产物MO 和水[2]。MO 中间产物形成会经历两种方式来转化为O2。同样,在酸性水溶液中催化剂的OER 电催化过程也要经历4个电子转移,然后进一步氧化催化剂的活性中间体,最后对反应中间体进行脱附暴露原始活性位置。贵金属铱或钌氧化物是OER 电催化活性最佳的催化剂材料,但是它们在酸性溶液中并不稳定[3]。因此,目前研究者们大多研究在碱性水溶液体系下催化剂OER 性能。
虽然传统的贵金属氧化物催化剂IrO2和RuO2催化性能好,但是其高昂的成本限制了其广泛应用。因此需要开发新型的非贵金属催化剂来替代贵金属材料催化OER反应。许多研究工作致力于研究具有成本效益的电催化剂代替贵金属基催化剂,其中过渡金属(如Mn、Fe、Co、Ni)氧化物/氢氧化物由于储量丰富,并具有优越的OER性能,因而格外引人注目。层状双金属氢氧化物(LDH)是一种类水滑石化合物,是由带正电荷的金属氢氧化物层和层间的阴离子通过非共价键的相互作用组装而成,分子式为·m H2O。其中二价金属阳离子(如Mg2+、Fe2+、Co2+、Ni2+、Cu2+、Zn2+)和 三 价 金 属 阳 离 子(如Al3+、Cr3+、Mn3+、Fe3+、Ga3+、In3+)的比例,层间的阴离子种类(以及卤素离子等)都对LDH 催化性能有重大影响。LDH 是一种在碱性环境中(p H=13~14)前景良好的高效OER催化剂,合理地设计LDH 纳米结构,有效地暴露表面活性位点,并缩短表面反应的离子扩散距离,有助于优化其电催化性能提升。
3 层状双金属氢氧化物的开发及应用
3.1 LDH 作为直接催化剂
目前的研究表明,钴基、镍基和铁基具有较好的OER 催化活性[4-7]。同时,将这些LDH 与石墨烯[8-9]、多孔碳[10]和碳纳米管[11]等材料复合后OER 催化反应活性得到进一步提高。例如,新加坡南洋理工大学楼雄文教授团队[12]利用简单的自模板策略制备了由超薄Ni-Fe LDH 纳米片组成的分级中空纳米棱柱(图3)。该工作首次将水溶性的四方相镍前驱体纳米棱柱作为自牺牲模板,在随后硫酸亚铁水解的过程中,溶液中水和水解过程中的质子逐渐消耗棱柱模板,与此同时在其表面生长一层Ni-Fe LDH 纳米片。通过控制溶剂比例和Fe2+离子浓度,可最终实现分级Ni-Fe LDH 中空纳米棱柱的构筑。由于具有较大的比表面积和优化的化学组成,Ni-Fe LDH 中空棱柱结构的电催化活性明显提升。当用作OER电催化剂时,Ni-Fe LDH 中空棱柱结构在较低的过电势(280 m V)下即可得到10 m A·cm-2的电流,且具有较小的塔费尔斜率(49.4 mV·dec-1)以及在碱性溶液中良好的稳定性。
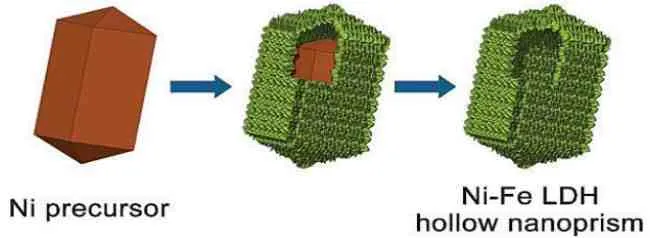
图3 Ni-Fe LDH 中空纳米棱柱过程的示意图
3.2 LDH 作为催化剂载体
随着对LDH 材料的深入研究,LDH 作为电催化剂时存在两方面不足:一个是LDH 材料堆叠的层状结构造成部分活性位点不能被充分暴露;另一个是LDH 材料自身的导电性较差,不利于电子传输。一些LDH 材料作为电催化剂时,堆叠的层状结构使得其活性位点不能被充分利用,造成催化过程中电子在电极-催化剂-反应物(产物)之间传输受阻,影响材料的催化活性与稳定性。因此,需要通过与其他材料杂化或者功能化等措施来调控LDH 催化剂材料的界面作用,提高催化剂的总体性能。贵金属纳米材料通常具有较高的催化活性,但是在使用过程中容易团聚,常采用将其负载于比表面积大的载体材料上来改善团聚问题,提高催化剂活性和寿命。载体材料的性质对金属催化剂催化性能有很大影响,因此要充分利用好催化剂与载体材料间的协同作用。天津大学胡文彬课题组[13]以M(OH)2(M=Co、Ni)为载体,利用它与金属Ag+之间的标准氧化还原电势差为反应驱动力,在层状M(OH)2表面成功地生长了Ag纳米粒子,实现了金属/过渡金属氢氧化物的复合(图4)。研究发现在碱性溶液中复合材料展现了优异的OER 催化活性和稳定性。并且通过实验和理论数据分析发现高效的催化活性主要归因于Ag纳米颗粒与载体之间存在着强烈电子协同作用,表面的Ag纳米颗粒对反应中间体的结合能发挥有效的优化作用,从而成为OER 反应活性位点。采取类似的方法,研究者们发现Pt、Pd等贵金属纳米粒子也能够成功负载于LDH 表面,并表现出尚佳的催化活性[14-15]。

图4 在碳布上生长的银纳米颗粒装饰的Co(OH)2纳米薄片示意图
3.3 LDH 作为催化剂前驱体
通过与贵金属纳米粒子复合方式能够提高LDH 材料的导电性能,但是纳米粒子通常在碱性氧析出反应过程中容易发生团聚,也容易出现被“毒化”现象,其稳定性能较差。为了提升催化剂材料催化活性并且保证其稳定性,还需要进一步摸索。研究发现,过渡金属氧化物、氮化物、硫化物、磷化物等在催化反应中具有更好的催化活性与稳定性。由于金属离子在LDH 表面上均匀分散,且层状结构特征独特,一定条件下能以LDH材料为前驱体制备相应的层状氧化物、氮化物、硫化物及磷化物。例如,楼雄文课题组[16]以金属有机骨架ZIF-67纳米立方体为模板,硝酸镍为刻蚀剂,在室温下合成了外部为Co Ni LDH,内部为ZIF-67的核壳结构,进一步磷化处理后,成功合成了含碳的镍钴双金属磷化物纳米盒子。这种设计充分展现了对结构和组分构成的优化调控,有效提高了材料的导电性,增大了电化学活性位点,相较于层状氢氧化物,NiCoP/C 展现出更优异的氧析出性能。同样,Chai等人[17]以Cu2O 纳米立方体为牺牲模板,经过刻蚀、磷化反应制备了镍-钴双金属磷化纳米盒子(图5)。当作为氧析出催化剂时,与Ni2P、CoP 和其他双金属磷化物相比,Ni0.6Co1.4P 纳米盒子由于其结构和组成优势对OER 显示出更强的电催化活性。
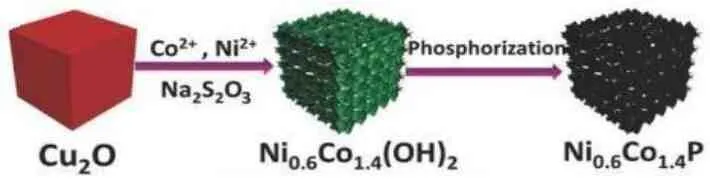
图5 Ni0.6Co1.4P纳米盒子制备示意图
通过离子液体的引入,构建了N、P、F 三元素掺杂的NiCo LDH[18],并通过在氨气氛围下高温煅烧得到双重氮化且表面具有P、F 双掺杂的PF/Co1.5Ni1.5N 棒状结构(图6)。在1.0 mol·L-1的KOH 溶液中,这种表面多原子掺杂的PF/Co1.5Ni1.5N表现出优异的OER 催化活性,其电流密度为10 m A·cm-2时相应的过电位为280 m V。研究表明NiCo LDH 层状结构进行氨化处理后得到相应的氮化物,Ni、Co金属元素与氮元素形成的M-N 键赋予其具有电阻小和耐腐蚀强的特性,因此相较于前驱体LDH 显示出优异的催化活性。
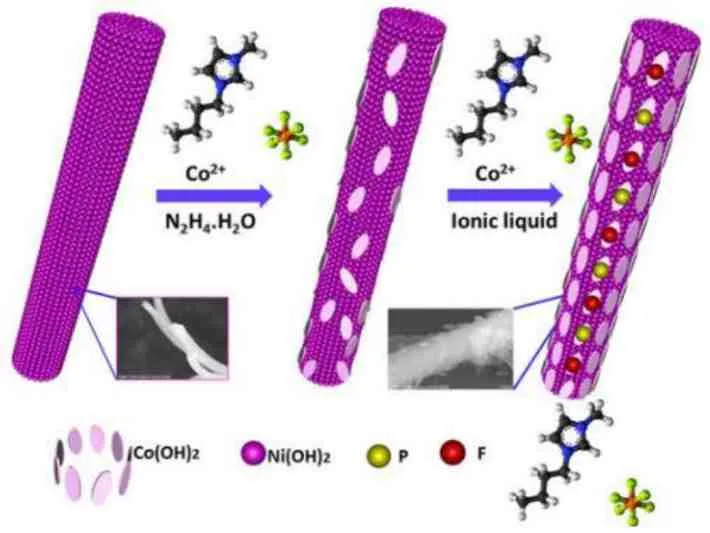
图6 PF/Co1.5Ni1.5N 纳米催化材料的合成示意图
4 展望与结语
本文从中学化学电解水实验出发,主要介绍了实际应用中电催化水分解反应的机理,探讨层状双金属氢氧化物(LDH)及其衍生物材料的开发设计,追踪其作为电极材料在催化电解水领域的研宄进展和成果,这些成果为中学化学的教学提供情境素材和思路。通过学习不同类型催化剂的设计策略,学生能够领悟到“科学探究与创新意识”在实际生产中重要性[19];结合国际发展趋势,运用“双碳”理念来支撑课堂教学,分析电催化方法在清洁能源转换领域中的机会和挑战,分享科学研究者们为社会进步发展所做出的贡献力量,加强了学生关注与化学有关的社会热点问题,认识环境保护和资源合理开发的重要性。同时,对于教师而言,通过构建化学前沿与基础化学理论间的相互联系,结合研究者们在电催化水分解领域的贡献,以此为教学情境来引导学生分析水的组成,观察宏观实验现象,应用微观观点来分析电解水的过程。在“一学一教”过程中,教师运用自身的知识和方法来综合分析化学对自然可能带来的各种影响,激励学生积极探讨与化学有关的社会决策问题,深刻理解化学、技术、社会和环境之间的相互关系,赞赏化学对社会发展的重大贡献,能够勇于承担责任,从而将化学核心素养贯穿整个课堂教学[20]。
