齐多夫定对小鼠糖脂代谢平衡的影响及作用机制
2022-07-02成丽媛郭笑言戈晓爱王丁丁
成丽媛,刘 薇,郭笑言,戈晓爱,王丁丁,王 涛*
(1中国药科大学药物科学研究院新药筛选中心,南京 210009;2南京市职业病防治院,南京 210042)
艾滋病,即获得性免疫缺陷综合征(AIDS),是世界范围内的重大感染性疾病,感染人数还在不断上升[1]。当前,各种抗病毒药物的合理治疗可获得良好的病毒抑制,多数艾滋病患的生活质量和存活时间均得到改善[2]。然而,现有抗病毒药物尚不能完全清除患者体内病毒,随着药物使用时间的延长,药物相关不良症状日益显著,如代谢综合征、糖尿病、慢性肝肾及骨骼疾病等[3-4],已成为影响艾滋病患者生存质量和预后的主要原因。
齐多夫定(AZT)是第一个被批准用于治疗AIDS 的核苷类逆转录酶抑制剂[5],也是抗人类免疫缺陷病毒感染的一线药物之一,但是长期用药所引起的机体代谢紊乱限制了其临床疗效发挥[6-7]。目前AZT的不良反应研究主要集中在线粒体毒性方面[8-10],AZT 可干扰线粒体DNA 的复制或抑制线粒体相关蛋白的合成而造成线粒体损伤[11],这可能是其诱发糖脂代谢的障碍和失衡的潜在机制。AZT 对于整体糖脂代谢平衡的作用特征及其靶器官目前尚不明确。
正常情况下,机体组织细胞可以利用葡萄糖、脂肪酸等多种能量物质代谢供能,可根据组织环境和能量物质的供应情况,在不同能量代谢底物之间切换[12],而线粒体则是维持和调节代谢平衡的核心细胞器[13]。基于AZT 诱发的临床代谢失衡症状和潜在的线粒体毒性特征,本研究采用正常小鼠长期给药,考察AZT 对整体糖脂代谢平衡的作用特征,同时探讨肝脏在AZT 所致线粒体毒性和糖脂代谢失衡中的靶器官角色,为其临床安全精准用药及不良反应防治提供实验依据。
1 材 料
1.1 药品与试剂
齐多夫定(CAS:A122924,纯度大于98%,阿拉丁试剂有限公司);胰岛素注射液(诺和灵30R,丹麦诺和诺德公司);RIPA 裂解液、BCA 蛋白浓度测定试剂盒(上海碧云天生物技术研究所);总RNA提取试剂,HiScript®Q RT SuperMix for qPCR(+gDNA wiper)逆转录试剂盒,AceQ®qPCR SYBR®Green Master Mix DNA 扩增试剂盒(南京诺唯赞生物科技有限公司);β-actin、葡萄糖转运蛋白(Glut2)、肉碱棕榈酸转移酶(Cpt1α)、中链酰基辅酶A 脱氢酶(Mcad)抗体(美国Proteintech 公司);Akt、P-Akt 抗体(美国Cell Signaling Technology 公司)。葡萄糖、甘油三脂检测试剂盒(南京建成生物科技有限公司);丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)血生化试剂盒(南京威特曼生物科技有限公司);非酯化脂肪酸检测试剂盒(日本Wako公司)。所用引物由上海英潍捷基公司合成。
1.2 仪 器
Legend Micro 21R 低温离心机,Varioskan Lux多功能微孔板读数仪,Nanodrop ND-2000超微量核酸蛋白测定仪,Applied Biosystems StepOneTM实时荧光定量PCR 仪(美国Thermo 公司);TL 系列中高通量组织细胞研磨破碎仪(北京鼎昊源科技有限公司);D1100-230V 恒温金属浴(美国Labnet 公司);PowerPac™HC 电泳仪电源,Gel Doc XR+凝胶成像仪(美国Bio-Rad 公司);BX53 生物显微镜(日本Olympus公司)。
1.3 动 物
SPF级雄性ICR小鼠,6~8周龄,体重18~22 g,购自河南斯克贝斯生物科技有限公司,生产许可证号SCXK(豫)2020-0005。所有动物实验均符合中国药科大学动物伦理委员会标准。
2 方 法
2.1 剂量设置及分组
24 只雄性ICR 小鼠随机分为3 组,每组8 只,分别为溶剂对照组(CON)、齐多夫定低、高剂量组(AZT-L、AZT-H)。齐多夫定给药组每天灌胃给予AZT 100,300 mg/kg,溶剂对照组灌胃给予相应体积的蒸馏水,连续12 周。给药结束后禁食12 h 摘眼球采血,颈椎脱臼处死小鼠,分离肝脏。
2.2 血清生化指标检测
12 周给药结束后,分别在禁食6 h 和12 h 后进行眼眶取血,将全血于200 μL 离心管中常温静置30 min 后,4 ℃,3 000 r/min 离心15 min,吸取上层血清至200 μL EP 管中,按血生化试剂盒说明测定血清葡萄糖(GLU)和甘油三酯(TG)水平。
2.3 糖耐量实验
给药结束前7 天,小鼠禁食不禁水12 h 后,灌胃给予2 g/kg 葡萄糖溶液。分别测定给予葡萄糖0,15,30,60,120 min 后小鼠的血糖,计算血糖浓度-时间曲线下面积(AUC)。
2.4 胰岛素耐量实验
给药结束前4天,小鼠禁食不禁水6 h后,腹腔注射0.75 U/kg 胰岛素注射液。分别测定给予胰岛素0,15,30,60,120 min 后小鼠的血糖,计算血糖浓度-时间AUC。
2.5 肝脏指数及肝脂检测
小鼠肝脏用生理盐水漂洗干净,滤纸吸干称重,计算肝脏指数,即肝脏占体重的质量分数。称取肝组织30 mg,加入磷酸盐缓冲液(PBS)研磨,使用BCA 法测定蛋白浓度,吸取肝匀浆上清液测定肝脏组织TG、非酯化脂肪酸(NEFA)水平。
2.6 肝脏病理学检测
取小鼠肝脏左叶中间部分,在4%中性甲醛中固定48 h,然后进行石蜡包埋、切片、脱蜡、苏木精-伊红(HE)染色,最后在显微镜下观察肝组织病理学形态变化。
2.7 Western blot检测相关蛋白表达
称取肝组织30 mg,加入RIPA 裂解液提取肝总蛋白,使用BCA法定蛋白,金属浴煮蛋白,-20 ℃保存变性蛋白。取等体积蛋白进行SDS-PAGE 凝胶电泳,在冰上恒流模式下进行转膜,5% BSA 封闭2 h,4 ℃孵育一抗过夜,一抗为Cpt1α、Mcad、Glut2、Akt、P-Akt 抗体。第2 天用TBST 洗膜,孵育二抗羊抗兔IgG 抗体1 h,再洗膜,采用化学发光法曝光。使用Image J进行蛋白条带的灰度分析。
2.8 RT-PCR检测相关基因表达
称取肝组织30 mg,加Trizol 裂解液1 mL 提取总RNA。使用超微量核酸蛋白测定仪检测RNA浓度,在逆转录仪上将RNA逆转录成cDNA。运用实时荧光定量PCR 法测定cDNA 样品中的Cpt1α、Mcad、Pepck、G6pase 和Glut2 的基因水平。选用βactin作为内参基因,引物序列如表1所示。
2.9 统计分析
使用GraphPad Prism 6.01 软件进行数据统计处理,实验结果以xˉ± s 表示。组间数据统计分析采用One-Way ANOVA 检验,P <0.05 为差异有统计学意义。

Table 1 Primer sequences for real-time quantitative PCR assay
3 结 果
3.1 齐多夫定对小鼠体重及肝脏系数的影响
如图1所示,各组小鼠在给药期间体重均有所上升,而各组间体重及肝脏指数均无明显差异。

Figure 1 Effect of zidovudine(AZT)on the body weight(A)and liver index(B)in mice(xˉ± s,n = 8)CON:Solvent control;AZT-L:Zidovudine(100 mg/kg);AZT-H:Zidovudine(300 mg/kg)
3.2 齐多夫定对小鼠血糖、血脂的影响
如图2血清生化结果显示,随着禁食时间的延长,对照组小鼠血清葡萄糖和甘油三酯水平都显著降低;与溶剂对照组相比,AZT给药对于禁食6 h与禁食12 h 血糖水平无明显影响(图2-A),但却显著抑制禁食12 h血清甘油三酯的降低(图2-B)。
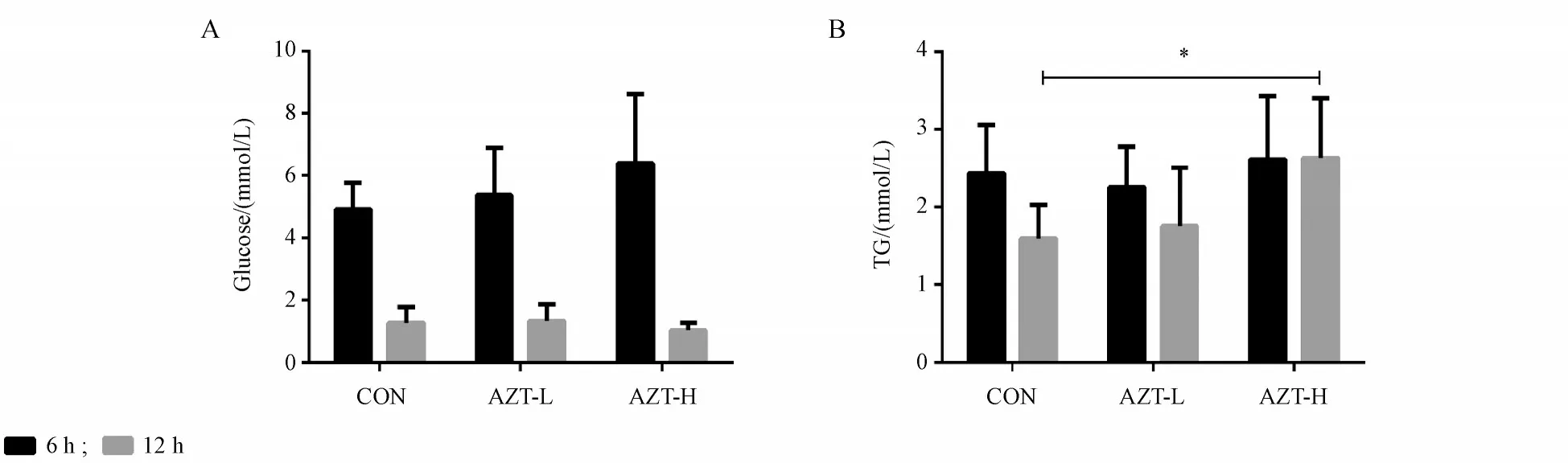
Figure 2 Effect of AZT on serum glucose(A)and triglyceride(TG)(B)in mice after fasting for 6 h or 12 h(xˉ± s,n = 8)*P <0.05
3.3 齐多夫定对小鼠糖耐量及胰岛素耐量的影响
如图3 口服糖耐量(OGTT)结果显示,溶剂对照组小鼠灌胃葡萄糖后,血糖在15 min 时达到最大值,之后逐渐下降,120 min 时恢复到基础水平。与对照组相比,低剂量组小鼠血糖无明显变化,而高剂量组小鼠在15 min 和30 min 的血糖明显高于对照组(图3-A)。计算AUC 发现,AZT 高剂量组可明显降低糖耐量水平(图3-B)。
胰岛素耐量(ITT)结果显示,溶剂对照组小鼠注射胰岛素后,血糖急速下降,在30 min 时降到最低,随后90 min 内肝脏糖异生增加使血糖恢复至基础水平。与对照组相比,AZT给药组可以剂量依赖性的增加胰岛素注射后30 min 内的降糖速率,然而,AZT 各剂量组血糖上升趋势明显被抑制,提示小鼠肝脏糖异生能力受损(图3-C)。结果显示AZT明显降低AUC水平(图3-D)。
3.4 齐多夫定对小鼠肝组织病理学的影响
肝脏HE 染色结果如图4 所示,溶剂对照组小鼠肝细胞结构完整,肝索排列整齐,AZT 高剂量组小鼠表现出肝细胞体积增大,胞浆淡染,而低剂量组对小鼠肝脏无明显影响。
3.5 齐多夫定对小鼠肝脏的影响
血清生化结果显示,AZT给药组呈剂量相关性的增加ALT、AST 水平,说明AZT 可导致肝脏受损(图5-A、B);肝脏组织TG、NEFA 指标明显升高,说明肝脏脂质蓄积(图5-C、D)。
3.6 齐多夫定对小鼠肝脏糖脂代谢基因表达的影响
PCR 结果如图6 所示,与溶剂对照组相比,AZT 给药后参与脂肪酸转运的关键酶Cpt1α 及脂肪酸β 氧化反应第一步的中链酰基辅酶A 脱氢酶(Mcad)基因表达剂量依赖性的下调。而糖代谢相关基因结果显示葡萄糖转运蛋白(Glut2)的基因表达上调,糖异生基因Pepck、G6pase表达呈剂量相关性的下调。结果表明AZT 导致肝脏脂肪酸氧化被抑制,能量缺乏导致糖酵解增强,同时糖异生过程被抑制。
3.7 齐多夫定对肝脏糖脂代谢相关蛋白表达的影响
如图7 所示,与溶剂对照组相比,AZT 给药组脂肪酸转运蛋白Cpt1α表达明显下调,与基因结果一致;Glut2、Mcad 及胰岛素信号通路相关蛋白表达无明显变化。
4 讨 论
新陈代谢是生命体的基本要素,既有整体的特征,也有组织细胞层面的机制。当疾病、损伤、药物等外界因素作用于机体代谢的某个过程,如果超过了机体自身调节能力,即表现为某些代谢失衡特征,甚至诱发多种代谢性疾病[14-15]。

Figure 3 Effect of AZT in oral glucose tolerance test(OGTT)(A)and insulin tolerance test(ITT)(B)(xˉ± s,n = 8)*P <0.05, ***P <0.001
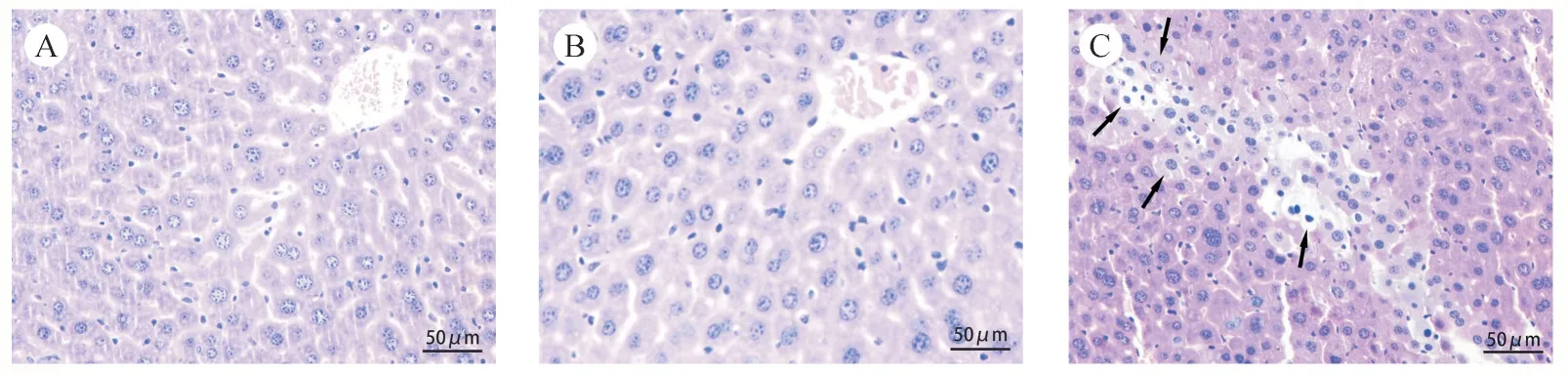
Figure 4 Effect of AZT on liver histopathology of mice(HE staining,×200)A:CON;B:AZT-L;C:AZT-H
葡萄糖是机体多数组织主要的能量代谢底物,也是多数代谢失衡病症的主要易损指标[17]。本实验中口服糖耐量结果显示,AZT高剂量组出现明显的糖耐量受损,提示机体对于外源性葡萄糖处置能力显著下降。胰岛素耐量结果显示,正常组小鼠血糖曲线先是经历30 min 的快速下降相,再出现90 min 的缓慢上升相,前者是外源性胰岛素的降糖作用,后者则是血糖降低继发的肝糖输出所致,其中肝糖异生发挥主要贡献。与正常小鼠相比,AZT 给药可使得血糖下降相的斜率更大,提示给药组胰岛素的血糖处置能力增强或者敏感性增加;同时血糖上升相接近消失,提示给药组肝脏糖异生作用被抑制。由此可见,AZT 长期给药一方面使得机体处置外源性葡萄糖能力(糖耐量实验)受损,另一方面却又使得胰岛素敏感性增强(胰岛素耐量实验)和肝脏糖异生减弱,表明AZT可损害机体葡萄糖代谢,但是对胰岛素介导的内源性糖代谢无不良影响。
脂肪酸作为另一种主要的能量物质,可与葡萄糖共同参与能量代谢供应,这即是机体代谢灵活性特征之一[18]。本实验中,通过检测禁食(能量匮乏)状态下小鼠血糖、血脂的水平,观察AZT 对糖脂代谢选择性的影响。随着禁食时间的延长,正常小鼠血清葡萄糖和甘油三酯水平都显著降低,表明机体在利用内源性的糖和脂代谢供能;AZT 长期给药对于内源性葡萄糖利用无明显影响,但却显著抑制甘油三酯的代谢利用,表明AZT损害小鼠对能量代谢底物的选择,影响了糖脂代谢平衡。

Figure 5 Effect of AZT on liver of mice(xˉ± s,n = 8)A:Alanine aminotransferase(ALT);B:Aspartate aminotransferase(AST);C:TG D:Non-esterified fatty acids(NEFA)*P <0.05, **P <0.01,***P <0.001

Figure 6 Effects of AZT on gene expression of glycolipid metabolism in mice(xˉ± s,n = 6)*P <0.05, ***P <0.001 vs CON group
线粒体是糖、脂等能量物质转化的主要场所,在糖脂代谢调节中发挥关键作用[19-20]。在富含碳水化合物的餐后,葡萄糖和胰岛素高时,葡萄糖摄取、糖酵解和丙酮酸氧化增加,脂肪酸氧化受到抑制。在禁食期间,Cpt1α 的活性增加,脂肪酸进入线粒体进行β 氧化[21-22],脂肪酸利用率的增加会抑制葡萄糖转运蛋白,阻碍葡萄糖的摄取和使用。肝脏是协调全身代谢的的主要器官,也是线粒体含量丰富的器官,在机体代谢调节中具有重要作用[23]。本实验中,AZT 给药组血清转氨酶水平升高,肝脏脂质含量(TG、NEFA)增加,提示肝细胞损害和脂质代谢障碍。AZT 给药组肝脏糖代谢基因表达明显上调,而脂肪酸氧化基因及糖异生基因表达明显下降。AZT 明显抑制Cpt1α 的蛋白水平,但对于糖代谢相关蛋白(Glut2、Mcad 及胰岛素信号通路)表达未见明显影响,提示AZT 长期给药导致肝脏脂肪酸转运受阻,不能通过脂肪酸β氧化来提供能量。由此可见,肝脏是AZT 诱发代谢失衡的潜在靶器官,而肝脏线粒体脂肪酸代谢障碍是其影响代谢平衡的潜在机制。
总之,AZT 长期给药可导致小鼠代谢失衡,主要表现为糖耐量受损和脂肪酸代谢障碍,肝脏是其重要的靶器官,其可能作用机制是通过下调脂肪酸氧化代谢及糖异生基因表达,从而导致肝脏脂质蓄积和糖脂代谢紊乱。机体糖脂代谢的调节是由多器官参与的,器官之间的交叉对话在能量稳态调节中也至关重要,后续研究可继续从代谢平衡调节着手,通过肌肉、脂肪、胰腺等多器官探讨,进一步阐释AZT导致代谢紊乱的机制。
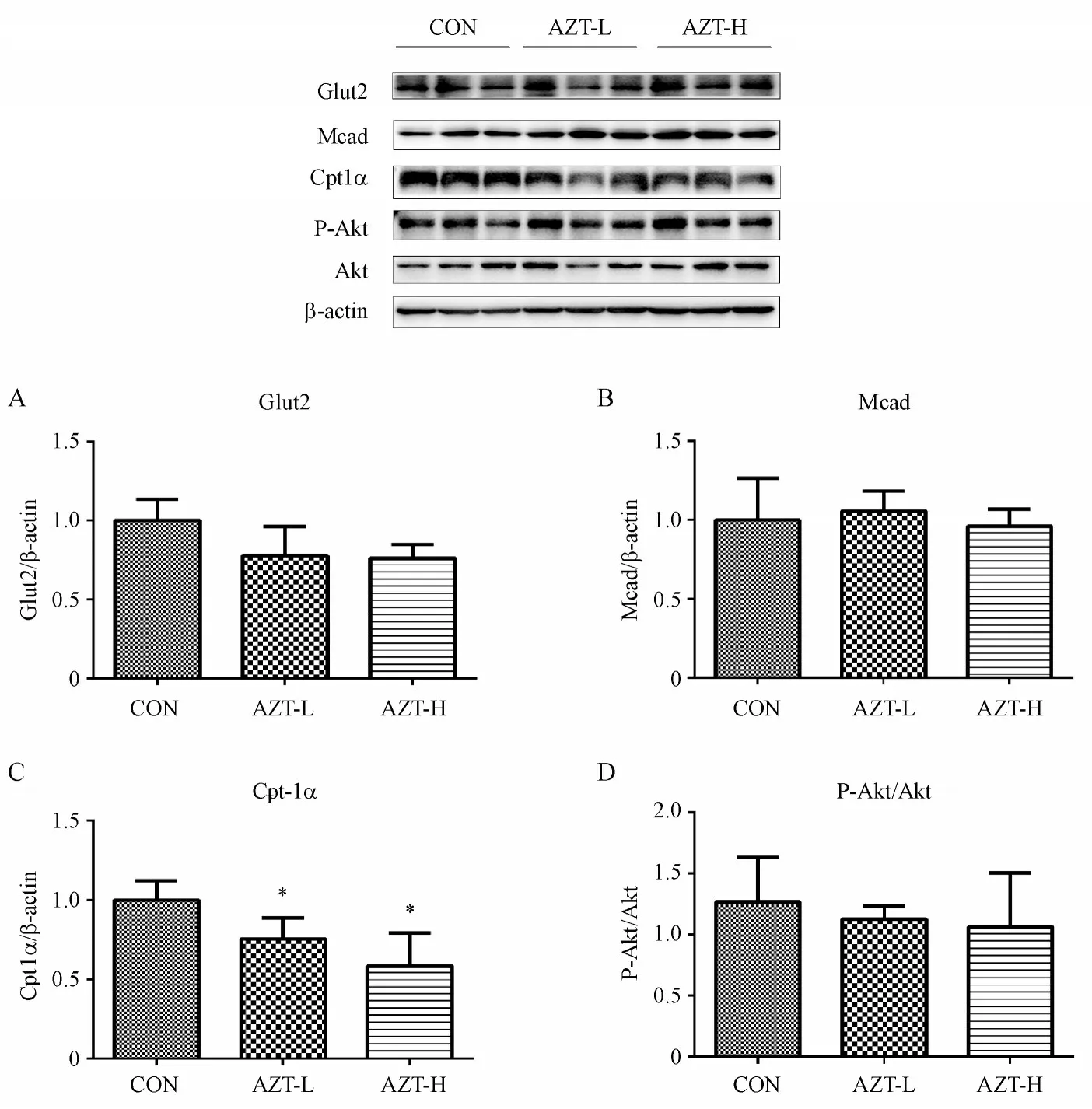
Figure 7 Effect of AZT on the expression of protein relative to glucose and lipid metabolism in mice (xˉ± s,n = 3)A:Glut2;B:Mcad;C:Cpt1α;D:P-Akt/Akt*P <0.05 vs CON group
