达沙替尼白蛋白胶束的制备与表征
2022-07-02汪文蝶周继源唐丽丹殷婷婕
汪文蝶,周继源,唐丽丹,殷婷婕**
(1南京医科大学附属常州第二人民医院药学部,常州 213000;2中国药科大学药学院药剂系,南京 211198)
达沙替尼(dasatinib,DAS)作为第二代酪氨酸激酶抑制剂,是一种非常有效的抑制白血病融合基因BCR-ABL 的分子靶向药物,对于治疗慢性骨髓性白血病(CML)和费城染色体阳性的急性淋巴细胞白血病(Ph+ALL)治疗效果显著[1]。近年来,DAS 相关临床实验研究表明,DAS 具有抑制多种实体瘤的增殖、防止肿瘤转移的作用[2],但其进入机体后不能特异性蓄积于肿瘤组织,因此在抗肿瘤的同时产生严重系统(如胃肠道、造血系统和淋巴系统)不良反应。已有报道DAS 与非疾病相关的细胞相互作用而引起严重的血液学和非血液学不良反应[3],导致临床上剂量减少或治疗中断,限制其在实体瘤治疗领域的临床应用。
为了提高DAS 的实体瘤靶向利用率,研究人员探索开发DAS 的新型纳米制剂,以期达到增效减毒的目的。但目前DAS 新制剂的相关报道较少,仅有纳米粒、脂质体、嵌段共聚物、聚合物前药,且前述已报道的新制剂均存在载药量低(均小于5%)的缺陷,限制了DAS 高效纳米制剂的研发进程[4-6]。
白蛋白具有良好的生物相容性、生物可降解性;同时有研究发现,DAS 与白蛋白具有一定的亲和力[7],提示基于白蛋白的纳米载体有荷载DAS的潜力。聚乙二醇(polyethylene glycol,PEG)由重复的氧乙烯基组成,其具有高度的亲水性。PEG 化的纳米制剂,可以降低胶束在体内递送药物过程中与血液蛋白质的结合率,能够有效避免载药胶束被体内单核巨噬细胞系统吞噬而清除[8],从而提升修饰型白蛋白纳米制剂的血循环时间,提高药物半衰期及其在肿瘤部位的蓄积。
本研究基于已设计合成的烷基化白蛋白[8],对其进行PEG 化修饰形成PEG-DSA,并评价其作为DAS 新型高效胶束载体的潜力。以圆二色谱、核磁共振氢谱、元素分析法、红外光谱等方法对载体进行了表征;同时采用单因素考察对PEG-DSA/DAS 胶束的制备工艺筛选优化,制得高载药量的目标制剂,并对其体外稳定性和释放行为进行了研究。
1 材 料
1.1 试 剂
牛血清白蛋白(bovine serum albumin,BSA)、十二醛、达沙替尼(上海阿拉丁生物科技有限公司);甲氧基-聚乙二醇3400-氨基琥珀酰亚胺琥珀酸酯(CH3O-PEG3400-NHS,上海芃硕生物科技有限公司);硼氢化钠(国药集团化学试剂有限公司);吐温80(南京威尔化工有限公司);其他试剂均为市售分析纯。
1.2 仪 器
PHS-3BW pH 计(南京晚晴仪器有限公司);LGJ-10A-50 冷冻干燥机、Beidi-ⅡYJ 超声波细胞粉碎机(南京贝蒂实验仪器有限公司);Perkin Elmer 2400 Ⅱ型有机元素分析仪(美国珀金-埃尔默公司);TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司);Zetasizer Nano ZS 纳米粒度仪、绝对分子量分析仪(英国马尔文仪器有限公司);Advance 500 型核磁共振波谱、TENSOR 27 型红外光谱仪(瑞士Bruker公司)。
1.3 统计学处理
使用GraphPad Prism 8.0 和Origin 2019 对数据进行分析处理,统计结果以xˉ± s表示,组间比较采用t检验。P <0.05认为具有统计学意义。
2 方 法
2.1 PEG-DSA载体的合成及表征
2.1.1 合 成 十二烷基白蛋白(DSA)载体按已报道的方法[8]合成。称取BSA 200 mg,溶于去离子水10 mL 中,缓慢滴入十二醛163 μL,室温搅拌反应0.5 h 后,滴加10%硼氢化钠(NaBH4)水溶液140 μL,继续搅拌12 h,稀盐酸调节反应溶液pH至中性,14 000 r/min冷冻离心20 min,0.8 μm滤膜过滤,除去不溶于水的十二醛和十二醇,将滤液置于透析袋中,pH 7.4的磷酸盐缓冲液(PBS)透析48 h,去离子水透析24 h,真空冷冻干燥制得白色固体DSA。随后取DSA 45 mg 溶于PBS(pH 7.4)5 mL中,向其中加入CH3O-PEG3400-NHS 15 mg,避光反应12 h,去离子水透析24 h后冷冻干燥。
2.1.2 圆二色谱测量(CD) 使用长度为1 cm 的1 mL 石英比色皿,在190 nm 至260 nm 的波长范围内,设置分辨率为0.2 nm,带宽为1.0 nm,扫描速度为100 nm/min,记录CD测量值。以nm为单位报告光谱,并计算α-螺旋(α-hexil)的百分比。通常测量蛋白质于208 nm 与220 nm 波长处CD 谱的变化,它的大小一般用平均残基摩尔椭圆率(MRE)来表示,可以通过公式(1)计算:
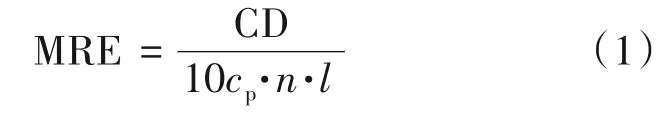
式中,n是氨基酸残基数目,l是杯子的路径长度,cp是摩尔浓度。
根据公式(2),通过计算208 nm 处的MRE 可以得到α-hexil的含量:

式中,MRE208是在208 nm 处观察到的MRE,4 000是208 nm 处无规卷曲和β 折叠的MRE;33 000 是208 nm处α-hexil的MRE。
2.1.3 核磁共振氢谱(1H NMR) 分别称取适量BSA、DSA、PEG-DSA 溶于D2O 中,利用核磁共振仪测定样品的1H NMR谱图。
2.1.4 红外光谱(FT-IR) 分别称取适量BSA、DSA、PEG-DSA,于红外灯下与适量KBr粉末混合,研磨,压片,并进行红外检测,记录FT-IR谱图。
2.1.5 元素分析 采用元素分析法分别测定BSA 和DSA 中C、H、N 3 种元素的摩尔分数,按照公式(3)计算DSA中十二烷基的取代度[8]:

式中,(C/N)BSA与(C/N)DSA分别表示BSA 与DSA 中碳原子氮原子的物质的量之比;13.36 是指BSA 分子中可反应氮原子(61)与总氮原子(815)物质的量之比[9]。
2.2 DSA/DAS,PEG-DSA/DAS 胶束的制备及处方优化
分别称取载体18 mg,溶于去离子水3 mL,另取DAS,溶于一定体积的有机溶剂中,并缓慢滴加至上述载体水溶液中,以800 r/min 转速搅拌10 min,以200 W 功率探头超声处理20 min,随后置于透析袋(相对截留分子质量为7 000),每隔4 小时更换去离子水2 L,共透析12 h,9 000 r/min离心10 min 后收集上清液即得载药胶束溶液。为制备最优的DSA/DAS,PEG-DSA/DAS载药制剂,采用单因素考察法比较达沙替尼的不同溶媒、载体和药物投料比以及载药浓度对上述两个载体载药量的影响。
2.2.1 溶 媒 固定载药溶媒的体积为100 μL,DAS 的投料量为5 mg,考察溶媒分别为二甲基亚砜(DMSO)和N,N-二甲基甲酰胺(DMF)时载体对DAS的荷载情况。
2.2.2 载体和药物投料比 固定载体的投料量为18 mg,分别考察DSA、PEG-DSA 与DAS 的质量比为8∶1,5∶1,4.5∶1,4∶1,3.6∶1,3∶1 时载体对DAS的荷载情况。
2.2.3 有机溶媒体积 固定DSA、PEG-DSA 与DAS 的投料比,考察有机溶媒体积分别为30,50,75,100 μL时两载体对DAS的荷载情况。
2.3 粒径分布及Zeta电位
分别取DAS 含量为1 mg/mL 的DSA/DAS 和PEG-DSA/DAS,25 ℃下测定两载药胶束的粒径,PDI及Zeta电位。
2.4 载药量和包封率
鉴于DAS 在水相介质中的溶解度极低,因此载药胶束溶液中游离的DAS 远远低于载入胶束疏水内核的量,故可忽略不计。取适量制备的载药胶束溶液,加入大量DMF 稀释至一定浓度,超声5 min 以破坏胶束结构,3 000 r/min 离心后收集上清液,紫外分光光度计测量其在323 nm 处的吸收度。计算包封率(EE,%)=载入胶束的DAS 量/DAS 投药量×100,以及载药量(DL,%)=载入胶束的DAS量/(载入胶束的DAS量+载体质量)×100。
2.5 体外稳定性评价
将DAS 含量为0.5 mg/mL 的DSA/DAS、PEGDSA/DAS 200 μL分别置于去离子水和含有10%胎牛血清(FBS)的PBS(pH 7.4)10 mL 中,在25 ℃下分别于1,2,4,6,10,12,16 h 取样并考察其粒径变化。
2.6 体外释放动力学
采用pH 为7.4 和5.0 两 种不同的PBS 作为释放介质以模拟机体生理环境和细胞内涵体/溶酶体环境,探究制剂体外释放行为。精密量取PEGDSA/DAS和DSA/DAS的10%FBS溶液(DAS浓度均为0.5 mg/mL)1 mL于相对截留分子质量为7 000的透析袋中,并置于含0.3%吐温80 的PBS(pH 7.4及pH 5.0)释放介质250 mL 中,温度设定为37 ℃,转速设定为100 r/min。在预设时间点1,2,3,4,6,8,10,12 h 时取出释放介质1 mL,并补充相同体积的新鲜释放介质。采用紫外分光光度计测量在323 nm处的吸收度,从而检测DAS的释放百分数。
3 结果与讨论
3.1 PEG-DSA载体的表征
3.1.1 CD解析 如图1所示,DSA和PEG-DSA的α-螺旋结构在222 和208 nm 处有负科顿(Cotton)效应,表现出两个负的肩峰谱带,在靠近192 nm 有一正的谱带。β 折叠的CD 谱在216 nm 有一负谱带,而在195 ~200 nm 有一正谱带,表明两个载体均保留了α-螺旋和β-折叠。通过“2.1.2”项中公式计算得出:BSA 的α-螺旋为39.8%,DSA 的α-螺旋为12.4%,PEG-DSA 的α-螺旋为13.5%。DSA与PEG-DSA的α-螺旋结构的百分比虽然较BSA的α-螺旋结构的百分比低,但从图中可以看出,其α-螺旋结构仍占主导,保留了BSA一定的生理活性。

Figure 1 Circular dichroism(CD)diagrams of BSA, DSA and PEGDSABSA: Bovine serum albumin; PEG: Polyethylene glycol; DSA: Dodecyl serum albumin
3.1.21H NMR 解析 如图2 所示,DSA 中的δ 1.24 和δ 0.84 处的峰分别归属于亚甲基氢和甲基氢[10]。PEG-DSA 中的δ 3.65 处为PEG 的亚甲基峰,在δ 1.24 和δ 0.84 其具有和DSA 同样的亚甲基氢和甲基氢。表明MAL-PEG3400-NHS 被成功引入,由此推断PEG-DSA已成功合成。
3.1.3 FT-IR 解析 在BSA 的红外图谱中(图3),可以观察到3 305 cm-1处的--OH 伸缩振动峰,2 960 cm-1处的甲基C-H 伸缩振动峰,2 937 cm-1处的亚甲基C--H 伸缩振动峰,1 658 cm-1处的酰胺Ⅰ带,1 537 cm-1处的酰胺Ⅱ带。DSA 为BSA 接上十二醛并还原后的结构,接枝上的基团为--CH2,--CH3,该结构在BSA 中已存在,所以其红外峰与BSA 基本一致。在PEG-DSA 的图谱中,1 107 cm-1处可见PEG 中--C--O--C--的对称伸缩振动峰,表明CH3O--PEG3400-NHS 的成功接入,结合核磁共振氢谱的数据,辅助证明PEG-DSA的成功合成。

Figure 2 1H NMR spectrum of BSA,DSA and PEG-DSA
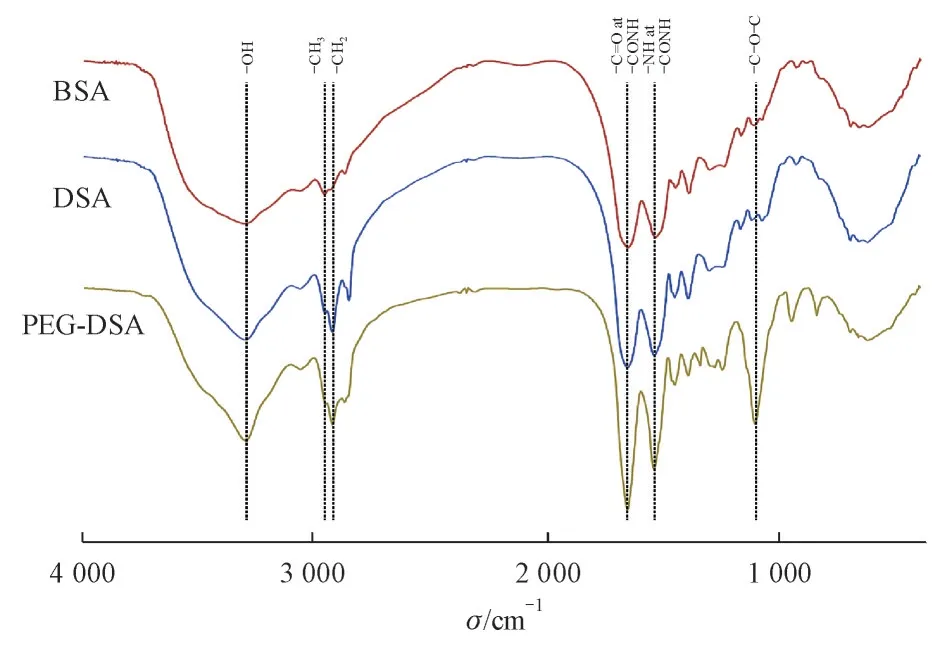
Figure 3 FT-IR spectrum of BSA,DSA and PEG-DSA
3.1.4 元素分析 如表1 所示,元素分析实验结果表明,DSA 结构中氨基上的十二烷基取代度为29.63%。
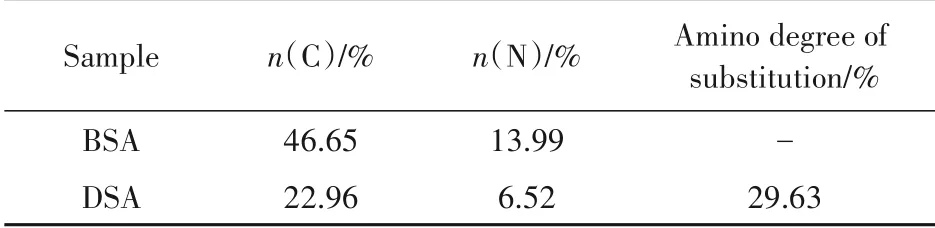
Table 1 Elemental composition of BSA and DSA
3.2 DSA/DAS,PEG-DSA/DAS 胶束的制备及处方优化
3.2.1 溶 媒 如表2、表3 所示,使用DMSO 或DMF所制得的DSA/DAS和PEG-DSA/DAS的载药量和包封率无显著性差异(P >0.05)。因此,两载体皆选择DMF为药物的溶媒进行下述的工艺优化。

Table 2 Effect of the organic solvents on loading capacity of DSA micelles for dasatinib(DAS)(xˉ± s,n = 3)

Table 3 Effect of organic solvents on loading capacity of PEG-DSA micelles for DAS(xˉ± s,n = 3)
3.2.2 载体和药物投料比 如表4、表5 所示,分别对DSA 和PEG-DSA 的载药工艺进行筛选,当载体和药物投料比为8∶1 ~4∶1 时,载药量和包封率随着载体和药物投料比的降低而升高,而当载体和药物投料比降低至3.6∶1 ~3∶1 时,载药量和包封率却呈下降趋势,这表明此时载体对DAS 的包载已达到饱和。综合考虑,确定DSA 与DAS 最佳投料比为3.6∶1,DSA 与PEG-DAS 最佳投料比为4∶1。该处方工艺下,载药量和包封率均最高,且载药量均超过10%,改善了DAS 载药量低的难题。
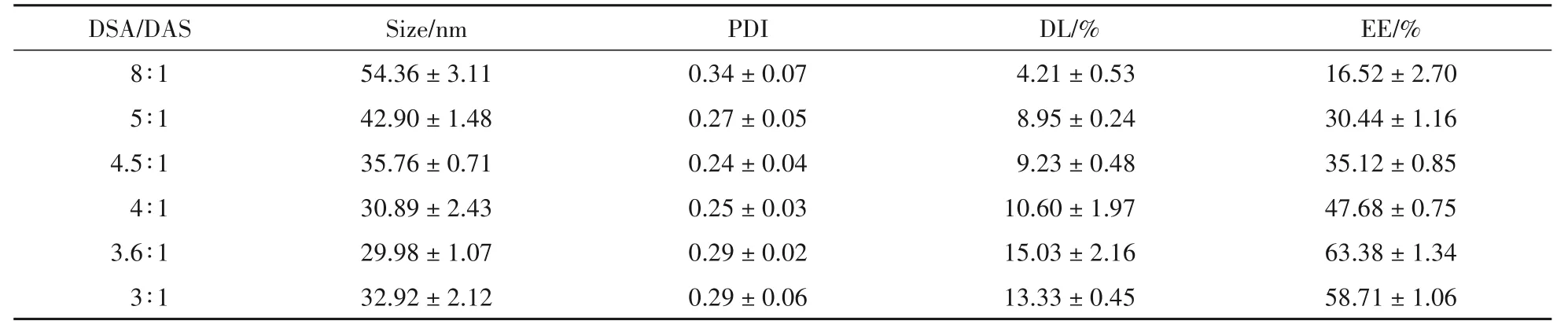
Table 4 Effect of feed mass ratio of DAS to DSA on loading capacity of micelles for DAS (xˉ± s,n = 3)

Table 5 Effect of feed mass ratio of PEG-DAS to DSA on loading capacity of micelles for DAS(xˉ± s,n = 3)
3.2.3 有机溶剂体积 如表6、表7 所示,当有机溶剂体积为30 μL 时,两载体对DAS 的荷载能力差,且粒径最大;当有机溶剂体积为50 μL,对DAS的荷载能力最强,粒径及PDI较为理想。故选择使用有机溶剂50 μL进行两载体载药的制备。
综上所述,筛选的最佳载药工艺如下:称取DSA 或PEG-DSA 18 mg,加去离子水3 mL 溶解形成胶束溶液;另取DAS 5 mg 或4.5 mg,超声,涡旋溶解于DMF 50 μL 中,并缓慢滴加至上述胶束溶液中,剧烈搅拌10 min,冰浴下探头超声20 min,去离子水透析12 h,9 000 r/min 离心10 min,分别制得DSA/DAS或PEG-DSA/DAS。

Table 6 Effect of volume of DMF on loading capacity of DSA micelles for DAS (xˉ± s,n = 3)

Table 7 Effect of volume of DMF on loading capacity of PEG-DSA micelles for DAS(xˉ± s,n = 3)
3.3 粒径分布及Zeta电位
最佳工艺下制备的DSA/DAS 胶束粒径为(29.98 ± 1.07)nm,PDI 为0.29 ± 0.02,Zeta 电位为(-18.27 ± 0.21)mV。最佳工艺的PEG-DSA/DAS 胶束粒径为(37.21 ± 0.21)nm,PDI 为0.24 ±0.04,Zeta电位为(-15.68±0.19)mV。
3.4 载药量和包封率
按照“2.4”项中的公式计算可得,DSA/DAS 最优处方的制剂载药量为(15.03± 2.16)%,包封率为(63.38 ± 1.34)%。PEG-DSA/DAS 最优处方的载药量为(10.22 ± 0.34)%,包封率为(42.73 ±1.15)%。两载体载药量均超过10%并远高于文献报道水平。PEG-DSA/DAS 的载药量和包封率低于DSA/DAS 的原因可能是由于PEG 的接枝,使得DSA载体的水化面积增大,导致DAS的负载减少。
3.5 体外稳定性评价
为了研究胶束的稳定性,考察了纯水环境以及模拟生理条件下,胶束粒径随时间的变化规律。如图4所示,胶束在16 h内粒径没有显著变化。但在含血清条件下DSA/DAS 胶束稳定性略低于PEG-DSA/DAS,可能是由于缺乏PEG 对生物成分的抗干扰作用,进一步的PEG 修饰有利于药物经体内运输至肿瘤部位从而发挥药效。
3.6 体外释放动力学
如图5所示,在pH 7.4生理环境下,PEG-DSA/DAS 中DAS 在前4 h 释放较为缓慢,在8 h 后进入平台期,12 h 累积释药百分率为75.63%;而在pH 5.0 细胞内涵体/溶酶体环境下释放加快,8 h 后进入平台期,12 h累积释药百分率92.91%,推测可能是由于酸性条件DAS 释放加快,DAS 的化学结构中存在-NH-氨基官能团,在低pH 条件下质子化,从而降低其疏水性,提高亲水性。PEG-DSA/DAS在pH 7.4和5.0条件下药物释放速率均低于DSA/DAS,DSA/DAS 组在8 h 处几乎完全释放,这表明PEG 可在生理条件下一定程度提高制剂稳定性,尤其可降低药物在循环过程中的突释。
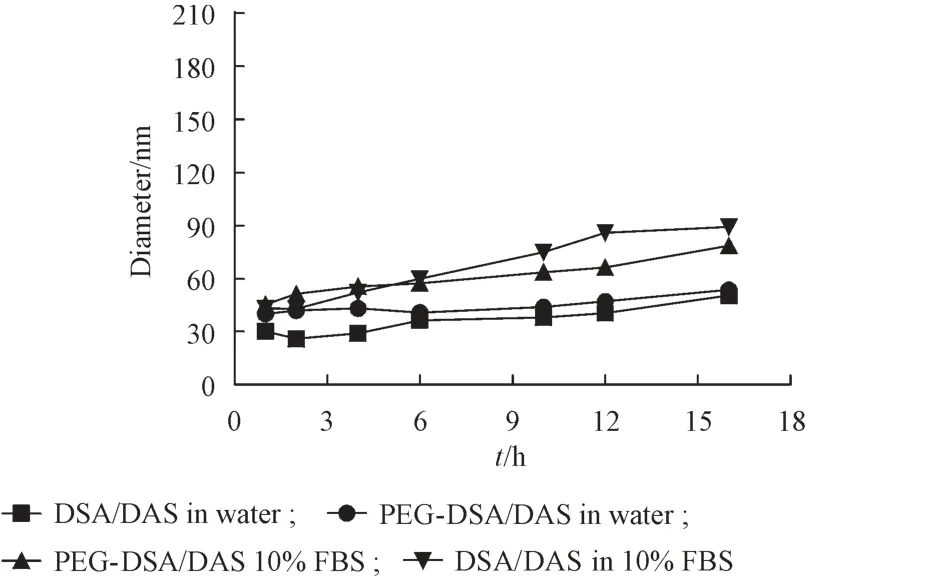
Figure 4 Time-dependent size changes of DSA/DAS and PEG-DSA/DAS in various medium(xˉ± s,n = 3)
4 讨 论
本研究利用希夫碱反应在BSA 的氨基上共价修饰十二醛并还原后制得十二烷基白蛋白,并对剩余的氨基进行酰胺化反应接枝PEG,构建两亲性蛋白偶联物PEG-DSA。DAS 为疏水性药物,并且和白蛋白有一定的亲和力,能够被包载于PEGDSA 胶束的疏水内核中,形成载DAS 的纳米胶束。相较于DSA/DAS,PEG-DSA/DAS 可通过PEG 的水化层进一步抵抗生物干扰,具有延长制剂血循环的潜能。
PEG-DSA 作为DAS 的递送载体,既实现DAS的有效增溶,又有望提升DAS 在肿瘤部位的靶向蓄积;其合成工艺简单,条件温和,能够保留白蛋白的部分生理学活性,具有出色的DAS 荷载能力(载药量高达10.22%),且目标载药制剂粒径及分布符合静脉注射要求,稳定性良好。本研究为DAS新型肿瘤靶向制剂的研制提供了依据。
