SNP-9对Aβ25-35导致bEnd.3细胞损伤的作用及其机制
2022-07-02姚思远高向东
孟 悦,姚思远,高向东,陈 松
(中国药科大学生命科学与技术学院江苏省生物药物成药性研究重点实验室,南京 211198)
阿尔茨海默病(Alzheimer′s disease,AD)是一种常见的神经系统变性疾病,重症AD 可能伴随吞咽障碍、肺炎、器官衰竭等并发症,带来巨大的社会和经济负担[1]。AD 是一种多因素、异质性的疾病,其主要病理特征是β 淀粉样蛋白(β-amyloid protein,Aβ)沉积和tau 磷酸化造成的神经元纤维缠结[2],近年来,对AD中脑血管功能的研究受到越来越多关注,AD 早期可能已出现脑血管功能障碍和血脑屏障(blood-brain barrier,BBB)损伤[3-5]。
作为一种选择通透性的屏障,BBB 可以防止体循环中的微生物、毒素等有害物质进入脑组织,同时帮助脑组织和血液交换营养物质和气体,对维持脑内环境稳态至关重要[6-7]。脑内皮细胞之间的紧密连接(tight junctions,TJs)和黏附连接诱导了高跨内皮电阻、低细胞旁路和跨细胞渗透,TJs包括occludin、claudins 和ZOs,黏附连接包括钙黏蛋白、血小板内皮细胞黏附分子和连接黏附分子[8]。AD患者的神经血管单元具有BBB渗透性增加、脑血管形态和功能异常、脑血流量减少等特点[9]。Aβ 可以通过受体介导的主动转运进出BBB,LRP1 受体介导Aβ 从大脑流出到外周,而RAGE 受体促进Aβ 流入大脑,AD 病理诱导的高RAGE 可以促进Aβ 在BBB 的转运,增加脑内积累[10]。并且RAGE 与Aβ 相互作用刺激促炎性细胞因子的活化,释放ROS,进一步造成神经元损伤和BBB 功能障碍[11]。炎症因子、RAGE、TJs等成分成为评估AD中BBB损伤的重要指标[12]。
目前治疗AD 的药物主要靶向N-甲基-D-天冬氨酸受体或乙酰胆碱酯酶,例如美金刚、多奈哌齐和加兰他敏等[13],但它们大多难以治愈AD[14],防治AD 亟需研发新型药物。本课题组前期报道了丝素蛋白水解物(silk fibroin hydrolysate,SFH)具有神经细胞保护活性[15-16],并从SFH 中分离、鉴定及合成了一系列具有神经保护活性的多肽SNPs(silk-derived neuroprotective peptides),其中SNP-9在多种AD 模型中均显示了良好的药物疗效,但是其对AD 模型中BBB 损伤的作用及分子机制仍不明确。
本研究使用Aβ25-35损伤bEnd. 3 细胞建立AD损伤模型,研究SNP-9 对该模型TJs 和炎症因子表达的影响,进一步检测bEnd. 3 细胞RAGE 的表达以及相关的NF-κB 通路的激活情况,从而分析SNP-9 对AD 中内皮细胞的影响,为SNP-9 对AD 中BBB的影响及作用机制提供理论依据。
1 材 料
1.1 试 剂
胎牛血清、DMEM 高糖培养基(美国Gibco 公司);MTT、氨苄青霉素、链霉素(中国Biosharp 公司);Aβ25-35(中国吉尔生化有限公司);SNP-9(序列为GSGAGAGSGAGAGSGAGSGSGA,南京金斯瑞生物科技有限公司);RIPA 细胞裂解液、BCA 蛋白浓度检测试剂盒、一抗稀释液、5 × 蛋白上样缓冲液(中国碧云天生物技术有限公司);RNA 纯化试剂盒(北京全式金生物技术有限公司);蛋白预染Marker、蛋白酶和磷酸酶抑制剂(美国Thermo 公司);脱脂奶粉(美国Bio-Rad 公司);5 × HiScriptⅡqRT SuperMix Ⅱ、2 × ChamQ Universal SYBR qPCR Master Mix、ECL 试剂盒(南京诺唯赞生物技术有限公司);PVDF 膜(美国Millipore 公司);胰蛋白酶、β-巯基乙醇(美国Sigma 公司);β-actin 抗体、TNF-α 抗体、RAGE 抗体、磷酸化NF-κB 抗体、NFκB抗体、IκBα抗体(中国Abclonal公司);HRP标记的山羊抗兔IgG(美国Cell Signaling Technology 公司);其他试剂均为市售分析纯。
1.2 仪 器
二氧化碳细胞培养箱、高速冷冻离心机、全波长酶标仪、PCR 仪、QuantStudioTM3 Real-Time PCR仪、NanoDrop 2000C 超微量分光光度计(美国Thermo 公司);电泳仪、转膜仪(美国Bio-Rad 公司);多功能凝胶成像系统(中国Tanon 公司);倒置相差显微镜(日本Olympus 公司);旋涡混合仪(中国大龙仪器公司)。
1.3 细 胞
小鼠脑微血管内皮细胞bEnd.3细胞来源于美国菌种保存中心(ATCC)。
2 方 法
2.1 细胞培养
bEnd. 3 细胞使用含10% Gibco 血清的DMEM培养,于5%CO2、37 ℃的培养箱中培养至汇合度达到70%~80%时进行实验。
2.2 Aβ25-35寡聚体的制备
使用分析天平称取Aβ25-356 mg,加入双蒸水6 mL 涡旋溶解,在超净台中用0.22 μm 微孔滤膜过滤后置于37 ℃恒温寡聚5 d,BCA 法检测Aβ25-35的浓度,于-20 ℃存放。
2.3 Aβ25-35损伤bEnd.3细胞模型的建立
取70% ~80%汇合度的bEnd. 3 细胞,用胰酶消化成细胞悬液,以每毫升5 × 104个细胞的密度铺于96 孔板中。待细胞贴壁后,将不同浓度的Aβ25-35(0.003 1,0.006 3,0.013,0.025,0.05,0.1,0.2,0.4 μmol/L)与bEnd. 3 细胞孵育24 h。MTT 法 检 测 细 胞 活 力:24 h 后 每100 μL 培 养基 加 入5 mg/mL MTT 溶 液10 μL,在5% CO2、37 ℃培养箱中孵育3 ~4 h 后,吸出培养基,每孔加入二甲亚砜150 μL,500 r/min 摇板10 min,用酶标仪检测吸收度,检测波长为570 nm,参比波长为630 nm。
2.4 SNP-9对Aβ25-35损伤bEnd.3细胞的影响
分别在Aβ25-35存在和不存在的情况下,bEnd.3细胞与不同浓度SNP-9(50,100,200,400 μmol/L)孵育24 h后,通过MTT法检测细胞活力。
2.5 RT-qPCR 法检测细胞ZO-1、occludin 和claudin-5 mRNA水平
取70% ~80%汇合度的bEnd.3 细胞,以每毫升4 × 105个细胞的密度铺于6 孔板中,分为空白组、Aβ25-35组、Aβ25-35+ SNP-9 组。给药24 h 后用RNA 纯化试剂盒提取细胞总RNA:弃去培养基,加入含有β-巯基乙醇的裂解液裂解细胞并灭活RNase,均质化后收集于无RNase 的离心管中,11 200 r/min 离心5 min,取上清液加等体积70%乙醇沉淀核酸,涡旋混匀并加入离心柱中,使RNA 与硅胶膜结合;先后加入DNase 和洗液去除DNA、蛋白和盐离子污染;将离心柱置于新的无RNase的离心管中,加入无RNase 水30 ~100 μL,静置1 min;11 200 r/min 离心2 min,收集RNA,NanoDrop 检测RNA浓度。
逆转录反应体系:取5 × HiScript ⅡqRT SuperMix Ⅱ8 μL,取RNA 4 ng,用无RNase 水补至40 μL。逆转录反应条件:55 ℃逆转录15 min;85 ℃灭活逆转录酶5 s。RT-qPCR 反应体系:每孔加上游和下游引物各1.5 μL,荧光染料2×ChamQ Universal SYBR qPCR Master Mix 5 μL,cDNA 2 μL。RT-qPCR 反应条件:95 ℃预变性30 s;95 ℃、10 s,60 ℃、30 s,进行40个循环;溶解曲线条件为95 ℃、15 s,60 ℃、1 min,95 ℃、15 s。结果用2⁻ΔΔCT法进行定量分析。引物序列见表1。

Table 1 Primer sequences of RT-qPCR
2.6 Western blot 法检测细胞中TNF-α、磷酸化NF-κB、NF-κB、IκBα、RAGE蛋白的表达水平
在6 孔板中造模给药24 h 后,弃去培养基,用PBS 洗3 次,每孔加含蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液100 μL 裂解细胞。将裂解液收集到离心管中,置于冰上裂解,每5 min 涡旋1 次,共5 次。4 ℃、12 000 r/min 离心20 min,收集上清液,BCA 法检测蛋白浓度。将样品浓度调至相同后制样,加入5 ×蛋白上样缓冲液后95 ℃金属浴10 min。在SDS-PAGE 胶中上样,80 V 恒压电泳。电泳结束后取下SDS-PAGE 胶,按海绵、滤纸、SDSPAGE 胶、活化的PVDF 膜、滤纸、海绵的顺序排列并夹紧,湿法300 mA 恒流转模,使用脱脂奶粉封闭2 h,TBST 缓冲液洗3 次,分别孵育β-actin、TNFα、磷酸化NF-κB、NF-κB、IκBα、RAGE 兔源一抗过夜。次日用TBST 缓冲液洗5 次,孵育HRP 标记的山羊抗兔二抗2 h,TBST 缓冲液洗5 次后加ECL 发光液曝光。
2.7 统计分析
实验结果采用GraphPad Prism 8.0 软件分析处理,结果以xˉ± s 表示,以One-way ANOVA 检验各组间的显著差异,P<0.05代表具有统计学差异。
3 结 果
3.1 Aβ25-35损伤bEnd.3细胞模型的建立
用含1% Gibco 血清的DMEM 将Aβ25-35稀释成一定浓度梯度(0.003 1,0.006 3,0.013,0.025,0.05,0.1,0.2,0.4 μmol/L)的溶液,孵育细胞24 h后MTT 实验检测细胞活力。结果如图1 所示,Aβ25-35处理导致bEnd. 3 细胞的活力降低,且具有浓度依赖性,后续选择0.05 μmol/L 做为实验的损伤浓度。

Figure 1 Effects of different concentrations of Aβ25-35 on bEnd. 3 cell viability(xˉ± s,n = 6)***P <0.001
3.2 SNP-9对bEnd.3细胞活力的影响
用含1% 胎牛血清的DMEM 将SNP-9 稀释成一定浓度梯度(50,100,200,400 μmol/L)的溶液,孵育细胞24 h 后MTT 实验检测细胞活力。结果如图2 所示,单独加入不同浓度SNP-9 对bEnd. 3 细胞的活力没有显著影响。

Figure 2 Effects of different concentrations of SNP-9 on bEnd. 3 cell viability(xˉ± s,n = 6)ns:No significance
3.3 SNP-9对Aβ25-35损伤bEnd.3细胞模型的影响
SNP-9(50,100,200,400 μmol/L)与0.05 μmol/L Aβ25-35溶液共孵育bEnd. 3 细胞,24 h 后MTT法检测细胞活力。结果如图3所示,100,200,400 μmol/L SNP-9 溶液均在一定程度上缓解了0.05 μmol/L Aβ25-35溶液造成的细胞活力下降,证明了SNP-9 具有抵抗Aβ25-35对bEnd.3 细胞损伤的作用,其中200 μmol/L SNP-9 溶液可显著缓解Aβ25-35造成的细胞损伤,且单独孵育200 μmol/L SNP-9 对细胞活力无显著影响,因此本研究选择200 μmol/L作为后续实验的浓度。

Figure 3 Effects of Aβ25-35 and different concentrations of SNP-9 on bEnd.3 cell viability(xˉ± s,n = 6)###P <0.001 vs control group;*P <0.05 vs Aβ25-35 group
3.4 SNP-9及Aβ25-35对bEnd.3细胞ZO-1、occludin和claudin-5 mRNA水平的影响
实验分为3 组:空白组,0.05 μmol/L Aβ25-35组以及0.05 μmol/L Aβ25-35+ 200 μmol/L SNP-9 组。孵育bEnd. 3 细胞24 h 后提取细胞总RNA,逆转录成cDNA 并 通 过RT-qPCR 法检测3 种TJs:ZO-1、occludin 和claudin-5 mRNA 水平。结果如图4所示,Aβ25-35降低了3 种TJs 的mRNA 水平,而SNP-9 缓解了Aβ25-35造成的mRNA 水平异常,证明了SNP-9可以缓解Aβ25-35损伤bEnd.3细胞TJs水平的减少。
3.5 SNP-9 及Aβ25-35对bEnd.3 细胞TNF-α 蛋白水平的影响
实验分为3 组:空白组,0.05 μmol/L Aβ25-35组以及0.05 μmol/L Aβ25-35+ 200 μmol/L SNP-9 组。孵育bEnd.3 细胞24 h 后提取细胞总蛋白,Western blot法检测细胞TNF-α蛋白的水平。结果如图5所示,SNP-9 可以减少由Aβ25-35造成的TNF-α 水平异常升高,证明了SNP-9 可在一定程度上缓解Aβ25-35诱导的炎症,其可能通过缓解炎症进而发挥保护内皮细胞及BBB的作用。
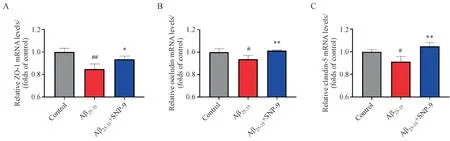
Figure 4 Effects of SNP-9 and Aβ25-35 on the mRNA levels of ZO-1,occludin and claudin-5 in bEnd.3 cells(xˉ± s,n = 3)A: Detection of relative mRNA levels of ZO-1 by RT-qPCR; B: Detection of relative mRNA levels of occludin by RT-qPCR; C: Detection of relative mRNA levels of claudin-5 by RT-qPCR#P <0.05,##P<0.01 vs control group; *P <0.05,**P <0.01 vs Aβ25-35 group

Figure 5 Effects of SNP-9 and Aβ25-35 on the protein levels of TNF-α in bEnd.3 cells(xˉ± s,n = 3)A:Detection of protein levels of TNF-α by Western blot;B:Quantitative analysis of protein levels of TNF-α##P <0.01 vs control group; *P <0.05 vs Aβ25-35 group
3.6 SNP-9 及Aβ25-35 对bEnd. 3 细胞磷酸化NFκB、NF-κB、IκBα蛋白水平的影响
实验分为3 组:空白组、0.05 μmol/L Aβ25-35组以及0.05 μmol/L Aβ25-35+ 200 μmol/L SNP-9 组。孵育bEnd.3 细胞24 h 后提取细胞总蛋白,Western blot 法检测细胞磷酸化NF-κB、NF-κB、IκBα 蛋白的水平。结果如图6 所示,SNP-9 可以缓解Aβ25-35造成的NF-κB磷酸化升高和IκBα蛋白水平的异常降低,证明了SNP-9具有缓解Aβ25-35诱导的IκBα降解以及NF-κB异常激活的作用。

Figure 6 Effects of SNP-9 and Aβ25-35 on the protein levels of p-NF-κB,NF-κB and IκBα in bEnd.3 cells(xˉ± s,n = 3)A:Detection of protein levels of p-NF-κB,NF-κB and IκBα by Western blot;B:Quantitative analysis of protein levels of p-NF-κB/NF-κB;C:Quantitative analysis of protein levels of IκBα#P <0.05 vs control group; **P <0.01 vs Aβ25-35 group
3.7 SNP-9 及Aβ25-35对bEnd.3 细胞RAGE 蛋白水平的影响
实验分为3 组:空白组、0.05 μmol/L Aβ25-35组以及0.05 μmol/L Aβ25-35+ 200 μmol/L SNP-9 组。孵育bEnd.3 细胞24 h 后提取细胞总蛋白,Western blot法检测细胞RAGE 蛋白的水平。结果如图7所示,SNP-9 可以缓解Aβ25-35造成的RAGE 蛋白水平异常升高,说明SNP-9 可能通过降低Aβ25-35损伤bEnd.3细胞中RAGE水平进而发挥保护作用。

Figure 7 Effects of SNP-9 and Aβ25-35 on the protein levels of RAGE in bEnd.3 cells(xˉ± s,n = 3)A:Detection of protein levels of RAGE by Western blot;B:Quantitative analysis of protein levels of RAGE#P <0.05 vs control group; **P <0.01 vs Aβ25-35 group
4 讨 论
TJs 是BBB 的重要组成部分,其中claudins 和occludin 是含有4 个跨膜结构域的跨膜蛋白,ZOs结合claudins 和occludin 细胞内结构域的PDZ 基序,并与肌动蛋白细胞骨架相连,保证TJs 的结构完整性[17]。在AD 患者脑内,存在claudins和occludin 的减少,并与不溶性Aβ 沉积有显著相关性[18],这证明了TJs损伤在AD 诱导的BBB 损伤中发挥重要作用。本研究中SNP-9 缓解了Aβ25-35导致的内皮细胞TJs 损伤,说明其具有在AD 中保护BBB 的作用。IL-1β、IL-6、TNF-α 等多种炎症因子可以诱导BBB 的破坏和TJs 下调或变性[19]。其中,TNF-α是最重要的促炎因子之一,可以由内皮细胞释放,并通过结合内皮细胞上的TNF-α 受体损伤BBB[20]。炎 症 损 伤 可 以 诱 导TJs mRNA 水 平 下调[21-22],TNF-α 还可以下调claudin-5 的启动子活性[23]。本研究中SNP-9 可能通过缓解Aβ 诱导的TNF-α水平异常,从而阻止TNF-α导致的TJs下调。TNF 家族的细胞因子可以通过NIK 和TAK1 激活NF-κB[24],NF-κB 也可以诱导TNF-α 的转录[25]。NF-κB 作为一种快速诱导的转录因子,在调节炎症、凋亡、氧化应激等多种生理反应中发挥重要作用[26]。经典NF-κB 复合物由p65 和p50 组成,未激活时与抑制蛋白IκBα 结合。NF-κB 的激活受IKK复合物调节,IKK 可以磷酸化IκBα,诱导其泛素化降解,从而释放NF-κB,诱导下游基因的转录[27-28]。RAGE 可以通过与Aβ 结合,激活NF-κB 通路,诱导炎症[29],最终造成TJs 破坏。本研究中SNP-9 可能通过调控RAGE,缓解NF-κB 异常激活,减少炎症因子TNF-α表达。
本研究分析了SNP-9 对Aβ25-35损伤bEnd. 3 细胞的作用及其机制,SNP-9 可能通过影响RAGE/NF-κB 信号通路,降低炎症因子TNF-α 的表达水平,缓解Aβ 导致的TJs 异常,进而在一定程度上改善Aβ 诱导的BBB 损伤。本研究为SNP-9 治疗AD及AD中BBB损伤的研究提供了实验依据,为SNP-9的应用提供了理论依据。
