红树植物内生真菌的分离与多样性
2022-07-02曾志浩袁宗胜黄晓南刘芳
曾志浩 袁宗胜 黄晓南 刘芳
摘要 选取红树植物秋茄(Kandelia candel)、桐花树( Aegiceras corniculatum )、白骨壤(Avicennia marina)为研究对象,分别采集红树植物的根、茎、叶部组织,分离各组织的内生真菌,提取DNA,通过PCR扩增后进行ITS鉴定。结果显示:从红树植物样本中共分离出139株内生真菌,分属于7纲15目17科32属。从秋茄、桐花树、白骨壤中分离的内生真菌分别占据了总菌数的34.53%、28.78%、36.69%,其中以青霉属、芽枝孢属、拟茎点霉属、间座壳属为优势菌属。在不同组织样本中,以茎部分离出的内生真菌数量最多,并且鉴定出的种属数量也最多,其次为根部,叶部最少。分布在不同植物及不同组织中内生真菌存在着显著差异性和多样性。
关键词 红树植物;内生真菌;分离;鉴定;多样性
中图分类号:Q939.5文献标识码:Adoi:10.13601/j.issn.1005-5215.2022.04.011
Isolation and Diversity of Mangrove Endophytic Fungi
Zeng Zhihao Yuan Zongsheng Huang Xiaonan Liu Fang
(1. College of Life Sciences,Fujian Agriculture and Forestry University,Fuzhou 350002,Fujian;2. Institute of Oceanography,Minjiang University,Fuzhou 350108,Fujian;3. Fuzhou Ocean and Fisheries Technology Center,Fuzhou 350007,Fujian)
Abstract Mangrove plants incorporating Kandelia candel,Aegiceras corniculatum and Avicennia marina were selected. The roots,stems and leaf tissues of three species trees were collected to isolate the endophytic fungi from tissues in this trial. The endophytic fungi DNA was extracted and then PCR amplification was performed to identify ITS region. The results showed that 139 endophytic fungi were isolated from mangrove plant samples,which belonged to 7 classes,15 orders,17 families and 32 genera. The number of endophytic fungal strains isolated from K. candel,A. corniculatum and A. marina accounted for 34.53%,28.78%,and 36.69% of the total fungi number,respectively. Among them,Penicillium,Cladosporium,Phomopsis,Diaporthe were the dominant genus. Among different tissue samples,the identified species and genera number of endophytic fungi isolated from stems was the largest,followed by roots,and leaves were the least. This study fully demonstrated that there are significant differences and diversity of endophytic fungi distributed in different plants and different plant tissues.
Key wordsMangrove plants;endophytic fungi;isolation;identification;diversity
紅树林以红树植物为主体,同时有着半红树植物及其伴生植物,生境具有强酸性、高还原性等特征[1]。福建省是中国红树林目前分布最北的省份,有着10余种真红树植物及多种半红树植物。红树林的微生物资源丰富,从其中分离鉴定的真菌超过280种,是海洋真菌的第二大类群[2]。内生真菌指能和植物体和谐共生,在植物中不会引起明显疾病的一类真菌[3]。红树林植物内生真菌因为生境特殊,而具有特殊的遗传背景;在种类和代谢产物上具有丰富多样性,并形成特有的代谢路径[4]。
通过对内生真菌的研究可以探寻其与植物宿体生长发育间存在的联系规律,内生真菌从植物中获取养分,同时分泌代谢产物影响着植物体的生长发育。部分真菌可以分泌能够提高植物体抵抗力、增强植物体抗逆性的次生代谢物[5],有的真菌还具有生态功能,可对宿主植物产生对生境适应性以及物质与能量应用上的影响[6]。本研究以福建漳州和泉州红树植物品种秋茄(Kandelia candel)、桐花树( Aegiceras corniculatum )、白骨壤(Avicennia marina)为样本,分离其内生真菌,并对其多样性进行了分析,为红树林内生真菌的进一步研究以及实践应用奠定基础。837341F5-7F5A-42C1-A2C7-DB01FB127365
1 材料与方法
1.1 材料
分离样本来源 :红树植物秋茄、桐花树、白骨壤的根、茎、叶,采自福建省漳州市和泉州市。选择健康的植物组织,将采集样品迅速装入无菌密封样品袋中,避免受到外来污染,标记时间、地点等信息,12 h内带回实验室进行分离。
培养基:海水马铃薯葡萄糖培养基(Seawater-PDA,SPDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,采样地海水1 000 mL。
主要试剂:75%乙醇、2%次氯酸钠溶液、无菌海水等,PCR引物及常规操作所用试剂。
1.2 红树内生真菌的分离与纯化
将采集到的根、茎、叶用流水冲洗干净后放入超声水浴锅内超声清洗3次,每次超声10~15 s,并用无菌粗滤纸吸干水分并晾干,接着用75%的乙醇浸泡60 s,2%次氯酸钠溶液浸泡5 min进行表面消毒,随后用无菌水漂洗5次,无菌粗滤纸吸干水分。接着在无菌条件下,将样品切成5 mm×5 mm的小块,放置于SPDA培养基平板,置25 ℃培养箱中培养,定时观察。长出菌落后,取不同特征边缘菌丝接种于新的SPDA培养基,逐步纯化,得到纯化菌株[7]。
1.3 ITS序列分析和系統发育分析
将内生真菌菌株置于SPDA培养基培养大约5 d后,通过真菌基因组提取试剂盒(北京百泰克生物技术有限公司)提取内生真菌的DNA,再使用ITS1和ITS4引物(序列ITS1:5-TCCGTAGGTGAACCTGCGG-3;ITS4: 5-TCCTCCGCTTATTGATATGC-3)对其进行PCR扩增。
(1)反应体系:反应液总体积 25 μL,上下游引物各 1 μL,Premix Taq 12.5 μL,模板(提取的真菌 DNA)3 μL,dd H2O 7.5 μL。
(2)反应条件:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,40次循环;最后,将其在72 ℃下延伸5 min[8]。
PCR产物经1% (W/V)琼脂凝胶电泳检测后送至上海生工生物工程有限公司。依据测序结果,登录数据库http:/www.ncbi.nlm.nih.gov/Blast/对所得的ITS基因序列进行相似度比对及同源性分析,并以此构建系统发育树,确定内生真菌的分类地位。
2 结果与分析
2.1 红树植物内生真菌的分离
2.1.1 秋茄、桐花树、白骨壤内生真菌的多样性
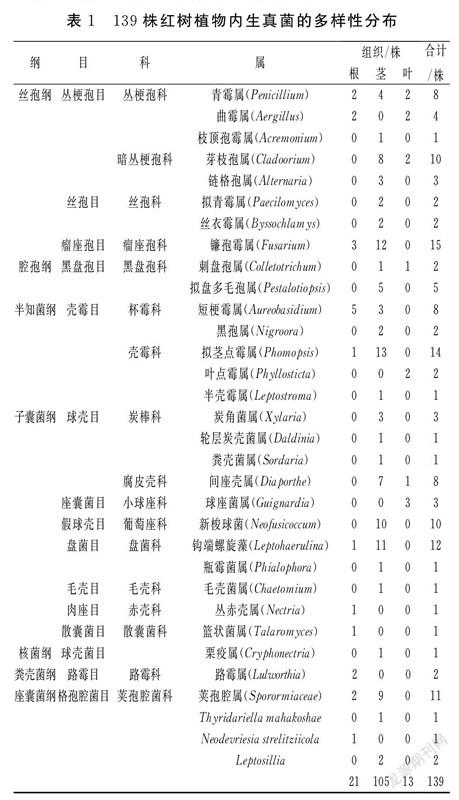
采集来自漳州、泉州的红树植物秋茄、白骨壤、桐花树的根、茎、叶,通过分离和纯化得到可培养真菌139株,通过基因测序结果分析共获得真菌,分属于7纲15目17科32属,结果如表1。
其中青霉属、芽枝孢属、拟茎点霉属、间座壳属分布较为多样化,不集中出现在特定植物、特定部位,所以其为主要优势菌属。总共32属真菌中,有18属真菌仅出现一株或两株,分布具有特殊性和局限性,分别为枝顶孢霉属、拟青霉属、丝衣霉属、刺盘孢属、黑孢属、叶点霉属、半壳霉属、轮层炭壳菌属、粪壳菌属、瓶霉菌属、毛壳菌属、丛赤壳属、篮状菌属、栗疫属、路霉属、Thyridariella mahakoshae、Neodevriesia strelitziicola、Leptosillia。镰孢霉属和新梭球菌虽然分离得到的菌数较多,但是集中出现在相同植物或相同部位,分布具有宿主专一性或组织专一性,不能算作优势菌属。荚孢腔属的菌株大多序列相似性较低,属于未知菌属。
2.1.2 红树植物不同组织分离结果
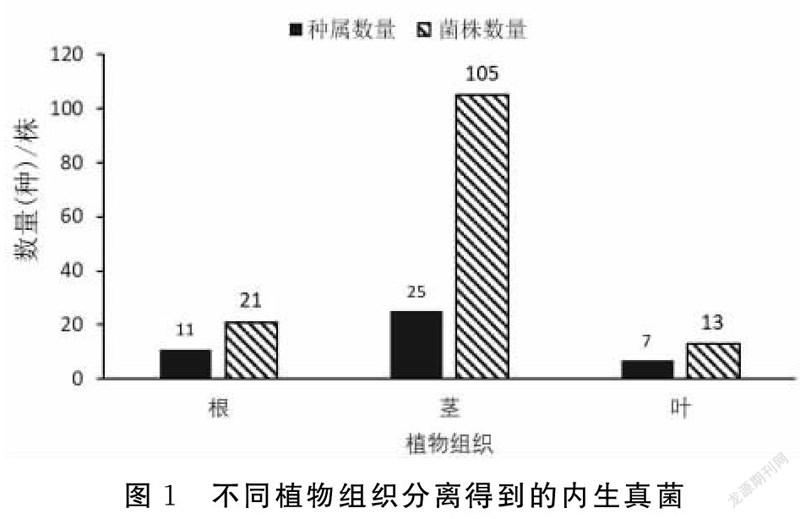
不考虑红树植物品种,仅分析红树植物不同组织分离得到的内生真菌的种属数量和菌株数量(图1),从红树植物茎部分离得到105株内生真菌,与其他组织相比数量最多;从根部分离得到21株内生真菌;叶部最少,分离内生真菌为13株。但是分离的菌株数量和真菌种属数量不呈正相关关系,茎部分离内生真菌种属数量仅为25属,根部分离内生真菌种属数量为11属,叶部分离内生真菌种属数量为7属,原因是茎部分离的内生真菌存在很多重复相似种属,根部和叶部分离的内生真菌数量虽然远小于茎部,但是多样性更强。同时可以看出一株植物的根、枝、叶等组织中所存在的内生真菌数量和种类并不相同。
2.1.3 不同红树植物的不同组织部位分离的内生真菌的多样性
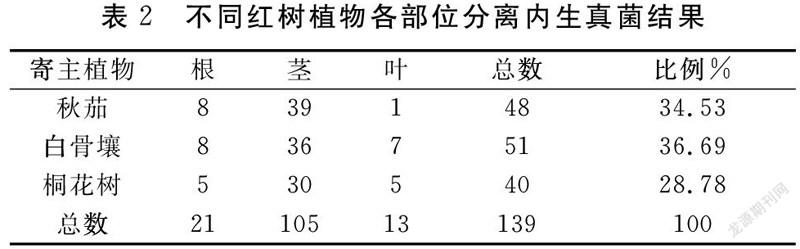
根据分离出的真菌的核酸序列,可确定从漳州和泉州的秋茄、白骨壤、桐花树的根、茎、叶中共计分离出139株可培养内生真菌。在组织水平上,秋茄样品分离出48株真菌分属18属:根部8株分属4属,茎部39株分属15属,叶部1株1属;白骨壤样品分离出51株真菌分属20属:根部8株分属5属,茎部36株分属14属,叶部7株分属5属;桐花树样品分离出40株真菌分属18属:根部5株分属4属,茎部30株分属13属,叶部5株分属4属,如表2。
由表2可看出,不同红树植物分离内生真菌数量占比不同,相同红树植物不同组织中分离内生真菌数量也各不相同。白骨壤中分离出的内生真菌数量占比最高,秋茄其次,桐花树最低。从两地红树植物的茎部分离出的菌株数量最多,远多于根部和叶部,根部的菌株数量略多于叶部。
从红树植物分离出的内生真菌种属数量来看,我们拟定标准:占植物分离内生真菌总数的10%及以上的真菌种属为该植物的优势菌属。按照这个标准,则可以分析得到不同红树植物的优势菌属各不相同。秋茄样品的优势菌属为拟茎点霉属(分离得到9株)、新梭球菌(分离得到7株)、短梗霉属(分离得到6株),前2种优势菌属仅在茎部分离得到,而短梗霉属菌株出现在根和茎的样品中。白骨壤样品的优势菌属为钩端螺旋藻(分离得到5株),仅出现在茎部;镰孢霉属(分离得到14株),出现在根和茎的样品中。桐花树样品的优势菌属为钩端螺旋藻(分离得到4株)和荚孢腔属(分离得到9株),前者在根和茎的样品中有出现,后者仅出现在茎的样品中。837341F5-7F5A-42C1-A2C7-DB01FB127365
可以看出,白骨壤和桐花树的优势菌属有一定相似性,都包括了钩端螺旋藻。白骨壤分离出的内生真菌数量最多,种属数量也最多,但和桐花树一样菌属优势不明显,秋茄分离出的优势菌属多样,三者总体具有丰富性。
2.1.4 红树植物不同地理位置分离结果
从位置水平上看,从采自泉州的桐花树中分离得到21株内生真菌(根部2株,茎部17株,叶部2株),而从采自漳州的桐花树中分离得到19株内生真菌(根部3株,茎部13株,叶部3株);从采自泉州的白骨壤中分离得到22株内生真菌(茎部16株,叶部6株),而漳州白骨壤分离得到29株内生真菌(根部8株,茎部20株,叶部1株);泉州的秋茄共分离出17株内生真菌,全部为茎部分离得到,而从采自漳州的秋茄中分离得到31株内生真菌(根部8株,茎部22株,叶部1株)。
不难看出,漳州的红树林植物所能分离出的内生真菌群落的丰富性要高于泉州的红树林植物。而采自漳州和泉州的桐花树的内生真菌群落丰富性和多样性大体相似,采自漳州的白骨壤的内生真菌群落在组织分布上的多样性要高于采自泉州的白骨壤,采自漳州的秋茄的内生真菌群落在丰富性和组织分布多样性上都高于采自泉州的秋茄。
2.2 红树植物内生真菌的ITS序列分析和系统发育分析
2.2.1 红树植物内生真菌的ITS序列比对分析
对所分离的139株红树植物内生真菌菌株进行ITS序列分析后,为了鉴别出对应的真菌种类,将所得到的ITS序列通过http:/www.ncbi.nlm.nih.gov/Blast/ 网站中的Blast功能进行相似性比对,由于真菌序列比对目前没有明确判断标准,所以采用16S rRNA序列比对标准,与某种系的代表参照序列相比,未知菌株序列的相似性≥98.6%,未知菌株 鉴定为该属;如未知菌株序列相似性<98.6%,未知菌株不能鉴定为该种或属[9]。
通过比对得到的数据显示(图2),在分离得到的139株红树植物内生真菌中,115株菌株序列相似性≥98.6%,可鉴定为其相对应的属;而有24株菌株序列相似性<98.6%(表3),则说明未知菌株可能属于其他种属。
2.2.2 内生真菌ITS 序列系统发育分析
将上述红树植物中分离的内生真菌的ITS序列构建成系统发育树(图3),确定内生真菌的分类地位。从图3中可以看到,构建出的系统发育树主要分为2个支系,其中一个较小的支系以青霉属、曲霉属为主,另一个大支系包括了其余的大部分菌株。从图3中的bootstrap值可以看出,分离的内生真菌菌株中有许多亲缘关系十分接近,隶属于相同种属。
3 结论
本试验研究了福建泉州和漳州的红树植物秋茄、白骨壤、桐花树的组织根、茎、叶中内生真菌的丰富性和多样性。试验共计分离出内生真菌139株,通过分子生物学的方法,将这些真菌鉴定到7纲15目17科32属。其中秋茄48株18属,白骨壤51株20属,桐花树40株18属。在内生真菌多样性和丰富性上,秋茄和白骨壤要大于桐花树,这和缪莉在对分布于福建省南部沿海的主要红树植物内生真菌资源进行初步调查的结论相似[10]。分离得到的139株内生真菌中,青霉属、芽枝孢属、拟茎点霉属、间座壳属为优势菌属,这点与徐莹对福建省红树林区采样后分离得到内生真菌的分析结果[11]及张艳等对广西北部湾红树植物内生真菌多样性的研究结果[12]有一定的相似性。
本试验结果发现,不论是同种植物不同组织间比较还是3种红树植物的不同组织总数间比较,茎部分离出的内生真菌菌株数和菌株种属数量都要高于根部和叶部。同样地,孙剑秋等在对北方药用植物内生真菌多样性及生态分布调查时发现,6种药用植物的枝条内生真菌定殖率和分离率明显高于叶片[13];高剑对高桥和东寨港红树林中3种常见树种进行红树林内生真菌多样性及生态分布的研究中指出,3种红树枝条中内生真菌的丰富性和多样性要高于根部和叶部,而根部和叶部中内生真菌的多样性和丰富性没有显著差异[14]。造成这种差异的原因可能是植物不同组织结构所含有的营养物质不完全相同,以及不同组织生长周期上存在差异,对内生真菌的侵染和分布造成了影响。
本试验数据体现不同地理位置对红树植物内生真菌的多样性有所影响。总体上看,采自漳州的红树林植物中的内生真菌群落的丰富性要高于采自泉州的同种红树林植物。推测是因为同种红树植物所处在不同生境中,其气候、土壤等多种条件不相同,导致了内生真菌的多样性也不相同,有待后续对不同土壤等影响开展进一步研究。本试验初步证明了福建省红树植物秋茄、白骨壤、桐花树中所含的内生真菌资源的丰富性与多样性,并对内生真菌资源的进一步利用提供了可靠的数据支持,对其开发起到了一定作用。
参考文献:
[1] 但新球,廖宝文,吴照柏,等.中国红树林湿地资源、保护现状和主要威胁[J].生态环境学报,2016,25(7):1237-1243
[2] Sarma VV,Vittal BPR. Biodiversity of mangrove fungi on different substrata of Rhizophora apiculata and Avicennia spp.from Godavari and Krishna deltas,east coast of India[J].Fungal Diverdity,2000(5):23-41
[3]邓祖军,曹理想,周世宁.红树林内生真菌的分离及代谢产物生物活性的初步研究[J].中山大学学报:自然科学版,2010,49(2):100-104
[4]邓祖军,曹理想,杨国武,等.从红树林内生真菌筛选重组人DNA拓扑异构酶Ⅰ抑制剂的研究[J].海洋通报,2009,28(5):91-96
[5]肖胜蓝,雷晓凌,佘志刚,等.广西山口8种红树林内生真菌的分离鉴定及抗菌活性菌株的筛选[J].热带作物学报,2011,32(12):2259-2263
[6]龙寒,向伟,庄铁城,等.红树林区微生物资源[J].生态学杂志,2005(6):696-702
[7] Liu AR,Xu T,Guo LD. Molecular and morphological description of Pestalotiopsis hainanensis sp.nov.,a new endophyte from a tropical region of China [J]. Fung Diver,2007,24:23-36
[8]張伟铮,关文苑,李松,等.ITS序列分析与MALDI-TOF MS质谱技术在丝状真菌鉴定中的应用[J].菌物学报,2019,38(8):1298-1305
[9]耿佳靖,袁梁,鲁辛辛.18S rRNA基因序列分析在临床常见酵母样真菌鉴定中的应用[J].中华检验医学杂志,2009(6):644-648
[10]缪莉.红树植物内生真菌抗菌抗肿瘤活性物质的初步研究[D].厦门:厦门大学,2002
[11]徐莹.红树真菌的生物活性以及去乙酰真菌环氧乙酯的发酵和理化性质的研究[D].厦门:厦门大学,2009
[12]张艳,蓝桃菊,廖仕同,等.广西北部湾红树植物内生真菌多样性[J].微生物学通报,2017,44(4):783-794
[13]孙剑秋,郭良栋,臧威,等.药用植物内生真菌多样性及生态分布[J].中国科学(C辑:生命科学),2008(5):475-484
[14]高剑.内生真菌多样性及其生态分布[D].湛江:广东海洋大学,2013837341F5-7F5A-42C1-A2C7-DB01FB127365
