丹参注射液对高脂血症模型小鼠脂质代谢的影响
2022-07-02王语晴郭婉琴刘欣欣肖洪彬牛雯颖李凤金
王语晴 郭婉琴 刘欣欣 肖洪彬 牛雯颖 李凤金
〔摘要〕 目的 明確丹参注射液对高脂乳剂诱导的高脂血症模型小鼠脂质代谢的影响。方法 高脂乳剂灌胃法建立高脂血症小鼠模型,造模成功后随机分为模型组、非特组(非诺贝特26 mg/kg)、丹高组(高剂量丹参注射液5 mL/kg)、丹低组(低剂量丹参注射液2.5 mL/kg),每组10只,另取10只小鼠作为空白组。模型组及各给药组予高脂乳剂继续灌胃,同时各给药组予相应药物,模型组和空白组予生理盐水,各组均连续干预21 d。检测血清甘油三酯(triglyceride, TG)、胆固醇(cholesterol, CHO)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)含量;分离肝脏,称重,计算肝脏系数;检测肝组织中超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、丙二醛(malondialdehyde, MDA)活性变化;ELISA法检测血清中3-羟基3-甲基戊二酸单酰辅酶A(3-hydro2xy-3-methylglutaryl coenzyme A, HMG-CoA)、卵磷脂胆固醇酰基转移酶(lecithin cholesterol acyltransferase, LCAT)、脂蛋白脂肪酶(lipoprtein lipase, LPL)及肝组织中肝脂酶(hepatic lipase, HL)、胆固醇7α-羟化酶(cholesterol 7α-hydroxylase, CYP7A1)含量。结果 与空白组比较,模型组TG、CHO、LDL-C、MDA、HMG-CoA含量均明显升高(P<0.05,P<0.01),LCAT、LPL、SOD、GSH-Px、HL、CYP7A1含量均明显降低(P<0.05,P<0.01),肝脏湿质量、肝脏系数均明显增大(P<0.01)。与模型组比较,各给药组CHO、LDL-C含量均明显降低(P<0.05,P<0.01),LCAT、CYP7A1含量均明显升高(P<0.05);非特组TG含量明显降低(P<0.05),LCAT、CYP7A1含量均明显升高(P<0.05);非特组及丹低组SOD、GSH-Px含量均明显升高(P<0.05),MDA含量均明显降低(P<0.05);丹高组HMG-CoA含量明显降低(P<0.05)。结论 丹参注射液能改善高脂乳剂诱导的小鼠血脂代谢紊乱,减轻氧化应激反应及脂质过氧化损伤,对胆固醇代谢的相关酶表达产生影响,以达到降低血脂的目的。
〔关键词〕 高脂血症;脂质代谢;丹参注射液;非诺贝特;脂质过氧化
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.06.007
Effect of Danshen Injection on lipid metabolism in hyperlipidemia model mice
WANG Yuqing1, GUO Wanqin1, LIU Xinxin1, XIAO Hongbin1, NIU Wenying1*, LI Fengjin2*
(1. Heilongjiang University of Chinese Medicine, Haerbin, Heilongjiang 150040, China;
2. Heilongjiang Academy of Traditional Chinese Medicine, Haerbin, Heilongjiang 150040, China)
〔Abstract〕 Objective To clarify the effect of Danshen Injection on lipid metabolism in hyperlipidemia model mice induced by hyperlipidemia emulsion. Methods The hyperlipidemia mouse model was established by intragastric administration of high-fat emulsion, and the successful mice were randomly divided into model group, fenofibrate group (fenofibrate 26 mg/kg), Danshen Injection high-dose group (5 mL/kg) and Danshen Injection low-dose group (2.5 mL/kg). There were 10 mice in each group, and another 10 mice were selected as blank group. The model group and each administration group were given high-fat emulsion for continuous intragastric administration, while each administration group was given corresponding drugs, and the model group and the blank group were given normal saline. Each group was continuously intervened for 21 days. The content levels of serum triglyceride (TG), cholesterol (CHO), high density lipoprotein-cholesterol (HDL-C) and low density lipoprotein-cholesterol (LDL-C) were detected. The liver was separated, weighed and the liver coefficient was calculated. The activities of superoxide dismutase (SOD), glutathione peroxidase (GSH-Px) and malondialdehyde (MDA) in liver were detected. ELISA was used to detect 3-hydro2xy-3-methylglutaryl coenzyme A (HMG-CoA), lecithin cholesterol acyltransferase (LCAT), lipoprtein lipase (LPL) in serum and hepatic lipase (HL), cholesterol 7α-hydroxylase (CYP7A1) in liver. Results Compared with the blank group, the content of TG, CHO, LDL-C, MDA and HMG-CoA in the model group increased significantly (P<0.05, P<0.01), the content of LCAT, LPL, SOD, GSH-Px, HL and CYP7A1 decreased significantly (P<0.05, P<0.01). Compared with the model group, the content of CHO and LDL-C in each treatment group decreased significantly (P<0.05, P<0.01), and the content of LCAT and CYP7A1 increased significantly (P<0.05); the content of TG in fenofibrate group decreased significantly (P<0.05), the content of LCAT and CYP7A1 increased significantly (P<0.05); the content of SOD and GSH-Px in fenofibrate group and Danshen Injection high-dose group increased significantly (P<0.05), and MDA decreased significantly (P<0.05); the content of HMG-CoA in Danshen Injection high-dose group decrease significantly (P<0.05). Conclusion Danshen Injection can improve the disorder of blood lipid metabolism in mice induced by high-fat emulsion, reduce oxidative stress and lipid peroxidation injury, and affect enzymes related to cholesterol metabolism, so as to reduce blood lipid.55C3C0E9-68E2-481D-AC96-F072FCF997D7
〔Keywords〕 hyperlipidemia; lipid metabolism; Danshen Injection; fenofibrate; lipid peroxidation
高脂血症是由多种原因导致的脂质代谢紊乱的一种病理状态[1]。血脂在血管壁中不断累积,引起血液黏稠度增加,形成粥样斑块,最终会引发冠心病和脑卒中等心脑血管危重疾病,严重威胁着人类健康[2]。研究发现,高脂血症为本虚标实之证,本虚以肝、脾、肾不足为主,标实则为痰浊、血瘀[3-4]。血脂异常可导致瘀血的形成,此病理因素贯穿于高脂血症发生、发展的始终[5]。现代药理学研究表明,活血化瘀类药物能改善脂质过氧化,纠正血液流变学异常[6],因此,临床治疗高脂血症可以“活血化瘀”为基本方法。
中药注射剂以中医药理论为指导,是在中草药制剂基础上发展而来的新剂型,具有生物利用度高、药效快等优势[7]。研究发现,中药注射剂特别是活血化瘀类中药注射剂广泛应用于心脑血管急症合并高脂血症的救治中,通过抑制血小板黏附聚集、促进纤维蛋白溶解来改善血管的堵塞情况,对血脂也起到了调节作用[8]。课题组前期研究发现,丹参、血塞通、红花黄、灯盏花这4种活血化瘀类的中药注射液在改善糖尿病模型小鼠糖代谢的同时,对血液脂质大分子物质起到了下调作用[9],由此可以推断活血化瘀类中药注射液可能具有潜在的降血脂作用。丹参具有活血祛瘀、通经止痛的功效,常用于胸痹心痛等心血管系统疾病[10]。但无论是临床实践还是实验研究,丹参各类剂型对血脂的影响尚未明确,是否具有治疗高脂血症的作用及作用机制仍需进一步深入研究。本实验采用高脂乳剂灌胃法制备高脂血症小鼠模型,通过检测实验动物各阶段血脂水平,抗氧化功能以及脂质代谢相关酶等指标水平,探究丹参注射液的降脂作用。
1 材料
1.1 动物
雄性ICR小鼠,SPF级,57只,体质量(20±2) g,由哈尔滨医科大学实验动物中心提供。实验动物合格证号为SCXK(辽)2018-0001,使用许可证书编号为SYXK(黑)2018-007。饲养环境通风干燥,安静,光线充足,饮水自由摄取。实验过程符合黑龙江中医药大学实验动物伦理要求,审批号为HZY201911005。
1.2 药物与试剂
丹参注射液(正大青春宝药业有限公司,批号:0205043);非诺贝特胶囊(法国利博福尼制药公司,批号:H20160155);胆固醇(cholesterol,CHO)、胆酸钠均购自上海蓝季科技发展有限公司(批号分别为210626、20201018);丙硫氧嘧啶(大连美仑生物技术有限公司,批号:MO316B);吐温-80(天津市风船化学试剂有限公司,批号:20200420);BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号:P0006);CHO、甘油三酯(triglyceride, TG)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)试剂盒均购自中生北控生物科技股份有限公司(批号分别为192061、198021、201441、201461);超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、丙二醛(malondialdehyde, MDA)、脂蛋白脂肪酶(lipoprtein lipase, LPL)、3-羟基3-甲基戊二酸单酰辅酶A(3-hydro2xy-3-methylglutaryl coenzyme A, HMG-CoA)、卵磷脂胆固醇酰基转移酶(lecithin cholesterol acyltransferase, LCAT)、肝脂酶(hepatic lipase, HL)、胆固醇7α-羟化酶(cholesterol 7α-hydroxylase, CYP7A1)试剂盒均购自南京建成生物工程研究所(批号分别为20210707、20210630、20210707、20211104、20210926、20211104、20211104、20211104)。
1.3 主要仪器
电子天平(北京赛多利斯仪器系统有限公司,型号:ISO90C1);恒温磁力搅拌器(金坛市医疗仪器厂,型号:78HW-1);多功能酶标仪(瑞士Tecan公司,型号:M200 PRO);全自动生化分析仪(日本Hitachi公司,型号:7600-020);水浴锅(上海医分仪器制造有限公司,型号:DZKW-D-1);多功能冷冻离心机(德国Hettich公司,型号:MIKRO 220R);涡旋混匀器(北京市永光明医疗仪器有限公司,型号:HYQ-2121A)。
2 方法
2.1 分组、造模及给药
随机选取47只小鼠,每天按20 mL/kg高脂乳剂(含猪油15 g,胆固醇6 g,胆酸钠2 g,丙硫氧嘧啶0.2 g,4 mL吐温-80,加蒸馏水定容至100 mL,參照脂乳剂制备方法[11])灌胃。造模第21天,随机抽取7只小鼠,取血,检测血清TG、CHO、LDL-C含量,三者均显著升高视为造模成功[12-13]。将造模成功后的40只小鼠随机分为模型组、非特组、丹高组和丹低组,每组10只。10只未进行造模处理的小鼠,作为空白组。
分组后,模型组与各给药组每天上午继续给予高脂乳剂,模型组每天下午予生理盐水腹腔注射,各给药组每天下午予相应药物进行干预(给药剂量根据人与动物体表面积剂量换算法[14],以70 kg成人1倍临床等效剂量给药)。丹参注射液人注射剂量为每天20 mL,换算得小鼠腹腔注射低剂量为每天2.5 mL/kg,低剂量的2倍为高剂量即5 mL/kg;非诺贝特胶囊人口服剂量为每天200 mg,换算得小鼠灌胃剂量为每天26 mg/kg。空白组每天上午予生理盐水灌胃,下午予生理盐水腹腔注射。每组均连续干预21 d。给药期间,非特组、丹高组各死亡2只小鼠。55C3C0E9-68E2-481D-AC96-F072FCF997D7
2.2 样本采集
小鼠禁食不禁水12 h,测量空腹体质量,末次给药2 h后,用戊巴比妥钠腹腔注射进行麻醉,眼底静脉丛取血,3000 r/min离心(离心半径8 cm)10 min,分离血清备用。小鼠颈椎脱臼处死后,解剖取肝脏,生理盐水洗涤,滤纸吸尽脏器表面液体后用电子天平称质量并记录。切取同一部位的部分肝脏液氮固定,放入-80 ℃冰箱内冷冻保存。制备肝匀浆时,肝组织室温解冻,切取肝脏约200 mg,剪碎,按1∶9比例加入预冷的生理盐水,匀浆机冰上研磨2 min,3000 r/min离心(离心半径8 cm)10 min,取上清液备用。
2.3 肝脏系数计算
各组小鼠处死之前,测量体质量及肝脏湿质量,计算肝脏系数,肝脏系数=肝脏湿质量(g)/体质量(g)×100%,用以评价肝脏病变程度[15]。
2.4 血脂生化指标检测
应用全自动生化仪检测血清TG、CHO、HDL-C、LDL-C,按照试剂盒说明书操作。
2.5 肝组织氧化指标检测
应用试剂盒检测肝组织中SOD、MDA、GSH-Px含量,按照试剂盒说明书操作。
2.6 脂质代谢活性酶检测
应用ELISA法检测血清中HMG-CoA、LCAT、LPL及肝组织中HL、CYP7A1含量,按照试剂盒说明书操作。
2.7 统计学方法
采用SPSS Statistics 22.0软件进行统计分析。计量资料以“x±s”表示,符合正态分布者,两组间比较采用t检验,多组间比较采用单因素方差分析;不符合正态分布者,采用非参数检验。以P<0.05为差异有统计学意义。
3 结果
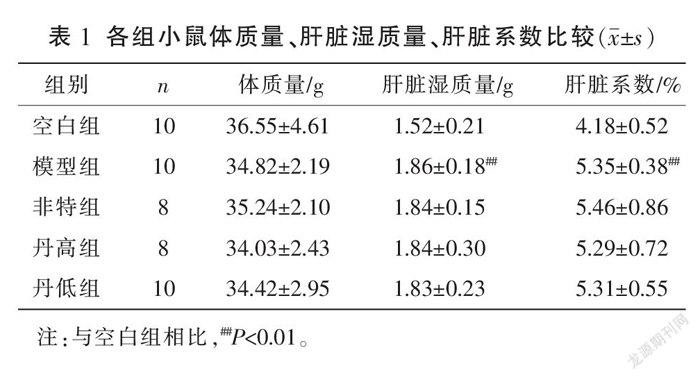
3.1 体质量、肝脏湿质量、肝系数情况
模型组体质量与空白组比较,差异无统计学意义(P>0.05)。与空白组比较,模型组肝脏湿质量、肝脏系数均明显增大(P<0.01)。各给药组体质量、肝脏湿质量、肝脏系数与模型组比较,差异均无统计学意义(P>0.05)。详见表1。
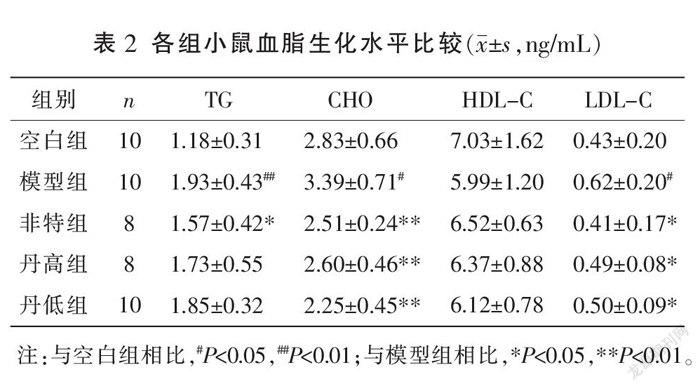
3.2 血清血脂生化水平情况
与空白组比较,模型组TG、CHO和LDL-C含量均明显升高(P<0.05,P<0.01);模型组HDL-C含量与空白组比较,差异无统计学意义(P>0.05)。与模型组比较,各给药组CHO、LDL-C含量均明显降低(P<0.05,P<0.01),非特组TG含量明显降低(P<0.05);各给药组HDL-C含量与模型组比较,差异均无统计学意义(P>0.05);丹高组、丹低组TG含量与模型组比较,差异均无统计学意义(P>0.05)。详见表2。
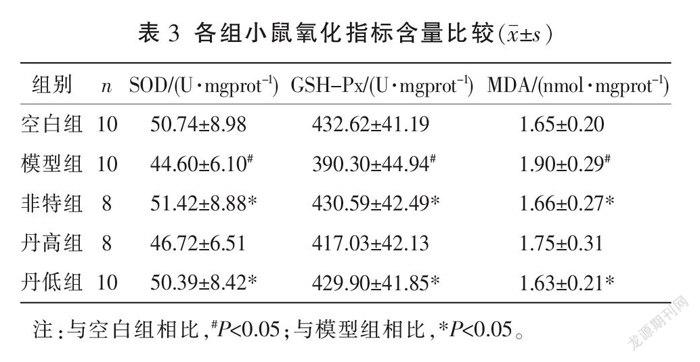
3.3 肝组织氧化指标含量情况
与空白组比较,模型组SOD、GSH-Px含量均明显降低(P<0.05),MDA含量明显升高(P<0.05)。与模型组比较,非特组和丹低组SOD、GSH-Px含量均明显升高(P<0.05),MDA含量明显降低(P<0.05);丹高组SOD、GSH-Px、MDA含量与模型组比较,差异均无统计学意义(P>0.05)。详见表3。
3.4 血清、肝组织脂质代谢相关蛋白酶含量情况
与空白组比较,模型组HMG-CoA含量明显升高(P<0.05),LPL、LCAT、HL、CYP7A1含量均明显降低(P<0.05,P<0.01)。与模型组比较,丹高组HMG-CoA含量明显降低(P<0.05),各给藥组LCAT、CYP7A1含量均明显升高(P<0.05),非特组LCAT、LPL、HL、CYP7A1含量均明显升高(P<0.05);丹低组和非特组HMG-CoA、丹高组和丹低组LPL、丹高组HL含量与模型组比较,差异均无统计学意义(P>0.05)。与丹低组比较,丹高组HMG-CoA含量明显降低(P<0.05);丹高组LPL、LCAT含量与丹低组比较,差异均无统计学意义(P>0.05)。详见表4-5。
4 讨论
TG、CHO、LDL-C、HDL-C是观测机体脂质代谢水平的常用指标,能真实反映出机体的血脂状况[16]。研究高脂血症的关键是选择理想的,与人类高脂血症发病机制相类似的动物模型。高脂乳剂灌胃法,通过模拟人类的高脂饮食,使模型体内相关生化指标迅速上升,操作简单、造模时间短,因而被广泛应用于各类降脂药物在体内的筛选[17]。本实验采用高脂乳剂灌胃法,诱导构建高脂血症小鼠模型,结果显示,高脂血症小鼠CHO、LDL-C、TG等血脂指标水平显著升高。肝脏是机体脂质代谢的主要场所,肝脏系数是脂肪变性的连续线性生化评价指标,肝脏系数的升高提示肝脏可能出现了肿胀、充血、增生等病理变化[18]。因此,以上各指标提示高脂乳剂诱导的ICR小鼠高脂血症模型具有对照意义。
高脂血症多属中医学“痰浊”“痰瘀”“血瘀”等范畴[19]。现代医学研究证实,高脂血症可促使血液流变学中的各项指标改变,出现高黏滞综合征,导致微循环障碍。实验发现,活血化瘀类药物可以影响高脂血症模型大鼠的红细胞膜结构,改变红细胞变形性从而改善血液状态,从而起到调节血脂的作用[20],因此,活血化瘀为该疾病的主要治疗思路。丹参注射液是由丹参经提取、纯化等现代化工艺制成的中药制剂,具有活血养血、通脉养心的功效,运用此药符合“活血化瘀”的治疗理念。非诺贝特可以激活过氧化物酶体增殖物激活受体α,调节CYP7A1和CYP8B1这两个胆汁酸的限速酶来降低体内血清CHO、LDL水平,还能通过过氧化物酶体增殖物激活受体反应元件PPRE激动LPL催化TG水解为游离脂肪酸和单酰甘油,对改善血脂、维持脂代谢平衡发挥着显著的作用[21-22]。基于以上思路,本实验以非诺贝特为阳性对照药,选择丹参注射液为治疗药物。结果表明,丹参注射液可以显著降低小鼠血清CHO和LDL-C含量,改善脂质紊乱,而对TG的影响较小。55C3C0E9-68E2-481D-AC96-F072FCF997D7
研究发现,机体长期处于高血脂状态,脂质代谢物过量堆积会导致血管内血栓形成,同时加重机体氧化应激反应,损伤血管内皮细胞,与动脉粥样硬化性心血管疾病的发生、发展有着密切的联系[23-24]。而肝细胞氧化损伤和肝内脂质过氧化,反过来也会影响肝细胞的脂质代谢功能,最终会造成肝内胆固醇、脂肪酸沉积以及肝细胞脂肪变性。SOD、GSH-Px和MDA的联合测定,可以反映机体清除氧自由基、抗氧化应激的能力及机体相应的过氧化损伤程度[25-27]。本实验结果显示,高脂血症小鼠MDA含量显著升高,SOD、GSH活力明显降低,说明高脂血症小鼠体内存在异常的氧化应激反应,高脂乳剂灌胃对小鼠肝脏造成了一定的损伤;而丹参注射液可以降低MDA水平,增加SOD、GSH-Px活性,提示丹参注射液在一定程度上能提高小鼠肝脏的抗氧化水平,低氧化应激水平有助于改善脂代谢紊乱,其降血脂作用可能与机体的抗氧化酶活性有关。
HMG-CoA還原酶是胆固醇合成的限速酶,其表达上升可导致血脂代谢紊乱,诱发高脂血症[28]。LCAT是脂蛋白代谢过程中的一种关键酶,能调节血液循环中CHO转运及维持CHO在血浆中的稳态[29]。LCAT催化HDL颗粒中卵磷脂分子至游离胆固醇分子形成胆固醇酯,后者通过VLDL转移至LDL进入肝脏而被清除。LPL是一种蛋白水解酶,能水解CM和VLDL-C转运的TG为甘油和脂肪酸,同时LPL还能将富含TG脂蛋白表面的磷脂和载脂蛋白转化为HDL-C,而HDL-C可将CHO转运至肝脏或以胆酸的形式进行排泄[30]。肝脏富含多种与脂质代谢相关的酶,是机体调控、平衡血脂的重要枢纽器官,是脂类合成和分解的重要场所,肝脏功能受损会导致脂代谢失衡,出现脂质沉积[31]。HL为肝实质细胞合成的一种糖蛋白,分泌入血后转运到内皮细胞表面发挥生理作用。HL既是磷脂酶,又是TG脂肪酶,在HDL代谢和VLDL向LDL转化中起着重要作用。HL能协助LPL进一步水解CM和VLDL的剩余微粒,催化CM和HDL中的TG和磷脂清除。相关研究表明,促进CHO化为胆汁酸是治疗高胆固醇血症的一条重要途径,CYP7A1作为胆固醇代谢途径中重要的一种限速酶,其表达升高后胆固醇向胆汁酸的转化增多,有效促进肝脏中胆固醇的代谢[32]。因此,脂质代谢关键酶的活性与血脂水平密切相关。本研究结果表明,丹参注射液可以降低小鼠血清中HMG-CoA含量,升高LCAT及肝组织CYP7A1水平,其降脂作用与主要与CHO代谢密切相关,初步表明丹参注射液可能是通过调节CYP7A1、HMG-CoA、LCAT等与CHO相关的脂代谢酶含量达到调节血脂的目的,进一步验证了脂代谢酶活性与血脂水平相关,特别是与胆固醇代谢密切相关,而对HL、LPL等TG水解酶的影响较小。
综上所述,丹参注射液对高脂乳剂诱导的高脂血症小鼠具有调节血脂的作用,能减轻氧化应激反应及脂质过氧化损伤,对胆固醇代谢的相关酶表达产生影响,以达到降低血脂的目的。因此,丹参注射液对高脂血症模型小鼠脂质代谢特别是胆固醇代谢具有调节作用,其降脂机制有待进一步的深入研究。
参考文献
[1] ZHANG H L, ZOU X Q, HUANG Q Y, et al. Effects of Kudingcha nanoparticles in hyperlipidaemic rats induced by a high fat diet[J]. Cellular Physiology and Biochemistry, 2018, 45(6): 2257-2267.
[2] 张玉昆,袁 茵,冯月男,等.补阳还五汤对高脂血症模型大鼠脂质代谢及肝组织的影响[J].中国药房,2020,31(10):1203-1207.
[3] 孟嘉伟,陈 丝,王 群,等.化瘀祛痰方调控长链非编码RNA-NEAT1/miR-27b对高脂血症大鼠胆固醇代谢的影响及机制研究[J].中华中医药学刊,2021,39(9):125-129,263.
[4] 彭高强,文颖娟,陈 茉,等.基于“壮火食气”探讨痰-瘀-脾与高脂血症关系[J].湖南中医药大学学报,2021,41(6):967-971.
[5] 常艳宾,张丽丽,李 雁.从痰浊血瘀理论探讨冠心病的发病机制[J].现代中西医结合杂志,2022,31(3):368-371.
[6] 王钰涵,张 鑫,郑彩平,等.丹参防治盐敏感性高血压血管内皮病变机制的研究进展[J].中华中医药杂志,2022,37(2):939-942.
[7] 周 唯.基于整合大数据的复方苦参注射液治疗胃癌与食管癌上市后评价研究[D].北京:北京中医药大学,2021.
[8] 朱雪萍,张丽梅,毛信心,等.丹参川芎嗪注射液对心绞痛疗效及血脂影响的meta分析[J].中国现代应用药学,2022,39(5):638-647.
[9] 李树洲.红花黄色素注射液、血塞通注射液、丹参注射液、灯盏花素注射液对2型糖尿病模型动物血糖的影响[D].哈尔滨:黑龙江中医药大学,2021.
[10] 单晓晓,洪帮振,刘 洁,等.丹参化学成分、药理作用、临床应用的研究进展及质量标志物的预测分析[J].中国中药杂志,2021,46(21):5496-5511.
[11] 牛雯颖,王莉丽,冯月男,等.补阳还五汤、少腹逐瘀汤和丹参饮对高脂血症模型大鼠红细胞膜组分影响的研究[J].上海中医药杂志,2018,52(8):78-82.
[12] 鞠 楷,万语嫣,张开莲.薤白对高脂血症模型大鼠血脂水平的影响及机制研究[J].中国药房,2018,29(7):976-979.55C3C0E9-68E2-481D-AC96-F072FCF997D7
[13] 楼招欢,张光霁,苏 洁,等.抹茶和桑抹茶对高脂血症模型大鼠血脂水平的作用[J].中成药,2016,38(7):1594-1597.
[14] 徐叔云,卞如濂,陈 修.药理实验方法学[M].北京:人民卫生出版社,2002:179-181.
[15] 林秋红,梁 齐,施家希,等.虎金方通过SIRT1/AMPK通路对代谢相关脂肪性肝病小鼠肝脏脂质合成的影响[J].中药新药与临床药理,2021,32(6):765-770.
[16] 马贵萍,陈 冉,王建茹,等.基于PERK-eIF2α通路探讨冠心康对LDLR-/-高脂血症小鼠血脂的调控机制[J].世界科学技术-中医药现代化,2020,22(2):370-376.
[17] ZHOU X D, ZHANG W Y, LIU X L, et al. Interrelationship between diabetes and periodontitis: Role of hyperlipidemia[J]. Archives of Oral Biology, 2015, 60(4): 667-674.
[18] 李 丽,朱 盼,郭兴兰,等.地菍粗多糖对高脂饮食诱导肥胖小鼠脂代谢的影响[J].中国畜牧兽医,2022,49(1):122-130.
[19] 林炜基,廖慧丽,刘健红,等.赵立诚教授运用健脾除痰降脂方治疗高脂血症经验[J].中西医结合心脑血管病杂志,2021,19(4):694-696.
[20] 杜海霞,周惠芬,何 昱,等.基于脂质代谢紊乱探讨丹红注射液对高脂血症大鼠的降脂作用及机制[J].中国中药杂志,2020,45(13):3203-3210.
[21] 王秋丽,张瑞英.PPARα在心血管疾病中作用机制的研究进展[J].临床与病理杂志,2022,42(2):449-454.
[22] 丁萍萍,张陆勇.过氧化物酶体增殖物激活受体α在脂质代谢中的作用研究进展[J].临床合理用药杂志,2019,12(4):177-179.
[23] 杨 光,杜云龙,朱开梅,等.定心藤总黄酮对高脂血症大鼠降血脂的作用研究[J].重庆医学,2017,46(4):433-435,438.
[24] 马培志,陈金秀.葛根总黄酮对高脂血症大鼠代谢指标及肝组织病理形态的影响[J].中国老年学杂志,2021,41(12):2626-2629.
[25] YANG S Y, LIU L, MENG L K, et al. Capsaicin is beneficial to hyperlipidemia, oxidative stress, endothelial dysfunction, and atherosclerosis in Guinea pigs fed on a high-fat diet[J]. Chemico-Biological Interactions, 2019, 297: 1-7.
[26] BUSCH C J, HENDRIKX T, WEISMANN D, et al. Malondialdehyde epitopes are sterile mediators of hepatic inflammation in hypercholesterolemic mice[J]. Hepatology, 2017, 65(4): 1181-1195.
[27] 王若利,王 瀟,岳红梅.紫檀芪对肺纤维化小鼠的抗氧化作用研究[J].中国临床药理学杂志,2021,37(5):532-535.
[28] 李成鹏,雷 杰,祝 炜,等.基于PPAR信号通路探讨辛温通阳中药对动脉粥样硬化大鼠的保护性机制[J].湖北中医药大学学报,2020,22(1):9-13.
[29] 欧 露,彭乐乐,田 英,等.卵磷脂胆固醇酰基转移酶的研究进展[J].医学综述,2015,21(15):2715-2717.
[30] 杨武英,吴磊燕,洪艳平,等.芦荟蒽醌对高脂血症小鼠脂代谢及LPL、MTTP基因mRNA表达的影响[J].中国食品学报,2018,18(12):13-21.
[31] 王 杰,贾连群,宋 囡,等.四君子汤通过铁死亡途径改善动脉粥样硬化小鼠肝脏脂质沉积[J].解剖科学进展,2021,27(1):75-78.
[32] XIA B, LIN P, JI Y B, et al. Ezetimibe promotes CYP7A1 and modulates PPARs as a compensatory mechanism in LDL receptor-deficient hamsters[J]. Lipids in Health and Disease, 2020, 19(1): 24.55C3C0E9-68E2-481D-AC96-F072FCF997D7
