条芩与枯芩的指纹图谱建立、抗炎活性及谱效关系研究
2022-07-02贾传青郭兰萍王晓于宗渊陈龙董红敬
贾传青 郭兰萍 王晓 于宗渊 陈龙 董红敬





关键词黄芩;条芩提取物;枯芩提取物;指纹图谱;抗炎活性;谱效关系
黄芩为唇形科植物黄芩Scutellaria baicalensisGeorgi 的干燥根,为临床常用中药,具有清热燥湿、泻火解毒、止血安胎的功效[1]。黄芩生长至3年以上者,其根部上段(老根)木心出现中空、腐朽,但下段仍致密、坚实。由其坚实的下段根部所制饮片为条芩,由其中空、腐朽的上段根部所制饮片为枯芩。《本草经集注》记载:“圆者名条芩为胜,破者名宿芩,其腹中皆烂,故名腐肠,惟取深色坚实者为好”[2];《药品化义》曰:“一品宜分两用,盖枯芩体轻主浮,专泻肺胃上焦之火,而条芩体重主降,专泻大小肠下焦之火”[3];《本草易读》记载:“中枯而飘者名枯芩,泻肺利气,止嗽化痰,除风热,清肌表宜之。细实而坚者名条芩,泻大肠火,除湿止痢,养阴退阳”[4]。由此可见,条芩与枯芩的划分是历代中医药学家的实践总结。然而,目前临床处方均为“黄芩”,并未对条芩和枯芩进行区分,这可能会影响黄芩临床应用的精准化。
现代研究表明,黄芩含有黄酮、挥发油、多糖等活性成分,具有抗炎、抗菌、抗肿瘤等多种药理活性,其抗炎活性尤为突出[5-8]。炎症是导致多种疾病的关键因素,包括心脑血管疾病、肺疾病等[9]。因此,从成分及抗炎活性角度探讨条芩与枯芩的区别,对两者的临床精准应用具有重要的意义。中药指纹图谱是中药谱效关系研究的基础,其能够整体、系统地表征中药主要化学成分的相似性;化学模式识别可体现样品间的差异,从而全面、准确地反映样品的内在质量[10-11]。基于此,本研究拟采用高效液相色谱(high performance liquid chromatography,HPLC)法建立条芩和枯芩的指纹图谱,并进行化学模式识别分析;同时拟采用脂多糖(lipopolysaccharide,LPS)诱导RAW264.7 细胞建立炎症模型,探讨条芩、枯芩抗炎活性的差异,并通过灰色关联分析法初步研究其谱效关系,旨在为条芩与枯芩的抗炎活性物质基础研究及临床应用提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有ACCHROM-S6000 型HPLC仪[华谱科仪(北京)科技有限公司],Eclipse Ts2 型倒置显微镜(日本Nikon 公司),Spark 型多功能酶标仪(瑞士Tecan 公司),BXM-50VE型立式壓力蒸汽灭菌器(上海博讯医疗生物仪器股份有限公司),Scientz-10N型冷冻干燥机(宁波新芝生物科技股份有限公司),DZKW-C型单列双孔电热恒温水浴锅(上海树立仪器仪表有限公司),TGL-16A型医用离心机(湖南平凡科技有限公司),LAB DANCER S25 型微型涡旋振荡器(德国IKA 公司),HFsafe-1200LC型生物安全柜、HF90 型CO2培养箱(上海力申科学仪器有限公司)等。
1.2 主要药品与试剂
DMEM 高糖培养基(批号GP21080140836)购自武汉赛维尔生物科技有限公司;胎牛血清(fetal bovineserum,FBS,批号1928703)购自以色列Biological Industries公司;LPS(批号059M4173V)购自美国Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号1209M036)、MTT(批号823L051)均购自北京索莱宝科技有限公司;一氧化氮(nitric oxide,NO)检测试剂盒( 批号032519190612)购自上海碧云天生物技术有限公司;小鼠白细胞介素6(interleukin-6,IL-6)、IL-1β酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号分别为279559-002、267273-007)均购自美国Thermo Fisher Scientific公司;乙腈为色谱纯,磷酸为分析纯,水为超纯水。
5 批条芩和5 批枯芩药材分别购自各地药材市场、药房或自采,经山东中医药大学药学院李佳教授鉴定为唇形科黄芩属植物黄芩S. baicalensis Georgi 的干燥根。购买或采收后,各药材样品按2020 年版《中国药典》(一部)“黄芩”项下“黄芩片”的制备工艺制成相应饮片[1],备用。5批条芩和5 批枯芩药材样品的来源信息见表1。
1.3 细胞
小鼠单核巨噬细胞RAW264.7 细胞株购自中国医学科学院基础研究所。
2 方法与结果
2.1 HPLC指纹图谱的建立
2.1.1 供试品溶液的制备称取各饮片粉末约0.5 g,加入10 倍量的70%乙醇,称定质量,加热回流提取2 h,放冷,再次称定质量,用70%乙醇补足减失的质量,经0.45μm微孔滤膜,滤过,即得。
2.1.2 色谱条件以Symmetry® C18(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~15 min,10%A→20%A;15~36min,20%A→25%A;36~50 min,25%A→38%A;50~55 min,38%A→45%A;55~65 min,45%A→65%A;65~75 min,65%A→80%A;75~80 min,80%A;80~86 min,80%A→10%A;86~91 min,10%A);流速为1.0 mL/min;检测波长为280 nm;柱温为25 ℃;进样量为5 μL。
2.1.3 精密度试验取“2.1.1”项下供试品溶液(编号K1),按“2.1.2”项下色谱条件连续进样测定6 次,以峰5为参照峰(由于峰5 的保留时间适中、分离度良好、峰面积相对较大,故以其为参照峰),计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD为0.14%~0.58%(n=6),相对峰面积的RSD为0.46%~3.21%(n=6),表明方法精密度良好。
2.1.4 稳定性试验取“2.1.1”项下供试品溶液(编号K1),分别于室温下放置0、3、6、9、15、24 h 时按“2.1.2”项下色谱条件进样测定,以峰5 为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD为0.17%~1.14%(n=6),相对峰面积的RSD为1.23%~4.66%(n=6),表明供试品溶液于室温下放置24 h 内稳定性良好。
2.1.5 重复性试验精密称取饮片样品(编号K1)粉末,共6 份,按“2.1.1”项下方法制备供试品溶液,再按“2.1.2”项下色谱条件进样测定,以峰5 为参照峰,计算各共有峰的相对保留时间和相对峰面积。结果显示,各共有峰相对保留时间的RSD为0.14%~0.64%(n=6),相对峰面积的RSD为0.67%~3.76%(n=6),表明方法重复性良好。
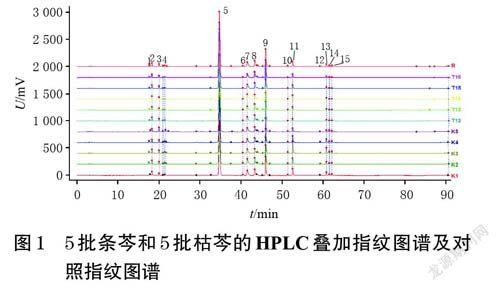
2.1.6 指纹图谱的建立分别取5 批条芩、5 批枯芩饮片样品粉末,按“2.1.1”项下方法制备供试品溶液,再按“2.1.2”项下色谱条件进样测定,记录色谱图。将色谱数据导入《中药色谱指纹图谱相似度评价系统(2012 版)》,以色谱峰分离度好、信号强度相对较高的K1 样品为参照,经多点校正后,采用中位数法生成条芩和枯芩的HPLC叠加指纹图谱及对照指纹图谱(R)。结果显示,5批条芩和5批枯芩饮片共有15个共有峰,详见图1。
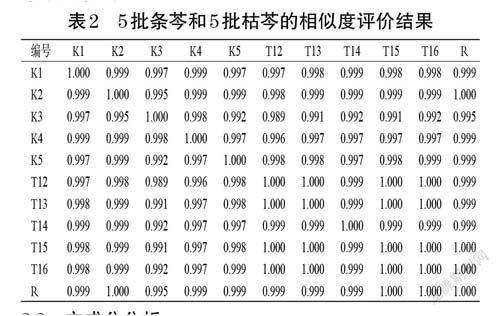
2.1.7 相似度评价以对照指纹图谱(R)为参照,采用《中药色谱指纹图谱相似度评价系统(2012 版)》对5 批条芩和5 批枯芩的指纹图谱进行相似度评价。结果显示,5 批条芩和5 批枯芩指纹图谱与对照图谱的相似度均大于0.990,表明指纹图谱暂无法区分条芩与枯芩。结果见表2。
2.2 主成分分析
以15 个共有峰的峰面积为变量,采用SIMCA 14.1软件进行主成分分析(principal component analysis,PCA)。结果显示,所建PCA模型的解释能力参数(R2X)为0.962,预测能力参数(Q2)为0.613,均大于0.5,表明该模型拟合良好[12]。条芩与枯芩分别位于PCA得分图(图2)的两侧,其中条芩的聚集程度较高,枯芩则较分散,提示该法可区分条芩与枯芩。载荷图中,变量离原点越远,表示其对主成分的影响权重越大[13]。由共有峰的PCA 载荷图(图3)可知,主成分1 的主要信息来自于峰1、3~4、6、10~15,主成分2 的主要信息来自于峰2、5、7~9,其中对主成分1 影响权重较大的变量为峰12、14、15,对主成分2影响权重较大的变量为峰2、7。
2.3 正交偏最小二乘法-判别分析
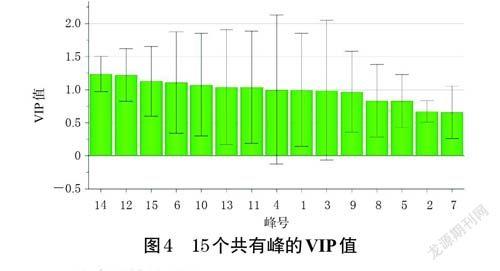
以15 个共有峰的峰面积为变量,采用SIMCA 14.1软件进行正交偏最小二乘法-判别分析(orthogonal partialleast-squares discrimination analysis,OPLS-DA)。变量重要性投影(variable importance in projection,VIP)是评价变量对分类贡献的常用指标,VIP 值>1 表示该变量对分类的贡献率较大,为组间特征性成分[14]。本研究以VIP 值>1 为标准筛选影响条芩和枯芩质量的差异标志物。结果显示,共有8 个峰的VIP值>1,依次为峰14、12、15、6、10、13、11、4,表明这8 個峰对应的成分可能是影响条芩和枯芩质量的差异标志物。结果见图4。
2.4 抗炎活性的测定
2.4.1 提取物和样品母液的制备取条芩、枯芩饮片各约30 g,加入10 倍量的70%乙醇,加热回流提取2 h,滤过,取滤液,减压浓缩至无醇味,冷冻干燥,制得各饮片样品的提取物冻干粉(得率为47%~52%)。称取各冻干粉10 mg,加DMSO 溶解,制成质量浓度均为200mg/mL(以提取物质量计)的样品母液,备用。
2.4.2 细胞毒性评价采用MTT法进行检测。取对数生长期的RAW264.7 细胞,按1.0×106个/mL 接种于96 孔板中,置于37 ℃、5%CO2培养箱中培养24 h(培养条件下同)后,弃去上清液。将细胞分为空白对照组和给药组,每组设置6 个复孔。空白对照组加入含5%FBS 的DMEM高糖培养基,给药组加入不同浓度的样品溶液(质量浓度分别为25、50、100、200、400 μg/mL,取“2.4.1”项下样品母液,用含5%FBS的DMEM高糖培养基稀释而得,质量浓度参考前期预实验设置),每孔100 μL。继续培养24 h 后,按50 μL/孔加入1 mg/mL 的MTT溶液;继续培养4 h 后,弃去上清液,每孔加入DMSO 100 μL,采用酶标仪于490 nm 波长下检测各孔的吸光度(A)值,并按下式计算细胞存活率(%):细胞存活率(%)=(A 给药组/A 空白对照组)×100%。结果显示,经25~400 μg/mL的提取物作用24 h 后,各给药组细胞的平均存活率均大于97%,表明各质量浓度的条芩和枯芩提取物对细胞均无毒性,详见表3。
2.4.3 NO抑制率的测定取对数生长期的RAW264.7细胞,按1.0×106个/mL接种于96 孔板中,培养24 h 后,弃去上清液。将细胞分为空白对照组、LPS 模型组和给药组,每组设置4 个复孔。空白对照组加入含5%FBS 的DMEM高糖培养基,LPS模型组加入含500 ng/mL LPS、5%FBS 的DMEM高糖培养基[15],给药组加入50 μg/mL样品溶液(质量浓度根据前期预实验和“2.4.2”项下实验结果设置),每孔100 μL。继续培养24 h 后,取每孔上清液50 μL,接种至新的96 孔板中,根据NO检测试剂盒说明书进行操作,采用酶标仪于540 nm波长下检测各孔的A 值,采用格里斯法计算NO含量并根据标准曲线计算NO释放量,再按下式计算NO抑制率:NO抑制率(%)=(NO释放量LPS 模型组-NO释放量给药组)/NO 释放量LPS 模型组×100%。采用GraphPad Prism 8.0 软件进行分析,数据均以x ± s 表示,采用t 检验,检验水准α =0.05。采用GraphPad Prism 8.0 软件计算各样品的半数有效浓度(median effective concentration,EC50)。
测定结果显示,50 μg/mL 枯芩提取物的NO抑制率为62.14%~71.13%,条芩提取物为39.52%~50.19%,前者的平均值显著高于后者(P<0.05);枯芩提取物的EC50为18.81~34.10 μg/mL,条芩提取物为46.67~68.34μg/mL,前者的平均值显著低于后者(P<0.05)。结果见表4。
2.4.4 IL-6、IL-1 β 抑制率的测定取对数生长期的RAW264.7 细胞,按1.0×106个/mL 接种于96 孔板中,培养24 h 后,弃去上清液。将细胞分为空白对照组、LPS模型组和给药组,每组设置4 个复孔。空白对照组加入含5%FBS 的DMEM 高糖培养基,LPS 模型组加入含500 ng/mL LPS、5%FBS 的DMEM高糖培养基[15],给药组加入50 μg/mL的样品溶液(质量浓度根据前期预实验和“2.4.2”项下实验结果设置),每孔100 μL。继续培养24 h 后,取每孔上清液30 μL,根据ELISA试剂盒说明书进行操作,采用酶标仪于470 nm 波长下检测各孔的A值,根据标准曲线计算IL-6、IL-1β的释放量,并按下式计算IL-6 或IL-1β的抑制率(%):抑制率(%)=(IL-6 或IL-1β释放量LPS 模型组-IL-6 或IL-1β释放量给药组)/IL-6 或IL-1β释放量LPS模型组×100%。统计学方法同“2.4.3”项。
测定结果显示,50 μg/mL 枯芩提取物对IL-6、IL-1β的抑制率分别为3.32%~18.38%、93.12%~95.47%,条芩提取物分别为6.21%~22.55%、94.10%~96.44%;其中枯芩提取物的平均IL-6 抑制率显著低于条芩提取物(P<0.05),而枯芩与条芩提取物的平均IL-1β抑制率比较,差异无统计学意义(P>0.05)。结果见表4。
2.5 灰色关联分析2.5.1 原始数据的无量纲化处理由于原始数据数列单位或量纲不同,不便于比较,因此在进行灰色关联分析前需要对数据进行无量纲化处理。本研究采用均值变换法,即用各序列元素分别除以相应序列平均值。将NO、IL-6、IL-1β抑制率均值化处理后的数据设为参考序列Y(k)(k=1、2、3…10,为样品编号),15 个共有峰峰面积均值化处理后的数据设为比较序列Xi(k)(i=1、2、3…15,为共有峰峰号),按下式计算绝对差序列Δi(k):Δi(k)=|Y(k)-Xi(k)|[16]。
2.5.2 关联系数的计算对于参考序列Y(k)有若干个比较序列Xi(k),绝对差序列中的最小值与最大值分别记为Δ(min)、Δ(max);ρ为分辨系数,一般为0~1,通常取0.5;按下式计算关联系数ξi(k):ξi(k)=[Δ(min)+ρ×Δ(max)]/[Δi(k)+ρ×Δ(max)]。本研究中,参考序列为NO 抑制率时,Δ(min)=0.001 3,Δ(max)=1.782 5;参考序列为IL-6 抑制率时,Δ(min)=0.033 8,Δ(max)=2.639 8;参考序列为IL-1β抑制率时,Δ(min)=0.001 3,Δ(max)=1.971 7。
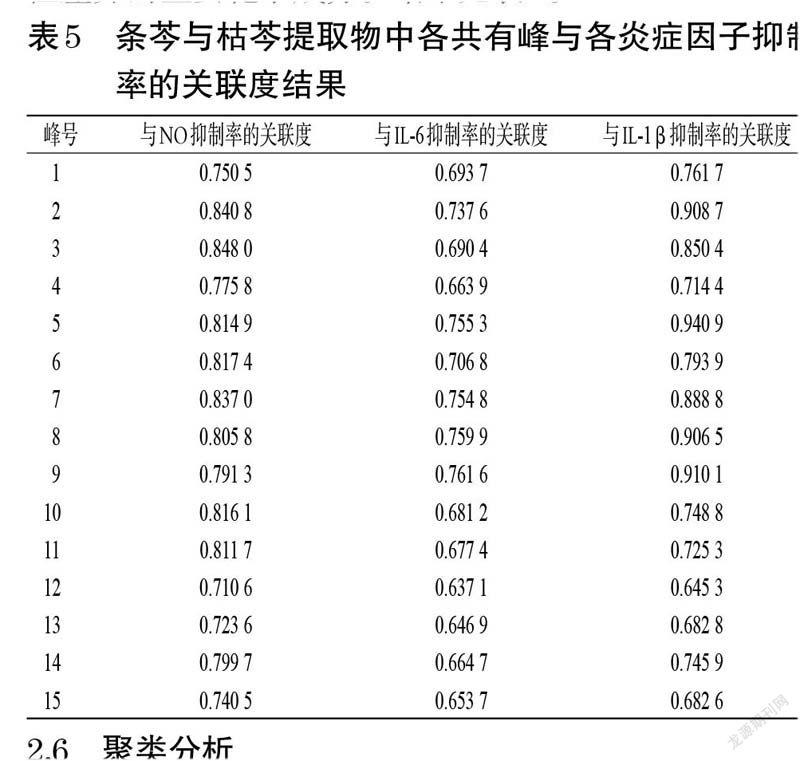
2.5.3 关联度的计算关联度(r)为各类关联系数的平均值,按下式计算:r=1nΣk=1nξi(k)(式中,n 表示比较序列的数据个数)[16-17];当r≥0.9 时,表示子序列对母序列有显著影响;当0.8≤r<0.9 时,表示有相对显著影响;当0.7≤r<0.8 时,表示有明显影响;当0.6≤r<0.7 时,表示有较小影响[18]。结果显示,条芩与枯芩提取物中15 个共有峰与各炎症因子抑制率的关联度均大于0.6;与NO抑制率的关联度由大到小依次为峰3>峰2>峰7>峰6>峰10>峰5>峰11>峰8>峰14>峰9>峰4>峰1>峰15>峰13>峰12,与IL-6 抑制率的关联度由大到小依次为峰9>峰8>峰5>峰7>峰2>峰6>峰1>峰3>峰10>峰11>峰14>峰4>峰15>峰13>峰12,与IL-1β抑制率的关联度由大到小依次为峰5>峰9>峰2>峰8>峰7>峰3>峰6>峰1>峰10>峰14>峰11>峰4>峰13>峰15>峰12。其中,峰2~3、5~8、10~11 与NO抑制率的关联度均大于0.8;峰2、5、8~9 与IL-1β抑制率的关联度均大于0.9;各峰与IL-6 抑制率的关联度均小于0.8。由于条芩和枯芩提取物对IL-6 的抑制率均较低,对NO、IL-1β的抑制率均较高,初步确定峰2~3、5~11 为黄芩抗炎活性的主要成分;同时,结合“2.3”项下结果,初步确定峰6、10~11 为造成条芩与枯芩抗炎活性差异的主要化学成分。结果见表5。
2.6 聚类分析
以50 μg/mL 浓度下各组细胞的NO、IL-1β、IL-6 抑制率为指标,利用平方欧氏距离为测度,采用SPSS 26.0软件进行聚类分析。结果显示,当平方欧氏距离为25时,10 批样品可聚为2 类,K1~K5 为一类,T12~T16 为一类,表明可将NO、IL-1β、IL-6 抑制率作为区分条芩与枯芩的指标。结果见图5。
3 讨论
本研究建立了5 批条芩和5 批枯芩的HPLC指纹图谱,确定了15 个共有峰,相似度均大于0.990,表明指纹图谱不能区分条芩和枯芩。PCA结果显示,条芩与枯芩分别位于得分图的两侧,其中条芩的聚集程度较高,枯芩则较分散,提示该法可区分条芩和枯芩。同时,推测枯芩较为分散的原因可能与采收年限的不同有关。OPLS-DA结果显示,有8个峰的VIP值>1,表明这8个峰对应的成分可能是影响条芩和枯芩质量的差异标志物。
由于NO是氧化应激反应的主要介质,而氧化应激能参与并加剧炎症反应;肿瘤坏死因子α(tumor necrosisfactor-α,TNF-α)、IL-1β、IL-6 是由巨噬细胞产生的促炎性细胞因子,可介导炎症反应的发生;NO、TNF-α、IL-1β、IL-6 是学者们关注较多的炎症因子[19],加之本课题组前期研究发现,在50 μg/mL 质量浓度下,条芩和枯芩提取物对TNF-α无明显的抑制作用,但对IL-1β的抑制作用显著,虽然条芩和枯芩提取物对IL-6 的抑制作用较弱,但组间比较仍有显著的差异性,故综合考虑,選择NO、IL-1β、IL-6 作为评价条芩和枯芩抗炎活性差异的指标。
本研究结果显示,各给药组的NO抑制率、IL-6 抑制率差异显著,两种提取物对IL-1β的抑制率均较高。为在相同质量浓度下比较提取物对各炎症因子的抑制率,故仅对50 μg/mL 提取物对应的数据进行比较。结果显示,在50 μg/mL 质量浓度下,枯芩提取物的平均NO抑制率显著高于条芩提取物,平均EC50、平均IL-6 抑制率均显著低于条芩提取物;两种提取物对IL-1β的抑制率均大于90%。这表明在50 μg/mL 质量浓度下,枯芩提取物对NO的抑制作用较强,但对IL-6 的抑制作用较弱,对IL-1β的抑制作用与条芩提取物相当。
灰色关联分析结果显示,峰2~3、5~8、10~11 与NO抑制率的关联度均大于0.8;峰2、5、8~9 与IL-1β抑制率的关联度均大于0.9;各峰与IL-6 抑制率的关联度均小于0.8。聚类分析结果显示,当平方欧氏距离为25时,10 批样品可聚为2 类,K1~K5 为一类,T12~T16 为一类,表明可将NO、IL-1β、IL-6 抑制率作为区分条芩与枯芩的指标。结合灰色关联分析和OPLS-DA 结果,初步确定峰6、10~11 为条芩和枯芩抗炎活性差异的主要化学成分。这表明黄芩的抗炎活性是多种成分共同作用的结果,该结果可为条芩和枯芩功效差异的进一步研究提供依据。
综上所述,在50 μg/mL 质量浓度下,枯芩提取物对NO的抑制作用较强,但对IL-6的抑制作用较弱,对IL-1β的抑制作用与条芩提取物相当;初步确定峰6、10~11 对应成分是条芩和枯芩抗炎活性差异的主要化学成分。
