蛭龙活血通瘀胶囊对小鼠脑出血及长链非编码RNA和靶基因的影响
2022-07-02谭睿陟钟霞王丽杨思进徐厚平
谭睿陟 钟霞 王丽 杨思进 徐厚平

关键词蛭龙活血通瘀胶囊;脑出血;炎症;长链非编码RNA;转录组测序
脑出血(intracerebral hemorrhage,ICH)是常见的脑卒中类型之一,发病率仅次于脑梗死,具有极高的致残率和致死率[1]。据研究统计,患者脑卒中后1 年的病死率接近60%,仅有20%的患者在脑卒中6 个月后能存活并独立生活[2],且男性发病率远高于女性[3]。可见,脑卒中已严重威胁患者的生命安全,影响患者及其家属的生活质量。ICH 由脑组织出血引起,并可由高血压、动静脉畸形或头部外伤导致,其病理生理学特征为严重的炎症、铁毒性、水肿、氧化应激和凝血酶形成[4]。蛭龙活血通瘀胶囊由水蛭、地龙、大血藤、黄芪、桂枝等药材组成,是西南医科大学附属中医医院研制的院内制剂,被广泛用于ICH 的临床治疗,效果明显[5-6]。此外,多项动物实验研究亦发现,蛭龙活血通瘀胶囊能有效改善大鼠/小鼠ICH 导致的脑损伤,具有显著的脑保护作用[7-9]。然而,蛭龙活血通瘀胶囊干预ICH 的具体作用机制尚不明确。近年来研究发现,部分长链非编码RNA(longnon-coding RNA,LncRNA)参与了染色体沉默、基因组印记、染色质修饰、转录激活、转录干扰、核内运输等多个重要的调控过程[10-12],且在中枢神经系统损伤中扮演关键角色,如诱导ICH 后细胞自噬和神经炎症[13]。本研究拟采用尾状核注射胶原酶以建立ICH小鼠模型,先考察蛭龙活血通瘀胶囊对小鼠ICH的影响,再通过转录组测序分析差异LncRNA并进行基因本体(gene ontology,GO)富集,预测有效LncRNA 和靶基因,最后通过体内实验进行验证,旨在为明确蛭龙活血通瘀胶囊改善ICH后脑损伤的作用机制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括LightCycler480 Ⅱ型实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪(瑞士Roche 公司),Mini-Protein Tetra System 型蛋白质电泳转印系统、ChemiDoc XRS+型凝胶成像系统(美国Bio-Rad 公司),RM2255 型组织切片系统(德国Leica 公司),BX61VS型全自动虚拟切片扫描系统(日本Olympus 公司),NanoDrop 2000 型超微量分光光度计(美国Thermo Fisher Scientific公司)等。
1.2 主要药品和试剂
蛭龙活血通瘀胶囊(批号20180216,规格0.4 g/粒)由西南医科大学附属中医医院制剂室制备;Ⅶ型胶原酶(批号C0773)购自美国Sigma 公司;cDNA 逆转录试剂(批号R323-01)、荧光定量PCR 试剂(批号Q711-03)均购自南京诺唯赞生物科技股份有限公司;苏木精-伊红染色试剂盒(批号C0105)和尼氏染色试剂盒(批号C0117)均购自上海碧云天生物技术有限公司;免疫组化试剂盒(批号PV-9000)和3,3′- 二氨基联苯胺(批号ZLI-9017)均购自北京中杉金桥生物技术有限公司;小鼠白细胞介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体(批号分别为sc-52012、sc-52746、sc-365062)均购自美国Santa Cruz 公司;辣根过氧化物酶标记的山羊抗小鼠免疫球蛋白G二抗(批号31430)和Trizol 总RNA抽提试剂(批号15596026)均购自美国Invitrogen 公司;考马斯亮蓝(批号B104237)购自上海阿拉丁生化科技股份有限公司;SuperSignalTM West Pico PLUS 高敏發光液(批号pierce34580)购自美国Thermo Fisher Scientific 公司;其余试剂均为分析纯,水为蒸馏水。
1.3 实验动物
SPF级雄性C57BL/6 小鼠33 只,8 周龄,购自成都药康生物科技有限公司,动物生产许可证号为SCXK(川)-2020-034。所有小鼠均饲养于西南医科大学动物实验中心动物房内,温度为20~22 ℃,相对湿度为50%~60%,12 h/12 h明暗交替。本实验方案已通过西南医科大学实验动物伦理委员会批准,审批编号为20211111-002。
2 方法
2.1 造模
小鼠经腹腔注射1%戊巴比妥钠麻醉后,头部向上固定于脑立体定位仪上,于前囟区域备皮,用75%乙醇消毒,纵向剪开该处皮肤约1 cm,用3%过氧化氢除去骨膜并暴露前囟及右侧颅骨,定位右侧尾状核(前囟右2.5mm,前囟前左侧0.2 mm),钻孔,注射0.075 U/μL Ⅶ型胶原酶溶液1 μL,进针深度为3 mm,5 min 注射完毕,留针5 min 后以1 mm/min 缓慢出针,骨蜡封闭进针孔,缝合皮肤并消毒。实验过程中保持室温(25±2)℃。术后24 h,待小鼠清醒后进行改良的神经功能缺损评分(modified neurological severity score,mNSS),若mNSS评分≥7 分则提示建模成功[14]。
2.2 分组、给药与采样
2.2.1 药效学观察将24 只小鼠适应性喂养1 周后,随机分为假手术1 组、模型1 组和蛭龙活血通瘀胶囊低、高剂量组[0.35、1.40 g/kg,以水为溶剂,剂量根据成人日剂量(0.08 g/kg)换算并结合多次动物预实验结果设置],每组6 只。模型1 组和各药物组小鼠按“2.1”项下方法复制ICH 模型,假手术1 组小鼠除不注射胶原酶外其余操作同“2.1”项。术后1 h,各药物组小鼠灌胃相应药液,假手术1 组和模型1 组小鼠灌胃生理盐水,每天1 次,连续3d。末次给药后,小鼠腹腔注射1%戊巴比妥钠麻醉,经心脏采血处死后迅速分离大脑,并提取ICH血肿周围组织。血液样品于室温下放置1 h 后,以3 000 r/min 离心15 min,分离血清。脑组织分为两部分,一部分用4%多聚甲醛溶液固定,用于后续形态学观察和免疫组化实验;另一部分冻存于-20 ℃冰箱中,用于后续RNA和蛋白表达检测。
2.2.2 转录组测序将剩余的9 只小鼠适应性饲养1 周后,随机分为假手术2 组、模型2 组和干预组(蛭龙活血通瘀胶囊1.40 g/kg,选择药效学实验中改善效果较好的剂量),每组3 只。小鼠造模和给药同“2.2.1”项。末次给药后,小鼠腹腔注射1%戊巴比妥钠麻醉,经心脏采血处死后迅速分离全脑组织。将全脑组织快速冻存于液氮中,一部分用干冰保存寄往广州基迪奥生物科技有限公司,以提取高质量RNA并进行测序;另一部用于实时定量PCR验证。
2.3 小鼠脑组织形态学观察
取“2.2.1”项下固定于4%多聚甲醛溶液中的脑组织适量,常规石蜡包埋,切片(厚度4 μm),经脱蜡、复水后用苏木精-伊红染料(苏木精染色5 min,伊红染色40 s)、尼氏染料(染色1 h)染色,晾干后用中性树胶封片。使用全自动虚拟切片扫描系统观察各组小鼠的脑组织形态学变化。
2.4 小鼠脑组织中IL-1β、TNF-α表达的检测
采用免疫组化法进行检测。取“2.2.1”项下固定于4%多聚甲醛溶液中的脑组织适量,常规石蜡包埋,切片(厚度4 μm),经脱蜡后用柠檬酸钠缓冲液(pH6.0)微波修复抗原,以5%胎牛血清室温封闭30 min,随后滴加IL-1β、TNF-α一抗(稀释比例均为1 ∶ 200),4 ℃孵育过夜;再滴加生物素标记的二抗,室温孵育1 h 后,使用3,3′-二氨基联苯胺(稀释20 倍)显色,苏木精复染细胞核,晾干后用中性树胶封片。使用全自动虚拟切片扫描系统采集图片并评估IL-1β、TNF-α表达情况,阳性细胞被染成棕色,棕色越深即表达越强。
2.5 小鼠脑组织中IL-1β、TNF-α蛋白表达的检测
采用Western blot 法进行检测。取“2.2.1”项下冻存的脑组织适量,液氮研磨后加入RIPA裂解液冰上孵育30 min,超声(功率200 W,频率20 kHz)处理2 s×5 次;以13 000 r/min 离心10 min,取上清液,用考马斯亮蓝法测定蛋白浓度。取100 ℃加热变性的蛋白70 μg 进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,100 V转膜60 min 后将蛋白转印至聚偏二氟乙烯膜上,用5%胎牛血清室温封闭1 h,分别加入IL-1β、TNF-α一抗(稀释比例均为1 ∶1 000)和GAPDH一抗(稀释比例为1 ∶5 000),4 ℃孵育过夜;随后加入辣根过氧化物酶标记的山羊抗小鼠免疫球蛋白G二抗(稀释比例为1 ∶5 000),室温孵育1 h,用高敏发光液浸泡30 s 后置于凝胶成像系统下成像。使用Image J V1.8.0 软件分析蛋白的条带灰度值,以GAPDH为内参计算目标蛋白的相对表达量。
2.6 小鼠脑组织中IL-1β、TNF-α mRNA和有效LncRNA及靶基因表达的检测
采用实时定量PCR 法进行检测。取“2.2.1”项下冻存或“2.2.2”项下液氮中的脑组织适量,液氮研磨后加入Trizol 总RNA抽提试剂提取总RNA。使用超微量分光光度计测定RNA浓度和纯度后,每个样本取RNA 1 μg进行逆转录以制备相应的cDNA。cDNA经无酶水40 μL稀释后,采用基于SYBR green 体系的PCR 试剂进行PCR 扩增。PCR 反应体系(10 μL)包含上/下游引物各0.5 μL、2×扩增试剂5 μL、cDNA模板1 μL、无酶水3 μL。PCR反应条件如下:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸20 s,共40 个循环。采用2-ΔΔCt法,以GAPDH为内参计算目标基因的相对表达量。所有引物均由生工生物工程(上海)股份有限公司合成,引物序列及产物长度见表1。
2.7 转录组测序数据处理
为保证数据质量,需要在信息分析之前对原始的RNA数据进行分析和过滤,以减少无效数据对结果造成的干扰。本研究利用Fastp 软件对测序得到的原始數据(raw reads)进行质量分析,过滤低质量数据[15];利用R V4.0.4 软件“DESeq2 包”筛选高质量数据中的差异LncRNA,标准为错误发现率(false discovery rate,FDR)<0.05 且|样品间表达量比值[log2(FC)]|>1[16];根据差异LncRNA与其邻近蛋白编码基因相关(顺式mRNA),或差异LncRNA与其共表达的蛋白编码基因相关(反式mRNA)分析得到与差异LncRNA 关联的顺式或反式mRNA[17];将顺式或反式mRNA数据导入GO数据网站(http://geneontology.org)进行功能分类并富集,应用超几何检验找出与整个基因组背景相比显著富集的GO条目;利用R V4.0.4 软件“热图(heat map)包”对差异LncRNA表达模式进行层级聚类分析,并使用热图呈现聚类结果。蛭龙活血通瘀胶囊干预相关有效LncRNA的筛选标准如下:在模型2 组中找出与假手术2 组相比有显著差异的LncRNA,且其在干预组中的表达相对于模型组有明显改善,此LncRNA即为蛭龙活血通瘀胶囊干预ICH相关的有效LncRNA。
2.8 统计学方法
采用SPSS 21.0 软件对数据进行统计分析。数据以x±s 表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
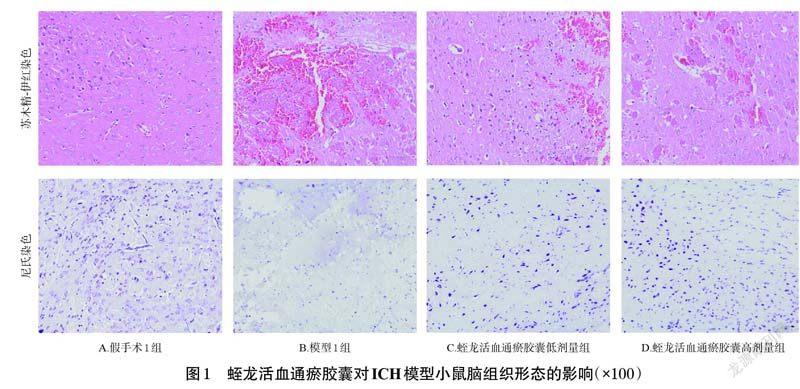
3.1 蛭龙活血通瘀胶囊对ICH模型小鼠脑组织形态的影响
苏木精-伊红染色结果(图1)显示,与假手术1 组比较,模型1 组小鼠脑组织病理损伤严重,细胞间隙增大、排列紊乱;与模型1 组比较,蛭龙活血通瘀胶囊低、高剂量组小鼠脑组织病理损伤均有所减轻,其中高剂量组的改善效果更明显。尼氏染色结果(图1)显示,与假手术1组比较,模型1 组小鼠神经元大量减少,脑神经损坏严重;与模型1 组比较,蛭龙活血通瘀胶囊低、高剂量组小鼠神经元均有所恢复,其中高剂量组恢复更佳。
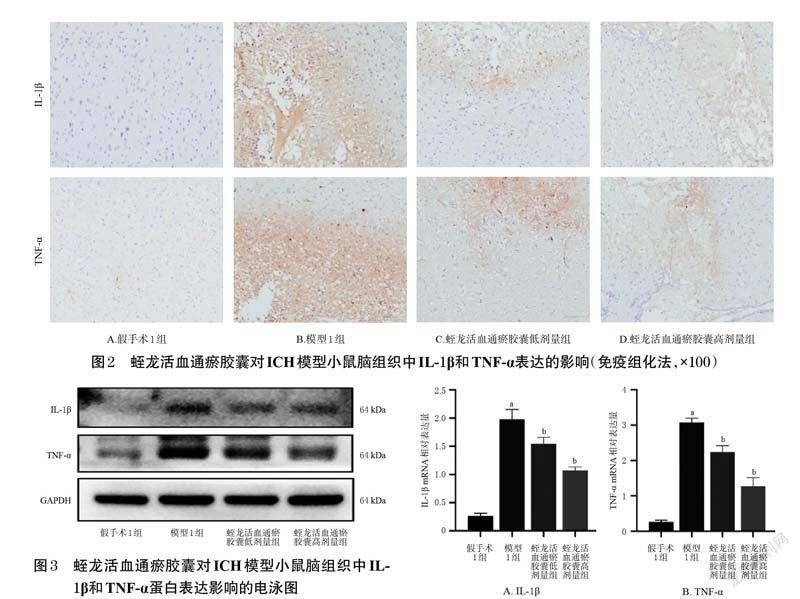
3.2 蛭龙活血通瘀胶囊对ICH模型小鼠脑组织中炎症因子IL-1β和TNF-α表达的影响
3.2.1 免疫组化法模型1 组小鼠脑组织中IL-1 β和TNF-α的表达水平均高于假手术1 组,而蛭龙活血通瘀胶囊低、高剂量组小鼠脑组织中IL-1β和TNF-α的表达水平均低于模型1 组。结果见图2。
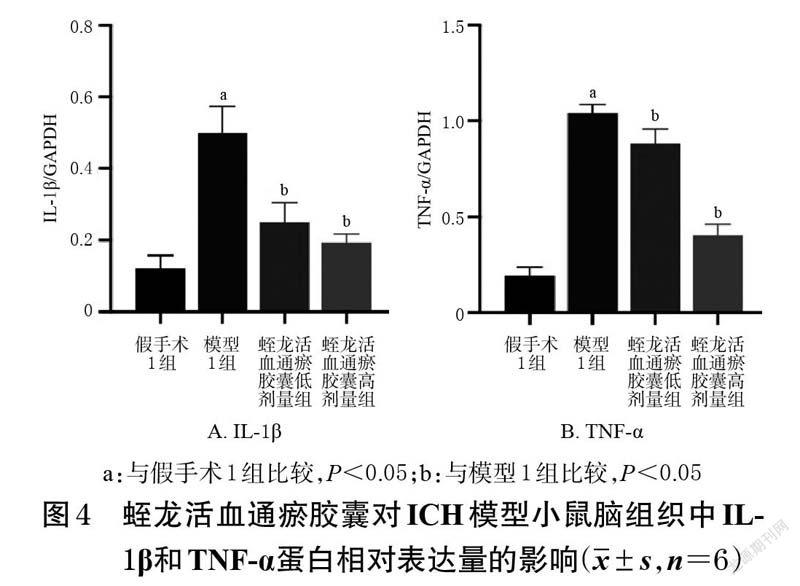
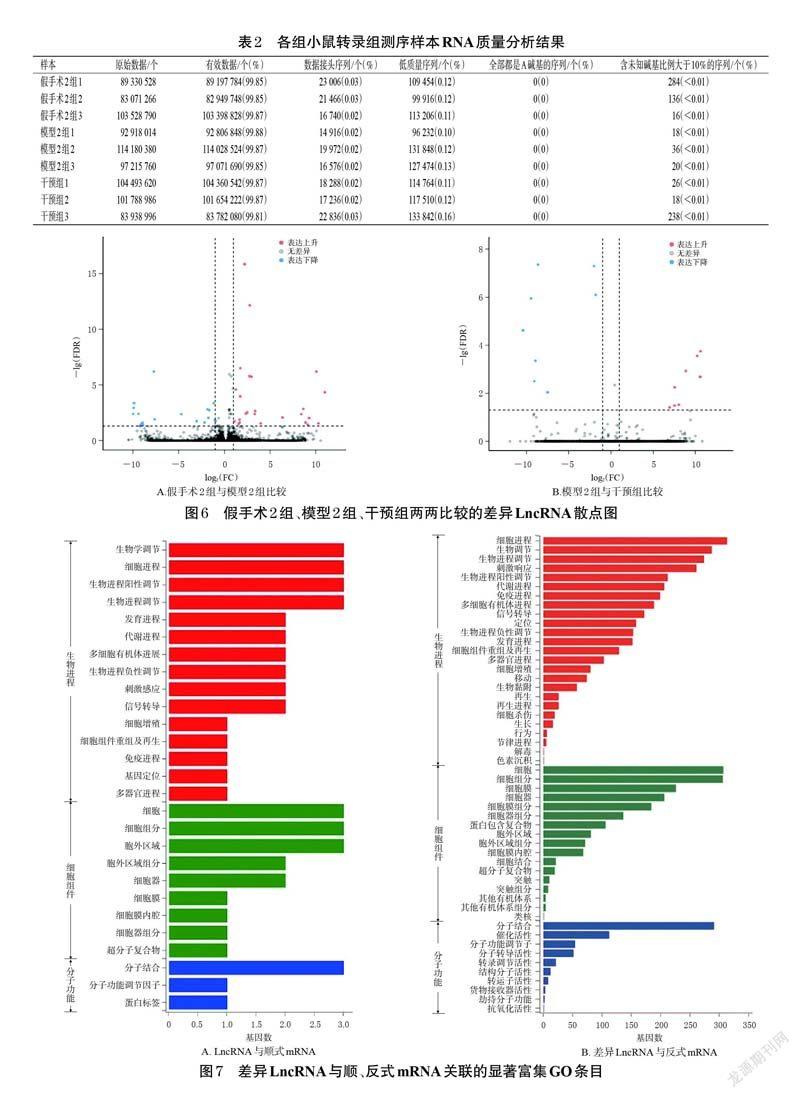
3.2.2 Western blot 法与假手术1 组比较,模型1 组小鼠脑组织中IL-1β、TNF-α蛋白的相对表达量均显著升高(P<0.05);与模型1 组比较,蛭龙活血通瘀胶囊低、高剂量组小鼠脑组织中IL-1β、TNF-α蛋白的相对表达量均显著降低(P<0.05)。结果见图3、图4。
3.2.3 实时定量PCR 法与假手术1 组比较,模型1 组小鼠脑组织中IL-1β、TNF-α mRNA的相对表达量均显著升高(P<0.05);与模型1 组比较,蛭龙活血通瘀胶囊低、高剂量组小鼠脑组织中IL-1β、TNF-α mRNA的相对表达量均显著降低(P<0.05)。结果见图5。
3.3 转录组测序样本RNA质量分析
除去含数据接头(adapter)序列、含未知碱基比例大于10%序列、全部都是A碱基序列以及低质量序列数据后,所得有效数据(clean data)占比均高于99%,表明数据质量佳。结果见表2。
3.4 差异LncRNA分析
假手术2 组与模型2 组比较,有44 个差异LncRNA,包括显著上升的LncRNA 25 个、显著下降的LncRNA 19个;而模型2 组与干预组比较,有16 个差异LncRNA,包括显著上升的LncRNA 8 个、显著降低的LncRNA 8 个。结果见图6。
3.5 GO富集
差异LncRNA 与顺式mRNA关联的相关功能主要集中在生物调节、细胞进程、生物进程阳性调节、发育进程等方面,显著富集的GO条目见图7A;差异LncRNA与反式mRNA关联的相关功能主要集中在刺激响应、代谢调节、免疫进程等方面,显著富集的GO条目见图7B。
3.6 有效LncRNA分析
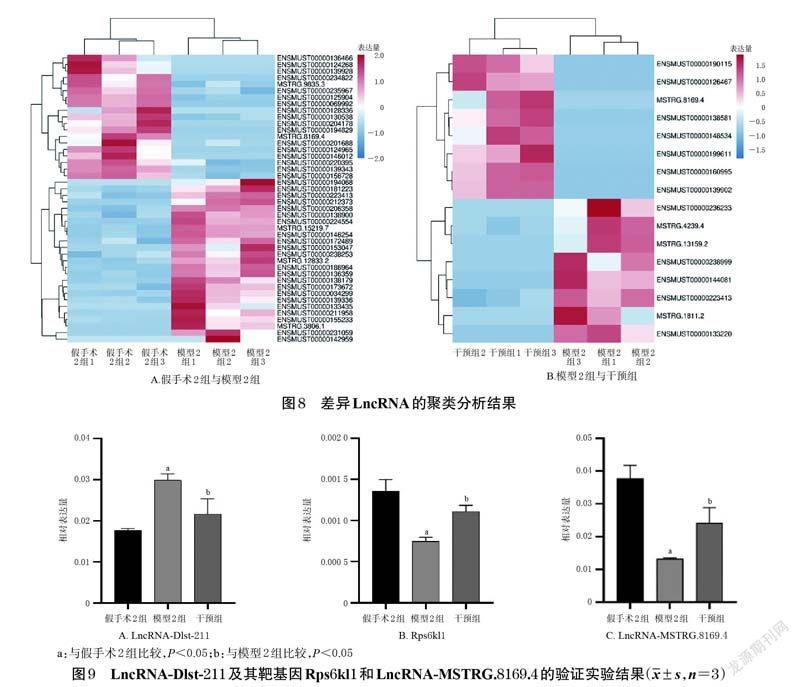
筛选到1 个LncRNA 在模型2 组中表达较假手术2组更高,且经蛭龙活血通瘀胶囊干预后显著下调,经数据库(http://asia.ensembl.org)查询发现其为LncRNADlst-211,其靶基因为ribosomal protein S6 kinase-like 1(Rps6kl1)。此外,还发现LncRNA-MSTRG.8169.4 在模型2 组中低表达,而经蛭龙活血通瘀胶囊干预后显著上调。聚类分析结果见图8。
3.7 有效LncRNA的PCR验证
与假手术2组比较,模型2组小鼠脑组织中Lnc RNADlst-211 的相对表达量显著升高(P<0.05),Rps6kl1、LncRNA-MSTRG.8169.4 的相对表达量均显著降低(P<0.05)。与模型2 组比较,干预组小鼠脑组织中LncRNADlst-211 的相对表达量显著降低(P<0.05),Rps6kl1、LncRNA-MSTRG.8169.4 的相对表达量均显著升高(P<0.05)。结果见图9。
4 讨论
ICH 是一种发病率高、致残率高、致死率高、复发率高的脑血管疾病,好发于中老年人群,严重威胁人们的生命安全和生活质量[18]。现有研究表明,高血压和淀粉样脑血管病是原发性ICH 的主要发病原因;除此以外,颅内动脉瘤、动脉硬化等也是ICH 的发病原因之一[19]。ICH 发病会造成脑组织局部占位性病变,同时释放大量凝血酶,并激活损伤相关分子模式从而释放出大量炎症因子和补体因子,进而诱导脑组织炎症反应、免疫细胞浸润和脑细胞凋亡[20]。尽管针对原发性ICH 损伤的手术已可以减轻神经功能损伤并降低病死率,但是ICH患者的预后依然不佳[21]。因此,减轻ICH 诱导的炎症和继发性脑损伤成为目前ICH临床治疗的主要方向。
中医认为,中风(脑卒中)发生多因风、火、痰、瘀、气、虚等导致人体气血阴阳运行失常、脏腑功能失调,故中医治疗注重祛风、补气、化痰、活血[22-23]。根据多年临床经验,我院杨思进教授结合现代医学理论提出补气通络、活血化瘀、化痰祛风的脑血管疾病治疗方法,并组方蛭龙活血通瘀胶囊。该方主要包含黄芪、水蛭、地龙、大血藤、桂枝等药材,被广泛用于脑卒中的临床治疗,并取得了良好的疗效[24]。本研究结果也证实,蛭龙活血通瘀胶囊能显著改善ICH模型小鼠的脑损伤,促进其脑神经功能恢复,同时能有效降低小鼠脑组织中炎症因子IL-1β、TNF-α的表达,减轻继发性脑损伤,符合目前ICH临床治疗的抗二次损伤策略。
LncRNA 是一种不具备蛋白质编码能力的非编码RNA,其长度超过200 个核苷酸[25]。已有研究证实,LncRNA能参与表观遗传介导的转录、翻译、RNA代谢、细胞自噬和细胞凋亡等进程[26],能调节神经元、小胶质细胞、星形胶质细胞等细胞炎症[27],还与脊髓损伤以及神經退行性疾病的发生有关[28]。基于此,本研究收集蛭龙活血通瘀胶囊干预前后的脑组织,快速提取总RNA后采用转录组测序技术对各组差异LncRNA 予以甄别。结果显示,模型2 组和假手术2 组比较,有44 个差异LncRNA;模型2组和干预组比较,有16个差异LncRNA;通过进一步筛选发现了2 个有效LncRNA,即LncRNADlst-211 和LncRNA-MSTRG.8169.4。笔者通过数据分析发现,LncRNA-Dlst-211 有顺式作用靶基因。顺式作用靶基因预测基本原理认为,LncRNA 的功能与其邻近的蛋白编码基因相关,位于上游的LncRNA 可能与启动子或者共表达基因的其他顺式作用元件有交集,进而在转录时或者转录后对基因的表达进行调控[29]。LncRNA-Dlst-211 的顺式靶基因可能为Rps6kl1,该基因与脑神经发育相关,在脑部及中枢神经系统中呈高表达[30]。本研究在假手术2 组、模型2 组和干预组小鼠脑组织中检测这两个差异LncRNA(LncRNA-Dlst-211 和LncRNA-MSTRG.8169.4)以及LncRNA-Dlst-211 靶基因Rps6kl1 的表达情况,结果显示,PCR验证结果与测序结果一致,即LncRNA-Dlst-211 在模型2 组中的表达升高,在干预组中的表达显著降低,其靶基因Rps6kl1 的表达与之相反;而LncRNA-MSTRG.8169.4 在模型2 组中的表达降低,在干预组中的表达显著升高。
综上所述,蛭龙活血通瘀胶囊能改善ICH 模型小鼠的脑损伤,并减轻炎症反应;其作用机制可能与下调LncRNA-Dlst-211的表达,上调LncRNA-MSTRG.8169.4、Rps6kl1的表达有关。本研究通过转录组测序分析了蛭龙活血通瘀胶囊干预后的差异LncRNA 以及其靶基因,并在体内进行了验证。后续笔者将进一步检测差异LncRNA在脑组织中表达的细胞种类,并探讨其在蛭龙活血通瘀胶囊改善ICH 损伤中的潜在分子机制。本研究有助于从非编码RNA 水平阐明复方蛭龙活血通瘀胶囊改善ICH 的表观遗传机制,为中药干预ICH 的研究开拓了新的思路,为中药药理研究提供了基础科学依据。
