MCAO模型大鼠不同缺血时相、不同脑区Thrombin与LC3Ⅱ/Ⅰ表达的相关性研究
2022-07-02马若梦李定祥彭珣李钰佳阳晶晶邓奕辉
马若梦 李定祥 彭珣 李钰佳 阳晶晶 邓奕辉


〔摘要〕 目的 研究缺血性中风瘀毒互结模型(简称“IS-YD”)大鼠在不同缺血时相、不同脑区凝血酶(Thrombin)与微管相关蛋白1轻链3(light chain 3, LC3)的动态性变化及二者的相关性。方法 将128只SD雄性大鼠随机分为假手术组、IS-YD(2 h、4 h、8 h、12 h、24 h、48 h、72 h)组,每组16只。分别于术后2、4、8、12、24、48、72 h取材前进行神经功能缺损评分,随即处死大鼠取出脑组织并分出大脑皮质与海马,2,3,5-三苯基氯化四氮唑染色观察并计算每组大鼠的脑梗死体积,Western blot法检测大脑皮质与海马的Thrombin、LC3Ⅱ/Ⅰ比值的表达。结果 与假手术组相比,IS-YD 12 h、24 h、48 h组神经功能缺损评分升高(P<0.05)。与假手术组及IS-YD 2 h、4 h组相比,IS-YD 8 h、12 h、24 h、48 h、72 h组脑梗死体积显著增大(P<0.01);与IS-YD 8 h组相比,IS-YD 12 h、24 h、
48 h、72 h组脑梗死体积显著增大(P<0.01);与IS-YD 12 h组相比,IS-YD 48 h、72 h组脑梗死体积显著增大(P<0.01);与IS-YD 24 h组相比,IS-YD 48 h、72 h组脑梗死体积显著增大(P<0.01);与IS-YD 48 h组相比,IS-YD 72 h组脑梗死体积显著增大(P<0.01)。与假手术组相比,IS-YD 12 h、24 h组皮质和海马Thrombin、LC3Ⅱ/Ⅰ表达显著增强(P<0.05);与IS-YD 2 h、4 h组相比,IS-YD 12 h、24 h组皮质和海马Thrombin、LC3Ⅱ/Ⅰ表达显著增强(P<0.05);与IS-YD 8 h组相比,IS-YD 12 h、24 h组皮质LC3Ⅱ/Ⅰ表达显著增强(P<0.01);与IS-YD 12 h组相比,IS-YD 48 h、72 h组皮質Thrombin、LC3Ⅱ/Ⅰ表达显著降低(P<0.05),海马LC3Ⅱ/Ⅰ表达显著降低(P<0.05);与IS-YD 24 h组相比,IS-YD 48 h、72 h组皮质和海马Thrombin、LC3Ⅱ/Ⅰ表达显著降低(P<0.05)。两种蛋白呈现直线相关性,且皮质Thrombin与LC3Ⅱ/Ⅰ的密切程度为56.7%,海马Thrombin、LC3Ⅱ/Ⅰ的密切程度为53.3%。结论 脑损伤后Thrombin与自噬相关蛋白LC3Ⅱ/Ⅰ在7个不同缺血时间点动态表达规律相似,并且具有高度相关性,同时明确了自噬变化最明显的两个时间点,也为进一步研究治疗脑梗死筛选了最佳药物反应时间点。
〔关键词〕 凝血酶;自噬;缺血性中风;瘀毒互结;化瘀解毒法;微管相关蛋白1轻链3;2,3,5-三苯基氯化四氮唑
〔中图分类号〕R255.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.06.005
Correlation of Thrombin and LC3Ⅱ/Ⅰ expression in different ischemic phases and
different brain regions in MCAO model rats
MA Ruomeng1,2, LI Dingxiang3, PENG Xun1,2, LI Yujia1,2, YANG Jingjing1,2, DENG Yihui3*
(1. College of Integrated Traditional Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha,
Hunan 410208, China; 2. Key Laboratory of Hunan Province for Integrated Traditional Chinese and Western Medicine on Prevention and Treatment of Cardio-Cerebral Diseases, Changsha, Hunan 410208, China; 3. College of Traditional Chinese Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective To study the dynamic changes of Thrombin and microtubule-associated protein 1 light chain 3 (LC3) in different ischemic phases and different brain regions in ischemic stroke with blood stasis and toxin interaction model ("IS-YD") and their correlation. Methods A total of 128 SD male rats were randomly divided into sham operation group and IS-YD (2 h, 4 h, 8 h, 12 h, 24 h, 48 h, 72 h) groups, with 16 rats in each group. Neurological deficits were scored at 2, 4, 8, 12, 24, 48, and 72 hours after the operation, respectively, and then the rats were sacrificed to remove the brain tissue, and the cerebral cortex and hippocampus were separated. The volume of cerebral infarction in each group was observed and calculated by 2,3,5-triphenyltetrazole chloride staining, and the expression of Thrombin and LC3Ⅱ/Ⅰ ratio in cerebral cortex and hippocampus was detected by Western blot method. Results Compared with the sham operation group, the IS-YD 12 h, 24 h and 48 h groups had higher neurological deficit scores (P<0.05). Compared with the sham operation group and the IS-YD 2 h, 4 h groups, the cerebral infarction volume in the IS-YD 8 h, 12 h, 24 h, 48 h, and 72 h groups was significantly increased (P<0.01); compared with the IS-YD 8 h group, the volume of cerebral infarction in the IS-YD 12 h, 24 h, 48 h, and 72 h groups increased significantly (P<0.01); compared with IS-YD 24 h group, the cerebral infarction volume of IS-YD 48 h and 72 h groups increased significantly (P<0.01); compared with the 48 h group, the volume of cerebral infarction in the IS-YD 72 h group was significantly increased (P<0.01). Compared with the sham operation group, the expression levels of Thrombin and LC3II/I in the cortex and hippocampus of the IS-YD 12 h and 24 h groups were significantly enhanced (P<0.05); compared with the IS-YD 2 h and 4 h groups, the expression levels of Thrombin and LC3Ⅱ/Ⅰ in the cortex and hippocampus of the IS-YD 12 h and 24 h groups were significantly enhanced (P<0.05); compared with IS-YD 8 h group, the expression of LC3Ⅱ/Ⅰ in the cortex of the IS-YD 12 h and 24 h groups was significantly enhanced (P<0.01); compared with IS-YD 12 h group, the expression levels of Thrombin and LC3II/I in the cortex of the IS-YD 48 h, 72 h groups were significantly decreased (P<0.05), and the expression of LC3II/I in the hippocampus was significantly decreased (P<0.05); compared with IS-YD 24 h group, the expression levels of Thrombin and LC3Ⅱ/Ⅰ in the cortex and hippocampus were significantly decreased (P<0.05). The two proteins showed a linear correlation, and the correlation between Thrombin and LC3Ⅱ/Ⅰ was 56.7% in the cortex and 53.3% in the hippoc?ampus. Conclusion After brain injury, Thrombin and autophagy-related protein LC3Ⅱ/Ⅰ have similar dynamic expression patterns at seven different ischemia time points, and are highly correlated. At the same time, the two time points with the most obvious changes in autophagy are identified, and the optimal time points of drug reaction are screened for further study on the treatment of cerebral infarction.CBA2E9D1-1A87-476B-BD87-B1A5CC4A17F9
〔Keywords〕 Thrombin; autophagy; ischemic stroke; blood stasis and toxin interaction; removing blood stasis and detoxification method; microtubule-associated protein 1 light chain 3; 2,3,5-triphenyltetrazole chloride
急性缺血性脑卒中有缺血性卒中与出血性卒中之分,其中缺血性卒中发病率高达85%,是一种由各种致病因素导致局部脑血流供应出现障碍,从而造成相应脑部组织损伤以及神经功能缺失的一种疾病[1]。其治疗策略主要集中在脑缺血急性期的早期血运重建、紧急介入治疗和应用重组组织型纤溶酶原激活物等血管内治疗,且研究证明,缺血后12~48 h存在神经保护的时间窗[2-3]。溶栓治疗是临床上有效的治疗方法,但受限于其狭窄的时间窗和较高的脑出血风险,故迫切需要寻求新的有效方法控制卒中。中医称该病为“中风”,自秦汉以来,认为其病机无外乎“风火痰瘀虚”五端[4]。随着时代的变迁和历代医家研究的愈发深入,“瘀毒致风”理论逐渐成为该病新的病机学说,瘀毒损伤脑络,使络损神伤,络虚邪气留滞,病理产物不能排出体外,进一步加重原有病情,且致病能力比原病邪有过之而无不及。阐明缺血性卒中疾病的现代生物学实质具有重要的现实意义[5]。
自噬即细胞自我吞噬的过程,是大多数真核生物古老的进化机制[6]。越来越多的证据显示,靶向与自噬相关的信号通路可能是治疗脑缺血的一个有效途径[7-8]。自噬可能是治疗缺血性卒中的新靶点,在缺血性脑损伤期间被激活并且参与神经元死亡的调节[9]。自噬的机制复杂,自噬活性的增强在脑缺血过程中起有益作用还是有害作用尚未有定论且存在着争议[10]。营养因子缺乏、生长因子撤离、高温、缺氧、激素刺激,均可诱导自噬的发生,研究发现,凝血酶(Thrombin)也可诱导脑内自噬的发生,从而加重脑损伤[11-12]。然而缺血性卒中中自噬的时间依赖性变化尚是未知的,且关于通过Thrombin诱导自噬的研究尚少。本文将从Thrombin诱导自噬从而介导脑损伤的角度讨论Thrombin与微管相关蛋白1轻链3(light chain 3, LC3)之间的相关性,从而为关于诱导自噬的研究提供一个新的思路。
1 材料与方法
1.1 动物
健康SPF级雄性大鼠128只,体质量220~240 g,由湖南斯莱克景达动物有限公司提供,动物许可证号:SCXK(湘)2019-0004,实验单位使用许可证编号:SYXK(湘)2019-0009。在湖南中医药大学动物中心饲养,其实验动物环境设施合格证号:SYXK(湘)2015-0003,动物饲养及手术环境温度控制在20~25 ℃,相对湿度50%~70%。
1.2 主要试剂
Thrombin抗体(美国Abcam公司,批号:ab92621);LC3B抗体、β-actin、HRP标记山羊抗兔抗体、HRP标记山羊抗鼠抗体(美国Proteintech公司,批号:14600-1-AP、66009-1-IG、SA00001-2、SA00001-1);2,3,5-三苯基氯化四氮唑(美国Sigma公司,批号:T8877-25G);RIPA裂解液(上海碧云天公司,批号:P0013B);蛋白酶抑制剂(北京金泰宏达公司,批号:583794)。
1.3 主要仪器
摇床、漩涡混合器(江苏其林贝尔公司,型号:TS-1、GL-88B);台式冷冻离心机(湖南湘仪公司,型号:H1650R);电泳仪、电泳槽、转膜仪(北京六一生物科技有限公司,型号:DYY-6C、DYCZ-24DN、DYCZ-40D);生物样品匀浆机(杭州奥盛仪器有限公司,型号:BioPrep-24)。
1.4 实验分组和造模方法
1.4.1 实验分组 先将大鼠在动物中心屏障系统适应性喂养7 d,按照随机数字表法将128只大鼠随机分为假手术组、缺血性中风瘀毒互结模型(简称“IS-YD”)组,按不同的缺血时相将IS-YD组分为IS-YD(2 h、4 h、8 h、12 h、24 h、48 h、72 h)组,每组16只。
1.4.2 缺血性中风瘀毒互结病证结合模型制备 首先参考蒋成婷等[13]建立的方法改良制作,即先将大鼠于动物中心屏障系统内适应性喂养7 d,于第8天腹腔注射1%角叉菜胶50 mg/kg,每天1次,连续3 d,再于第11天皮下注射干酵母混悬液10 mL/kg。24 h后采用可逆性大脑中动脉闭塞(middle cerebral artery occulation model, MCAO)线栓法[14]制备缺血性中风模型,即术前用10%水合氯醛0.003 5 mL/g腹腔注射进行麻醉,取仰卧位固定大鼠,在其颈部备皮并用聚维酮碘消毒,于颈部正中稍右侧作切口,鈍性分离皮下组织,在靠近气管肌旁,用黑色缝合线分离出与迷走神经并行的右颈总动脉,顺着颈总动脉往上找到三叉口,以此继续分离出颈内动脉与颈外动脉,将主动脉夹夹住颈外动脉,于颈总动脉近心端插入头端用石蜡包被的单丝尼龙鱼线,栓线长度自颈总动脉分叉处18~20 mm,再将多余的尼龙线尾部与颈总动脉结扎,随即在切口处撒上阿莫西林粉末,进行缝合处理。假手术组除了不插入栓线,其余操作同IS-YD组。术中记录插入栓线的时间,以此来确定缺血时相和取材时间。术后将大鼠置于饲养笼里,自由进食和饮水。以大鼠手术后出现左侧肢体瘫痪,站立不稳,提尾时向一侧转圈为模型成功的判断标准[14]。
1.4.3 神经功能缺损评分 待动物清醒后,参照Zea Longa评分标准[14]检测动物神经功能缺损评分。0分:无神经功能缺损;1分:不能完全伸展左侧前爪;2分:向左侧转圈;3分:向左侧倾倒;4分:不能自发行走且意识水平低下。1~3分为造模成功,否则弃之不用。CBA2E9D1-1A87-476B-BD87-B1A5CC4A17F9
1.5 标本采集
1.5.1 皮质和海马分离 将术后苏醒的64只大鼠逐个进行神经功能缺损评分并记录,根据插入栓线时间推算每组缺血各时相的取材时间,分别于缺血后2、4、8、12、24、48、72 h,用10%水合氯醛按0.003 5 mL/g的剂量麻醉大鼠后,在冰盒上快速断头取脑,并且分离出大脑皮质和海马置于冻存盒,存放在-80 ℃冰箱里备用。
1.5.2 断头取脑 与上述操作相同,将另外一批64只大鼠快速断头取脑。
1.6 指标检测
1.6.1 2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride, TTC)染色测定脑梗死体积 从
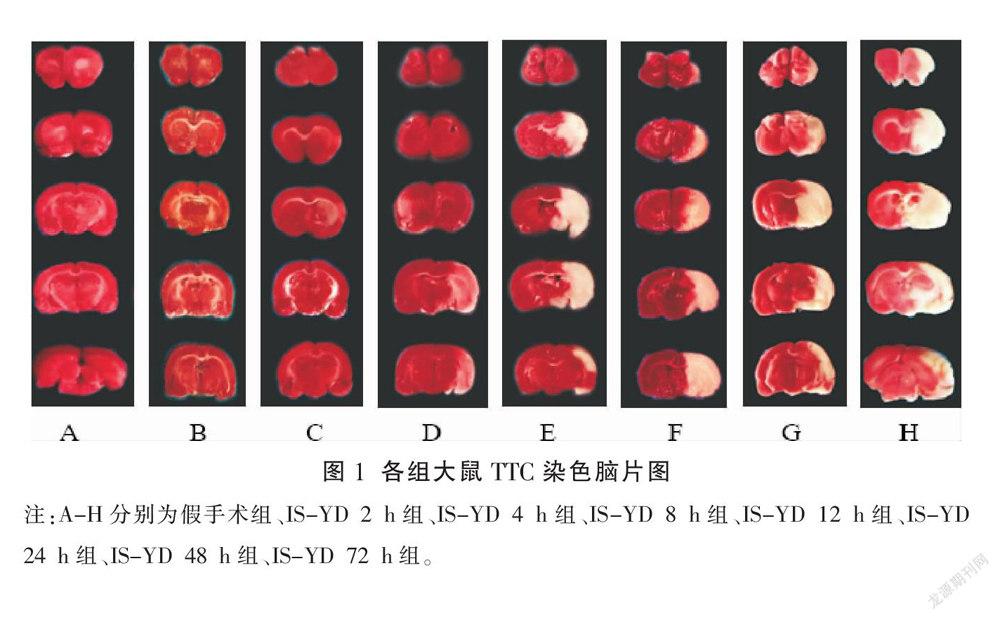
-20 ℃冰箱里取出冰冻鼠脑,放置于脑槽为2 mm的脑切片模具内,在额极与枕极处放置两片刀片以固定大脑便于均匀切片,从视交叉处额极到枕极处连续切5片,厚度均为2 mm,将其置于锡箔纸覆盖的2% TTC溶液中染色,染色后梗死区变为白色,非梗死区呈现红色,为使每片脑片染色均匀,37 ℃水浴锅中孵育15 min,且每5 min翻面,之后转移到放有多聚甲醛的6孔板中进行固定,24 h后进行拍照,拍照注意采用统一角度、高度,尽量保证统一光线。最后使用Image Pro Plus 6.0软件分析计算脑梗死体积所占百分比。
1.6.2 Western blot法检测Thrombin和LC3蛋白的表达水平 分别剪取50 mg的皮质和海马组织,加入500 μL裂解液(RIPA∶蛋白酶抑制剂=50∶1),于4 ℃冰箱预冷的生物样品匀浆机中反复研磨充分裂解,之后4 ℃,12 000 r/min,离心半径为17.8 cm,离心10 min,得到上清液。取100 μL蛋白原液,加入25 μL
5×loading buffer混匀,沸水煮15 min。点样、电泳、转膜封闭后进行抗体孵育[LC3B兔抗(1∶2000)、Thrombin兔抗(1∶1000)、β-actin鼠抗(1∶5000)],将膜与一抗一起孵育,4 ℃过夜,HRP标记的二抗(1∶8000)次日孵育。
1.7 统计学方法
采用SPSS 25.0统计软件统计分析原始数据,以“x±s”表示计量资料,组间比较采用单因素方差分析。方差齐者,组间两两比较采用LSD或SNK法,方差不齐者,则选用Games-Howell方法比较;若不符合正态性分布,则采用多样本秩和检验,即Kruskal-Wallis单因素ANOVA分析,P<0.05代表差异具有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分比较
假手术组大鼠神经功能缺损评分为0分。与假手术组比较,IS-YD 48 h组(P<0.05)和IS-YD 12 h、24 h组(P<0.01)神经功能缺损评分显著升高。详见表1。
2.2 各组大鼠脑组织梗死体积比较
假手术组及IS-YD 2 h、4 h组未发生脑梗死,即脑梗死面积为零。与假手术组及IS-YD 2 h、4 h组相比,IS-YD 8 h、12 h、24 h、48 h、72 h组脑梗死体积显著增大(P<0.01);与IS-YD 8 h组相比,IS-YD 12 h、24 h、48 h、72 h组脑梗死体积显著增大(P<0.01);与IS-YD 12 h、24 h组相比,IS-YD 48 h、72 h组脑梗死体积显著增大(P<0.01);与IS-YD 48 h组相比,IS-YD 72 h组脑梗死体积显著增大(P<0.01)。详见表2、图1。
2.3 各组大鼠Thrombin和 LC3Ⅱ/Ⅰ的表达水平比较
与假手术组相比,IS-YD 12 h、24 h组海马及皮质Thrombin、LC3Ⅱ/Ⅰ表达显著增强(P<0.05,P<0.01);与IS-YD 2 h组相比,IS-YD 12 h、24 h组皮质、海马及IS-YD 48 h组海马Thrombin、LC3Ⅱ/Ⅰ表达显著增强(P<0.05,P<0.01);与IS-YD 4 h组相比,IS-YD 12 h、24 h组皮质、海马及IS-YD 48 h组皮质Thrombin、LC3Ⅱ/Ⅰ表达显著增强(P<0.05);与IS-YD 8 h组相比,IS-YD 12 h、24 h组皮质LC3Ⅱ/Ⅰ表达显著增强(P<0.01);与IS-YD 12 h、24 h组相比,IS-YD 48 h、72 h组皮质及海马Thrombin、LC3Ⅱ/Ⅰ表达显著降低(P<0.05)。详见图2、表3。
2.4 Thrombin与LC3Ⅱ/Ⅰ相关性分析
使用SPSS 25.0软件對大脑皮质、海马Thrombin与LC3Ⅱ/Ⅰ的原始数据进行直线相关分析、建立回归方程。可看出散点图均有一定的直线趋势,且Thrombin与LC3Ⅱ/Ⅰ两个变量均符合正态性分布,故选择Pearson相关分析,分别得出Pearson积差相关系数r皮质为0.753>0.70,P皮质=0.000<0.05;r海马为0.73>0.70,P海马=0.000<0.05,因此二者有直线相关关系。进一步作直线回归方程,分别得出样本回归方程的决定系数R2皮质=0.567,R2海马=0.533。说明大脑皮质、海马的Thrombin与LC3Ⅱ/Ⅰ呈正相关关系,皮质Thrombin与LC3Ⅱ/Ⅰ的密切程度有56.7%,海马二者的密切程度有53.3%。详见图3-4。CBA2E9D1-1A87-476B-BD87-B1A5CC4A17F9
3 讨论
急性脑梗死属本虚标实,是在气血亏虚于内的基础上,合并情志失调、饮食不节、劳倦内伤、年老体衰等诱因而发作,引起脏腑阴阳失调,气血逆乱,上犯于脑,形成脑脉痹阻之缺血中风或者血溢脉外之出血中风。历代医家对中风病的阐述,大多从风、火、痰、气、血、虚方面出发。《素问·至真要大论》云:“诸风掉眩,皆属于肝”“诸暴强直,皆属于风”。基于中医基础理论,肝为风木之脏,肝为刚脏,体阴而用阳,主生发生动,如若各种原因导致精血暗耗,肝阴不足,则致肝阳偏亢,升发太过,形成肝阳化风之象,则为掉眩;严重者加上暴怒的情绪干扰,肝阳暴涨于上,血随气逆,蒙蔽清窍发为中风。《素问·调经论》云“血之与气,并走于上,则为大厥,厥则暴死,气复反则生,不反则死”,说明中风病的病机是由于气血逆乱,并走于上,蒙蔽清窍,神明失守则猝然昏仆。王永炎院士[15]首次提出了“毒损脑络”学说,认为中风病毒邪的产生无外乎两个方面,一是病因积累,诸邪丛生;二是正衰积损,邪炽成毒。换言之,即在反复的外邪侵袭、情志失调及长期的饮食失度、劳倦过度、脏腑功能失常等多种病因的作用下,形成风、火、痰、气滞、血瘀,即产生了一种新的致病因素——毒邪。该毒邪仍具有原病邪的致病特点,但其致病作用比原病邪有过之而无不及,是风、火、痰、瘀等邪的复合形式。毒邪致病力强,直接导致正衰积损,进一步引起机体无力祛邪排毒,毒邪进一步在体内蓄积,形成恶性循环。中风病中常见的毒邪有热毒、痰毒、瘀毒、寒毒等,因此,“瘀毒致风”理论逐渐成为中风病新的病机学说[16]。本课题组前期研究发现,化瘀解毒方可抑制Thrombin的毒性和炎性,减轻脑组织中炎性因子的浸润,明显改善大鼠缺损的神经功能。由此,也从以方测证的角度印证了瘀毒病机假说存在的科学性[17]。
Thrombin是一种被凝血酶原切割而成的丝氨酸蛋白酶,介导纤维蛋白原转化为纤维蛋白,是参与血栓形成的核心因素。事实上,Thrombin在中枢神经系统中的毒性作用已經在各种缺血模型中显示出来。低水平的Thrombin活性具有神经保护作用,高水平的Thrombin活性是有害的,且缺血半球的Thrombin活性和梗死体积之间有显著相关性[18]。Thrombin的活性衍生物为凝血酶原(Prothrombin),Prothrombin和Thrombin一起在中枢神经系统中局部表达。在中风疾病中,高水平的Thrombin直接促进细胞毒性、血管破裂、氧化应激和炎症反应,受损伤大脑半球内的Thrombin活性与脑梗死体积之间也有直接相关性[19]。同时,Thrombin的血管内效应包括诱导血脑屏障破坏、脑水肿、神经炎症和神经元死亡,均是由PAR(PAR-1、PAR-3、PAR-4)及其多种脑细胞类型中的下游信号转导介导[20]。
新近研究发现,Thrombin可以诱导细胞自噬的发生[11-12]。HU等[11]通过耳内注射Thrombin特异性地提高了Beclin-1和LC3这两种自噬标记物在星形胶质细胞中的表达,并促进星形胶质细胞内而非神经元内自噬空泡的形成。之后进行的体内实验表明,在同侧基底节中,耳内注射Thrombin可增加LC3-Ⅰ向LC3-Ⅱ的转化、组织蛋白酶D水平和自噬空泡的形成。WU等[21]的动物实验研究发现,脑出血患者血浆Thrombin-抗凝血酶复合物浓度与脑出血严重程度呈正相关,且血肿周围区域的神经元存在自噬,Thrombin可能参与了这些神经元自噬的激活。郑佳骏等[22]所做的体内和离体实验表明,Thrombin处理24 h后,星形细胞中自噬明显激活;而将Thrombin注射到大鼠脑内3 d后,自噬活性亦达到高峰,证明Thrombin以时间依赖的方式参与脑出血后的病理生理过程,且是脑出血后细胞自噬的重要诱因。亦有研究发现,缺血再灌注诱导星形胶质细胞中的炎症因子分泌、氧化应激和自噬均被Thrombin加重,而SPRED2基因敲除可抑制Thrombin,证明Thrombin通过激活SPRED2介导的自噬作用加重星形胶质细胞的缺血再灌注损伤[23]。
检测自噬有多种方法,LC3贯穿整个自噬过程,是目前公认的自噬标记物。在自噬成熟过程中,LC3-Ⅰ在C端有少量氨基酸被切割后转化为LC3-Ⅱ,LC3和磷脂酰乙醇胺结合形成自噬小体膜的一部分,LC3-PE促进自噬体和溶酶体的相互作用,因此以自噬小体的数量来检测自噬的活性与LC3-Ⅱ数量或LC3-Ⅱ/LC3-Ⅰ的比值直接相关。由此,本实验通过检测LC3Ⅱ/Ⅰ比值的表达来验证自噬的活性。
本实验研究探讨了缺血性中风进展过程中Thrombin、自噬相关蛋白LC3Ⅱ/Ⅰ的动态变化,为缺血性脑损伤的进一步研究提供了基础。研究发现缺血性中风后Thrombin与自噬相关蛋白LC3Ⅱ/Ⅰ的表达呈正相关,且均在缺血12 h、缺血24 h达到高值,由此证明了Thrombin、自噬相关蛋白LC3Ⅱ/Ⅰ、缺血性脑损伤的变化三者均具有时间依赖性,且三者之间具备内在联系。同时为进一步研究治疗脑梗死筛选了最佳药物反应时间点,可指导下一阶段对中成药干预该病证结合模型的研究。其内在机制可能是高水平的Thrombin通过上调相应脑区的自噬水平,进而加重对脑组织的损伤,具体过程不仅有Thrombin本身对血脑屏障的神经毒性,更有自噬过度被激活对重要细胞器甚至是细胞核的吞噬降解,引发神经细胞死亡[6]。因此,该实验认为高水平的Thrombin活性、过度发生的自噬会促进大鼠神经功能缺损,加重脑梗死体积占比。除此之外,明确了自噬变化最明显的两个时间点,可用于指导下一阶段用药干预抑制自噬,从而发挥脑保护作用。当然,本实验仍存在着不足和需要改进之处:第一,未来可从其他诱导自噬的因素角度挖掘与自噬相关性高的影响因素;第二,在缺血2~72 h时相内,Thrombin、LC3Ⅱ/Ⅰ、脑梗死体积占比表现并非完全一致,其原因与内在机制值得进一步探索与思考;第三,未来可从细胞实验入手进一步验证Prothrombin与自噬之间的关系。CBA2E9D1-1A87-476B-BD87-B1A5CC4A17F9
参考文献
[1] RAJAH G B, DING Y. Experimental neuroprotection in ischemic stroke: A concise review[J]. Neurosurgical Focus, 2017, 42(4): E2.
[2] HERPICH F, RINCON F. Management of acute ischemic stroke[J]. Critical Care Medicine, 2020, 48(11): 1654-1663.
[3] YAMASHITA T, ABE K. Recent progress in therapeutic strategies for ischemic stroke[J]. Cell Transplantation, 2016, 25(5): 893-898.
[4] 安 鑫,张连运,苑奇志,等.缺血性中风病的中医理论研究概况[J].光明中医,2016,31(8):1205-1208.
[5] 钟达源,李 兰,马若梦,等.基于网络药理学探讨丹参酮ⅡA治疗缺血性中风的机制研究[J].中医药信息,2021,38(4):1-10.
[6] GALLUZZI L, BRAVO-SAN PEDRO J M, BLOMGREN K, et al. Autophagy in acute brain injury[J]. Nature Reviews, 2016, 17(8): 467-484.
[7] HOU K, XU D, LI F, et al. The progress of neuronal autophagy in cerebral ischemia stroke: Mechanisms, roles and research methods[J]. Journal of the Neurological Sciences, 2019, 400: 72-82.
[8] DENG M, ZHONG X, GAO Z, et al. Dynamic changes in Beclin-1, LC3B and p62 at various time points in mice with temporary middle cerebral artery occlusion and reperfusion (tMCAO)[J]. Brain Research Bulletin, 2021, 173: 124-131.
[9] WANG P, GUAN Y F, DU H, et al. Induction of autophagy contributes to the neuroprotection of nicotinamide phosphoribosyltransferase in cerebral ischemia[J]. Autophagy, 2012, 8(1): 77-87.
[10] SUN Y, ZHU Y, ZHONG X, et al. Crosstalk between autophagy and cerebral ischemia[J]. Frontiers in Neuroscience, 2018, 12: 1022.
[11] HU S, WU G, DING X, et al. Thrombin preferentially induces autophagy in glia cells in the rat central nervous system[J]. Neuroscience Letters, 2016, 630: 53-58.
[12] 胡枢坤,吴 刚,常 川,等.凝血酶导致的星形细胞死亡中自噬激活以及作用研究[J].中国临床神经科学,2014,22(6):608-613.
[13] 蒋成婷,葛金文,聂慧芳,等.缺血性中风瘀毒互结证病证结合动物模型研究[J].中国中医药信息杂志,2020,27(9):69-74.
[14] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[15] 李澎涛,王永炎,黄启福.“毒损脑络”病机假说的形成及其理论与实践意义[J].北京中医药大学学报,2001(1):1-6,16.
[16] 仲爱芹,徐士欣,张军平.从瘀毒论治缺血性中风的理论探析[J].中华中医药学刊,2015,33(3):573-575.
[17] 鄧奕辉,覃弘宇,文 果,等.化瘀解毒法对MCAO大鼠凝血酶及其受体、脑组织MCP-1、NF-κB的表达及中性粒细胞浸润的影响[J].世界中医药,2016,11(4):575-579.
[18] BUSHI D, BEN SHIMON M, SHAVIT STEIN E, et al. Increased thrombin activity following reperfusion after ischemic stroke alters synaptic transmission in the hippocampus[J]. Journal of Neurochemistry, 2015, 135(6): 1140-1148.
[19] PLESERU A M, MIHAILA R G. The role of thrombin in central nervous system activity and stroke[J]. Clujul Medical, 2018, 91(4): 368-371.
[20] YE F, GARTON H J L, HUA Y, et al. The role of thrombin in brain injury after hemorrhagic and ischemic stroke[J]. Translational Stroke Research, 2021, 12(3): 496-511.
[21] WU C, YAN X, LIAO Y, et al. Increased perihematomal neuron autophagy and plasma thrombin-antithrombin levels in patients with intracerebral hemorrhage: An observational study[J]. Medicine, 2019, 98(39): e17130.
[22] 郑佳骏,吴 刚,胡枢坤.脑出血后凝血酶诱导自噬细胞的种类研究[J].中国临床神经科学,2019,27(1):16-21.
[23] WANG X, LU W, LIU B, et al. Thrombin aggravates hypoxia/reoxygenation injury of astrocytes by activating the autophagy pathway mediated by SPRED2[J]. Experimental and Therapeutic Medicine, 2021, 22(4): 1107.CBA2E9D1-1A87-476B-BD87-B1A5CC4A17F9
