大小鼠多种连续微量采血法的比较
2022-07-01黄浙学朱青青余雨滋潘永良周梓欣
黄浙学,朱青青,余雨滋,潘永良*,周梓欣,伍 爽
(1.湖州师范学院医学院,浙江省媒介生物学与病原控制重点实验室,浙江 湖州 313000;2.双林镇中心卫生院,浙江 湖州 313012)
0 引言
利用模式动物建立的动物模型是生命科学等领域的主要研究方法之一,围绕该方法的基础医学和临床医学研究在现代医学领域中发挥着不可替代的重要作用[1-2].由于大小鼠在遗传背景、生理特征及代谢特点等方面与人类相似,且具有生长发育快、繁殖周期短、体型小、易于饲养管理等优势,所以大小鼠是目前临床前实验的理想动物模型.连续微量采血可提供在血液中各项生理生化指标的动态变化趋势,但目前国内利用生物分析技术将其应用在药代动力学及毒代动力学方面的研究仍较少.随着生物分析仪器灵敏度的不断提高,微量采血技术的优势不断凸显.在不影响动物生存与活动的前提下,连续微量采血能够有效减少实验动物的使用量和混杂变量的偏倚,从而提高实验的成功率和准确率.故连续微量采血在采样难度大或样本量少的实验研究中发挥着越来越重要的作用[3-5].然而,相比于一次性大量采血,连续微量采血需反复操作,技术要求高,不可避免地会引起动物生理功能及行为活动的改变.因此,为获取合格的血样标本,应慎重选择安全、微创、可连续多次的采血方式,并注意在采血过程中应严格遵守操作程序,采取积极有效的措施来减少血样污染和缓解动物应激.近年来,大量文献对鼠科各种采血方式进行了比较研究,但鲜见系统地对连续微量采血方法进行归纳总结的文献报道[6-7].因此,本文概括了在鼠类尾部、眼部、舌下、颈部、隐静脉以及下颌等部位的连续采血方法,总结其操作注意事项及优缺点,以便为实验者选择合适的采血方法提供理论依据和实践参考.
1 鼠尾采血
1.1 断尾采血
自小鼠尾部近心端捋向尾尖,用手术剪将其尾尖剪断,让血液流出,所采集血液为动静脉混合血(见图1(a)).有文献表明:小鼠在多次采血时每次剪尾长度不应超过1 mm,平均采血量为每次0.1 mL;大鼠每次剪尾长度一般不超过2 mm,但当所需血量较大时则应适当加长剪尾长度,平均采血量为每次0.3~0.5 mL[6].若取血失败,则可再次向近心端断尾,一般每只大小鼠的采血总次数可达 10 次以上[8],但由于当尾部被切除1/3以上后会引起痛觉过敏[9],因此需严格控制每次剪尾长度以及总采血次数.同时,在采血过程中,由于反复挤压会增加混入组织液的可能性,易导致溶血而降低采血质量,所以操作者的采血动作应尽量轻柔迅速.在采血结束后,由于尾尖伤口不易包扎、断端易反复出血,因此要及时给予消毒止血,避免感染,推荐采用棉球压迫、胶布包扎、电烧灼或6%液体火棉胶等方法止血.此外,术后需注意及时更换垫料、清洗鼠笼,避免笼内长时间残留过多血液而对实验鼠的生理心理状态产生较大影响.
断尾采血能够排除麻醉药物对检测指标的干扰,且操作方便、简单易学,适合初学者使用.该种方法适用于要求动物保持清醒状态且在短时间内多次采血的研究,采集的血液标本可用于涂片、试纸检测血糖和ELISA等实验[10].
1.2 尾静脉采血
捏住鼠尾两侧,使尾静脉充盈显露,针头呈15°夹角刺入尾部下1/3血管处,当阻力突然消失有突破感时可见回血,轻轻按摩鼠尾加快血液流出(见图1(b)).与断尾采血方法相比,尾静脉采血所需时间更长、操作要求更高,在采血时应自远心端向近心端依次选择进针点,以便可以多次采血.在采血过程中为保证血液能够从针孔顺利流出,应避免抽吸过快而致血管瘪陷[11];在采血结束后需用力按压,防止渗血、皮下淤青、血肿的发生.据文献[12]报道,用温水浸泡鼠尾能使其血管扩张,加快采血速度,但该方法步骤烦琐、易造成烫伤等额外的应激;有研究者探索了更加简单快捷、安全有效的方法,他们尝试了用75%酒精棉球用力擦拭鼠尾,并获得了相同的效果.此外,还有文献报道了更优化的快速采血法——尾静脉切割法[13],即在一侧尾静脉做一微小切口,用毛细玻璃管取血(见图1(c)).该方法不要求实验人员掌握精准的尾静脉穿刺技术且能够在短时间内快速采取微量血液,尤其适用于初学者[10].
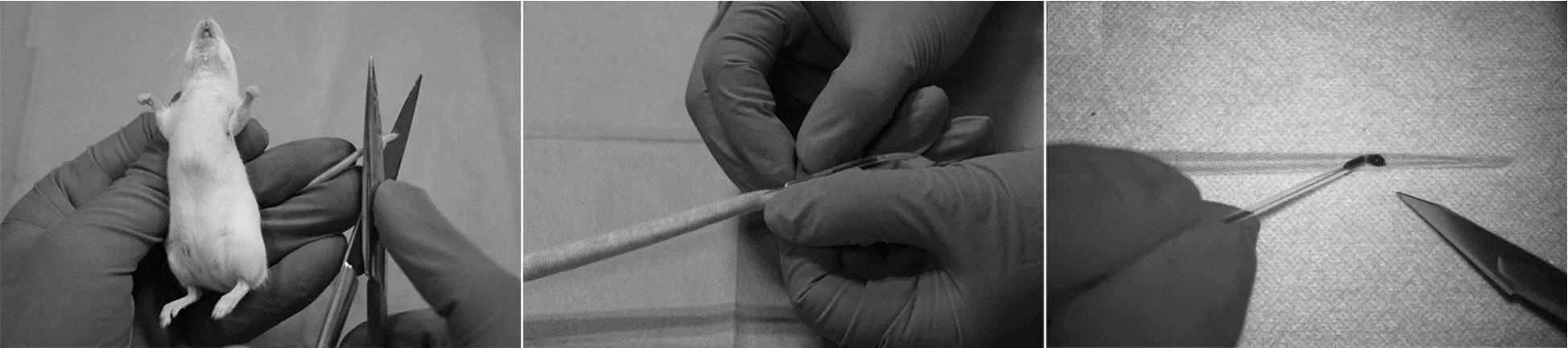
(a)断尾采血 (b)尾静脉采血 (c)尾静脉切割采血图1 鼠尾采血
静脉采血法无须麻醉、创伤小、易止血、采血量足且不易被污染,一般适用于较大体型动物的多次采血(但有些动物体型较大,不易控制,在采样时应激反应强烈,如SD大鼠,故一般采取乙醚吸入麻醉或腹腔注射麻醉[11]等方法).由于小体型动物的血管细,采血难度大,静脉采血法受到较大限制,所以推荐采用断尾采血法.综上所述,尾静脉采血适用于连续多次采血的实验研究,目前被认为是研究药代学、毒代学的最理想的采血方法之一[10-11,14-15].
2 眼眶采血
采用徒手保定法单手固定动物,下压动物头部使其眼球向外突起,同时压迫动物颈部使其眼眶后静脉丛充血,然后用另一只手沿眼眶后壁轻轻捻动毛细玻璃管,血液可被快速采集[16](见图2).血液生化和相关行为学指标结果显示:在无麻醉条件下,眼眶采血法比其他方法能获取更高质量的血样标本,且对动物的一些应激指标(如采血后血液皮质酮变化、笼内自发行为以及旷场运动距离)影响较小[17].但是,眼眶采血法存在一些不足和缺陷:如对眼部组织的损伤较大[17],操作会持续刺激动物产生较强的疼痛感[18],眼眶反复采血或按压止血不当很可能会引发眼睑痉挛、角膜炎症和眼球浑浊等并发症[19].由于上述不良反应发生率较高且部分症状不明显,在实验过程中常常因未能及时被发现而影响最终数据的可靠性,所以眼眶采血方法目前已被较多学者淘汰,尤其在某些地区内已被法律取缔[7].同时,为提高动物福利,英国实验动物“3R”国际中心等建议应在不影响实验检测指标的前提下采用麻醉采血[20-21].有研究者[20]对眼眶采血的入路途径进行了改良,将传统的内眦入路方式改为侧方入路方式,结果显示该方法在采血频次较少时动物眼部损伤的发生率更低.此外,有研究者[20]建议在采血前涂抹眼膏或使用无菌毛细玻璃管以降低感染风险,当反复采血时两眼交替取血可以减少组织损伤.更高效优化的眼眶取血方式仍有待深入研究.

图2 眼眶采血
总体而言,眼眶采血方法因其突出的优点(如方法简单、采血量可控、采血速度快、血样质量高、不易凝固等)而深受部分研究者的喜爱[7],特别是在某些特殊的动物模型中,如凝血功能障碍的Ⅶ基因敲除动物,眼眶采血法因出血量少且不易造成大出血而具有不可替代性[21-22].但是,眼眶采血法也因其难以避免的上述不良反应而受到了部分学者的质疑和批判,故有学者建议眼眶取血采血频率每周不宜超过1次,且不作为多次采血的优先选择方法[21,23].
3 舌下静脉采血
充分暴露实验动物的舌头,让采血针与舌面呈10°夹角缓慢刺入沿边缘纵行的舌下静脉,即可迅速获得血液(见图3(a)).大鼠1次采血量可达2 mL[24].在采血过程中,安琪等[25]建议应注重对舌的保护:在进行舌的固定时需使用无齿止血钳或衬垫棉花以防拉伤,如遇出血不止的情况,可用棉球填塞;当反复多次取血时应双侧交替采血以减少不良反应,同时应时刻关注在麻醉状态下动物的生理状态,保证气道通畅以免窒息.马征等[21,26]研究发现:舌下静脉采血溶血率较高,推测这与操作者采血熟练程度、血液流出速度以及口腔分泌物混杂有关,这提示了熟练掌握规范化操作对减少溶血具有重要作用.因此,有研究者报道了一种优化方法——舌下静脉切割法,即用眼科小剪将一侧舌下静脉剪开1 mm左右的小口,用毛细管收集流出血液(见图3(b)),该方法因更加便捷安全而备受青睐[26].
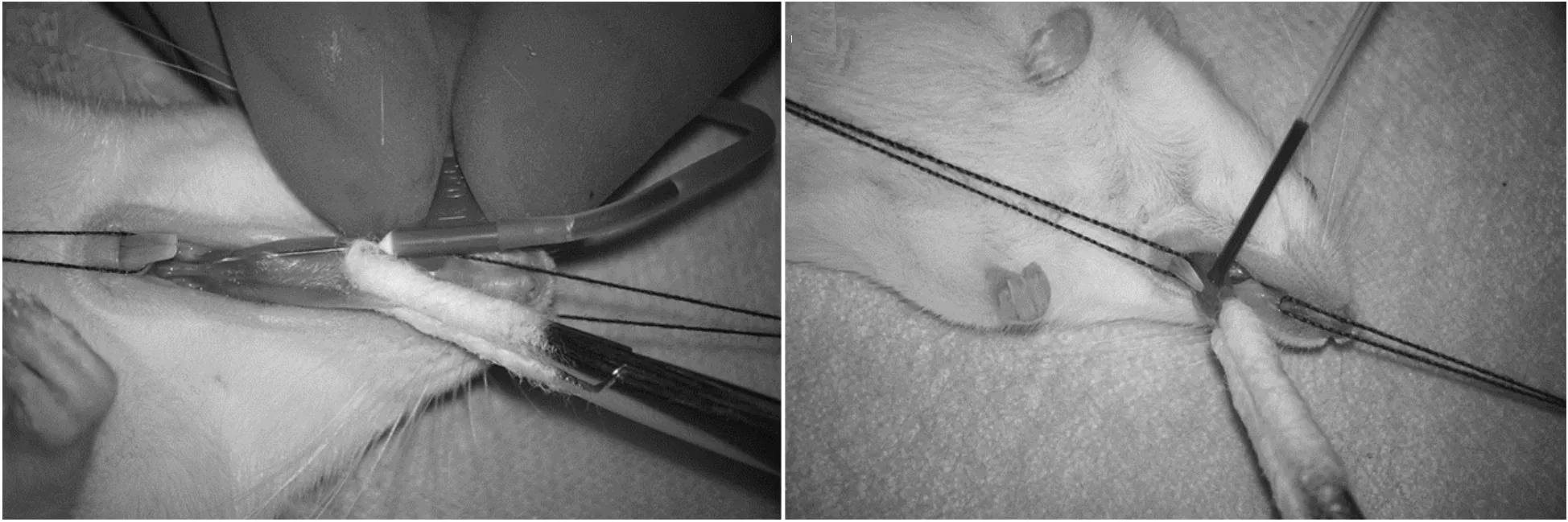
(a)舌下静脉穿刺采血 (b)舌下静脉切割采血图3 舌下静脉采血
舌下静脉采血操作简便、采血量大、血样质量高、危害性小,但需在麻醉状态下进行.实验发现:经舌下静脉采血的动物除舌部稍有水肿外无其他组织损伤,伤口经2~3 d即可恢复,不影响进食进水能力[24-25].因此,舌下静脉采血法适用于多次反复采血,是动态监测血液相关指标的有效方法.
4 颈动静脉采血
用肉眼寻找颈动静脉,在确定具体位置后,沿与胸骨成45°~60°角向头部方向进针采血(见图4).在大鼠的胸锁乳突肌下缘血管搏动处即为颈动脉[27]、在搏动外侧约1 mm处为与之伴行的颈静脉[28].颈动静脉的位置较为隐蔽,初学者不易精确寻找且缺乏娴熟的进针技巧,故可采用特殊体位法来减少穿刺失误:保持动物头和身体平直,将上肢向斜下方伸展固定,使颈部与前肢的角度在90°~150°之间[27].与传统的在全麻醉将态下切开颈部皮肤相比,该方法避免了大块皮肤的暴露,不仅能重复采血,还能提高采集血液的质量并降低组织损伤和感染风险.但因为颈动静脉的定位难度较大,所以颈动静脉采血法更加适用于经验丰富的技术人员.
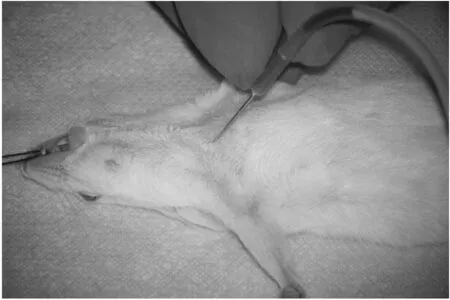
图4 颈静脉采血
颈动静脉采血法要求动物必须处于麻醉状态,为非正常生理状态,这使部分采血指标存在偏差.为消除麻醉的影响,王敏康等[29-32]致力于埋管取血法的研究.该方法通常以大鼠为实验对象,其主要操作流程是在游离、结扎颈部血管后作“V”形切口,经切口插入导管并结扎固定.除颈部外,其他部位插管方法均与之相似[33].该方法在埋管成功后再行采血时无须麻醉或重复进针,可准时、定量、重复采集血样.但埋管采血法也存着在一些缺点,从而限制了其在实验室中的广泛应用[34]:埋管手术难度大,操作不当易引起大血管破裂,即使安装成功后也可能因为动物抓挠而导致埋管装置的损坏、堵塞、脱出等;埋管装置容易发生各种异常状况,需操作者定期检查,及时疏通以保证插管畅通.埋管采血法极大地促进了动物福利的发展,是连续微量采血发展的新方向,值得深入研究与探讨.
5 隐静脉采血
隐静脉采血一般无须麻醉,对动物后腿外侧区备皮消毒,于隐静脉处穿刺取血(见图5),同时注意压迫防止血肿形成.文献[35]报道:在同一实验中应尽量控制采血部位相近,这是因为不同部位静脉所采集的血液可能与周围淋巴液的污染有关,其血液学和血清生化指标存在较大差异.此外,采血持续时间对血样中的应激指标影响较大.因此,熟练操作并缩短采血时间是提高血液标本质量的关键因素之一[36].
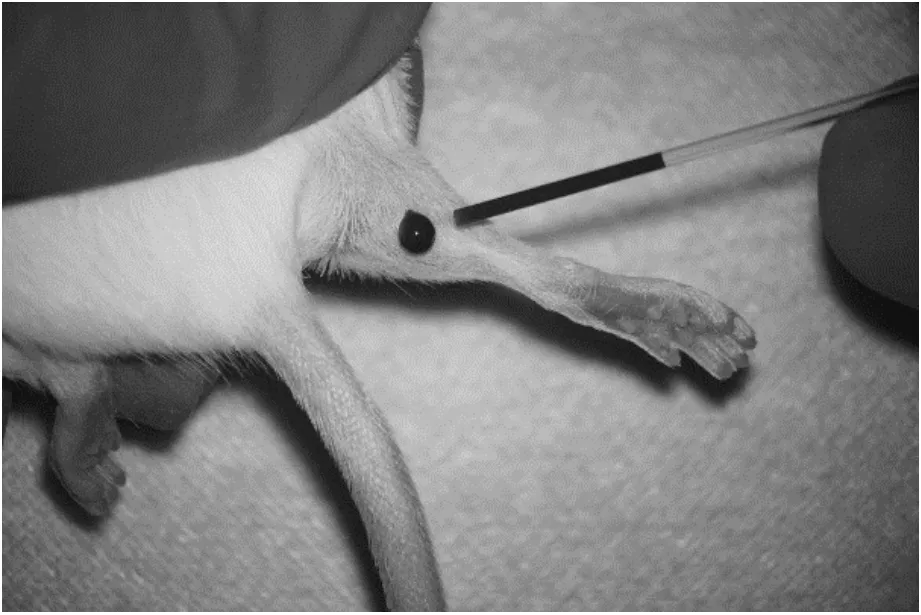
图5 隐静脉采血
隐静脉血管丰富且位置浅表易辨认,操作者容易把握采血点的位置和深度,能有效减少在采血过程中的失误,并极大减轻动物所遭受的痛苦.该方法符合动物福利的“3R”原则,有利于促进动物的长期健康生存,故推荐隐静脉采血法为连续微量采血的首选方式之一[4,17,37].
6 下颌静脉采血
在动物下颌部剃毛消毒,然后将动物倒立数秒,待其面部血管充盈后快速进针采血(见图6).由于下颌部静脉丛丰富、血流量大,因此在操作中尤其应注意及时止血.目前,下颌静脉丛的体表投影点尚未完全统一,研究发现在不同物种甚至同一物种的不同实验中,进针部位都各有偏差.在小鼠中,有研究者认为在嘴角平面与外眼角延长线交点、下颌骨后方咬肌边缘处为进针采血点[38];也有研究者认为在下颌明显少毛或无毛部位为实验采血点[39].此外,操作人员在进入正式实验前应先进行解剖观察,确定合适的采血针型号以及精确的定位坐标,避免大小鼠在未麻醉状态下前肢和头部摆动而导致进针位点偏差,同时注意在采血过程中应根据个体差异调整进针的角度、力度和深度等[34].为了进一步提高采血质量和效率,张东淑等[38]提出选用微量毛细吸管将血液的采取与收集合二为一,该方法能迅速提高血液的采集速度并有效减少血液的污染,尤其适用于自血穴位注射技术的研究.
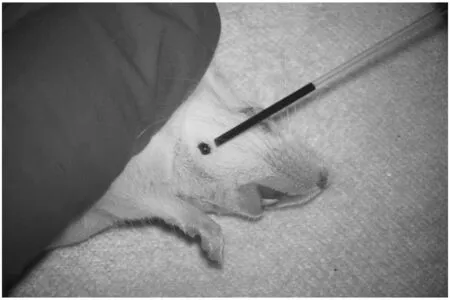
图6 下颌下静脉采血
下颌静脉采血是一种快速、简单、人性化的新型采血方法[40-42],在保证实验血样被顺利采集的基础上能显著降低对动物的伤害程度.该方法具有损伤小、愈合快、死亡率低、可持续性强的优点,符合动物福利及“3R”原则[43].但目前该方法在连续微量采血中的应用报道仍较少,是否能被广泛应用也有待验证和评估[43].
7 讨论
采血是在动物科学研究中最基本也是最重要的技术之一,连续微量采血更是监测血液和血清生化动态变化的良好指标,通过成倍减少实验动物的使用量,可以降低由个体差异所造成的实验误差,从而提高实验数据的有效性和准确性.通过文献总结分析,本文归纳出一些制约微量采血质量的重要因素:每一种采血技术对动物均存在一定的刺激,且刺激程度与采血频率有关,在一定程度上这种刺激甚至会影响测试指标.在1 d内多次进行尾部采血会引起一些不良反应(如血液皮质酮浓度的升高[17,44]),但旷场活动距离不受影响[17];当采血频率减少到每天1次时,血液皮质酮浓度则不会发生上述改变[17].因此,在尾部采血实验中,若需测试血液皮质酮浓度指标,则应在24 h后进行2次采样,而旷场运动距离则无此时间限制.因此,在根据药物或毒物的性质和代谢特点确定采血间隔时间后,还需要综合考虑采血频率对检测指标的潜在影响,从而提高实验数据的真实性和准确性.
麻醉本身对采血操作的影响具有双重性.目前,麻醉仍存在着一定的弊端和不足.如增加操作时间;刺激动物产生某些生理和行为上的非特异反应,包括引起血液动力学变化、血浆肾素等应激指标的升高、血糖含量的波动以及干扰糖皮质激素等物质的代谢等[45-47],但是上述部分由麻醉所造成的数据偏差可以通过设置对照组来校正.同时,在临床和科研工作中,麻醉因具有可减少穿刺失误、减轻组织损伤和提高动物福利等显著优势而被广泛应用于动物实验中.因此,需要在有效判断麻醉对研究指标的具体影响后,再自行选择是否需要麻醉.
每种采血方法各有其优缺点,根据实验需求选择合适的连续采血方法极其重要.理想的采血方法不仅应操作简便,还应减轻应激反应、提高血样质量;然而在实际操作过程中很难找到一种完美的采血方法,每种采血方法都不可避免地会产生一定的副作用,甚至不恰当的反复采血方式还会导致动物的生理、心理状态发生相应的变化[6],尤其是其累积效应会引起血液生化指标的长期改变,直接影响实验数据的有效性和准确性.因此,根据实验需求和采血特点进行针对性的选择显得极为重要.
(i)舌下静脉采血对舌肌等组织损伤较小、愈合快、可反复采血,但是必须在麻醉条件下进行,其他采血方式均可自主选择是否需要麻醉.
(ii)断尾采血难度低,适用于初学者,但需要注意避免剪尾过长和尾部断端的止血问题.尾静脉采血是其改良方法,该方法除操作简便外还具有损伤小、愈合快、不良反应少、血样不易受污染等优势,具有较高的应用价值.因此,尾静脉采血是普通实验室连续微量采血的首选方法之一.
(iii)眼眶采血速度快、采血量大,但在多次采血时需注重眼部护理以减少并发症的发生,该方法适用于大规模实验.
(iv)颈动、静脉采血量大,质量高,但位置较深,要求实验人员熟悉操作技术和颈部解剖结构,避免反复试插而引起大量出血.
(v)隐静脉位置浅表易穿刺进针,应激反应小,血样质量高,适用于各类物种,是仅次于尾静脉采血的优先选择方法之一.
(vi)下颌静脉采血伤口小、采血量大、恢复快,虽然在单次采血中常被使用,但将其应用在反复多次采血实验中的文献报道却较少,这可能与进针点较难把握有关.
(vii)大动静脉埋管为多次无创采血提供了新的方向.该方法适合于体型较大动物的长期采血实验,但由于埋管操作复杂,后期需定期维护,所以对实验者要求较高.
综上所述,建议研究者根据自身的实验性质和特点选择合适的连续微量采血方法,同时注意应尽量保证在一天的同一时间段内采血,避免因动物生物钟节律而引起指标误差,从而提高数据的可靠性.
