下调lncRNA OIP5-AS1可通过miR-217/USP7轴抑制肝癌细胞EMT及侵袭迁移
2022-07-01刘星刘小梯符秋红陈学东
刘星,刘小梯,符秋红,陈学东
(1.深圳市龙华区中心医院,广东 深圳,518110;2.邵阳学院 医学部,湖南 邵阳,422000)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的肝癌病理类型,是全球癌症相关死亡的主要原因,长期预后差及死亡率高是其主要特点[1-2]。虽然HCC的诊断和治疗水平有了较大提高,但由于对其复杂的分子发病机制认识不足,难以避免HCC的频繁复发和远处转移[3-4]。因此,进一步阐明HCC恶性肿瘤细胞侵袭转移的分子生物学机制,有利于制定更有效的治疗策略。
人类基因组研究表明约90%的人类基因组DNA序列能够被转录,在这些转录本中只有约2%的转录本能够编码并翻译成蛋白质,而其余较多不能编码并翻译为蛋白质的转录本则被称为非编码RNA(noncoding RNAs,ncRNAs)[5]。长链非编码RNA(long non-coding RNAs,lncRNAs)和微RNA(microRNAs,miRNAs)是非编码RNA的主要组成部分[6]。IncRNA的特点是长度超过200 bp核苷酸且没有蛋白质编码功能,其在多种恶性肿瘤中调控肿瘤发生和转移[7]。例如,lncRNA TMPO-AS1可调控食管癌细胞的上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程[8]。IncRNA AGAP2-AS1作为miR-4668-3p的竞争内源性RNA(ceRNA),诱导结肠癌细胞的EMT过程[9]。IncRNA ZNFX1-AS1作为miR-144的ceRNA调控EZH2的表达,并促进结肠癌细胞的进展和转移[10]。
IncRNA OIP5-AS1位于人类15号染色体上,多项研究证实它在多种人类疾病中发挥重要作用,其中较多的是恶性肿瘤。有研究报道lncRNA OIP5-AS1通过AKT /NF-κB通路靶向miR-26a-5p,从而促进动脉粥样硬化的进展[11];lncRNA OIP5-AS1可通过miR-448/PON1轴和TLR3/NF-κB信号通路的失活来缓解类风湿性关节炎进展[12]。在肿瘤的研究中证实lncRNA OIP5-AS1通过调节miR-137/ZNF217信号轴调控卵巢癌进展[13];lncRNA OIP5-AS1通过靶向miR-429/FOXD1/ERK通路在胰腺癌细胞中发挥致癌作用[14]。但lncRNA OIP5-AS1/miR-217/USP7分子轴调控肝癌细胞的EMT 及侵袭迁移机制的研究目前尚无文献报道。本研究旨在探讨lncRNA OIP5-AS1通过调控miR-217/USP7分子轴进而影响肝癌细胞的EMT 及侵袭迁移过程的机制,为肝癌的诊治提供新的靶标。
1 资料与方法
1.1 细胞株及主要试剂
正常肝细胞株HL-7702及肝癌细胞株(MHCC97H,Hep3B,HepG2和HCCLM3)购于中国科学院典型培养物保藏委员会细胞库;胎牛血清(fetal bovine serum,FBS)、DMEM培养基购于美国赛默飞公司;青霉素、链霉素和双荧光素酶报告基因检测试剂盒均购于北京索莱宝科技有限公司;转染试剂盒 Lipofectamine®3000、PrimeScriptTM反转录试剂盒和实时荧光定量PCR(qRT-PCR)试剂盒TB GreenTMPremix Ex TaqTMII均购于日本TaKaRa 公司; TRIzol-Reagent购于美国Invitrogen公司;N-cadherin,Vimentin,E-cadherin,USP7和GAPDH一抗购于Proteintech中国公司;辣根过氧化物酶HRP标记二抗均购于北京中杉金桥生物技术有限公司;Transwell实验用侵袭小室购于美国康宁公司;蛋白质印迹及IP蛋白裂解液均购于上海碧云天生物技术有限公司;实验中涉及到的质粒、干扰片段、miRNA的模拟物和抑制剂均委托上海吉玛制药技术有限公司设计并合成。
1.2 方法
1.2.1 sh-lncRNA OIP5-AS1,shOIP5-AS1-1与shOIP5-AS1-2质粒以及miR-217 3′ UTR荧光素酶报告基因表达载体构建
根据lncRNA OIP5-AS1基因组序列和质粒载体多克隆酶切位点设计lncRNA OIP5-AS1上下游引物,同时针对lncRNA OIP5-AS1剪切位点不同设计shOIP5-AS1-1与shOIP5-AS1-2引物序列,设计特异性扩增针对mRNA 3′ UTR区域DNA序列。通过PCR扩增目的基因,提取目的基因和质粒DNA、双酶切、T-A连接、转化感受态细胞等构建sh-lncRNA OIP5-AS1,shOIP5-AS1-1与shOIP5-AS1-2质粒载体和空白对照质粒同时构建荧光素酶基因共表达的miR-217 靶向mRNA 3′ UTR嵌合基因共表达质粒载体。
1.2.2 细胞培养和转染
正常肝细胞HL-7702及肝癌细胞株(MHCC97H,Hep3B,HepG2和HCCLM3)用含有10%FBS,100 U/mL青霉素和100 g/mL链霉素的DMEM培养基置于恒温细胞培养箱(37 ℃、5% CO2)中培养,将处于对数生长期的肝癌细胞以2×105个/孔的密度接种到6 孔板中,按照转染试剂盒 Lipofectamine®3000说明书将相应的质粒、干扰片段及模拟物分别转染至分组的实验细胞中,通过qRT-PCR和蛋白质印迹实验检测转染效果。
1.2.3 qRT-PCR实验检测lncRNA OIP5-AS1和miR-217的表达
用TRIzol法提取细胞中RNA,紫外分光光度计检测提取RNA的浓度及纯度。按照TaKaRa PrimeScriptTM反转录试剂盒说明书的步骤对提取的RNA进行反转录以制备cDNA,按照TB GreenTMPremix Ex TaqTMII试剂盒说明书的步骤检测lncRNA OIP5-AS1和miR-217的表达情况,实验以GAPDH和U6为内参对照。每个实验样品均设置3个复孔,每组独立实验均至少重复3 次。相应基因的qRT-PCR引物序列见表1。

表1 正向和反向引物的序列Table 1 Sequence of forward and reverse primers
1.2.4 蛋白质印迹法检测N-cadherin,Vimentin,E-cadherin和USP7表达
采用蛋白质印迹法及IP裂解液提取细胞中的总蛋白质,通过BCA法检测并定量蛋白质浓度,分别取等量蛋白质经充分煮沸变性后采用10% SDS-PAGE电泳(80 V,120 min)分离蛋白质;电转膜法将电泳分离的蛋白质转移至PVDF膜上,5%脱脂奶粉室温条件下封闭1 h;加入目的条带相应的一抗(体积稀释比例均为1∶1 000),4 ℃孵育反应过夜;TBST洗膜3次,10 min/次,加入相应属性HRP标记二抗(体积稀释比例均为1∶2 000)室温条件下孵育1 h;TBST洗膜3次,10 min/次;最后利用化学发光凝胶成像分析仪观察N-cadherin,Vimentin,E-cadherin和USP7的蛋白表达情况。
1.2.5 Transwell实验检测肝癌细胞迁移和侵袭能力
取对数期生长的肝癌细胞,胰酶消化后用无血清培养基重悬至适当细胞浓度,在进行迁移实验时,Transwell上室中加入200 μL无血清细胞悬液,Transwell下室中加入600 μL含有20%血清的培养基,置于恒温细胞培养箱(37 ℃、5% CO2)中培养24 h,弃除所有的培养基后甲醛固定30 min,用棉签擦除上室中未发生迁移的细胞,0.1%结晶紫染色,清洗并干燥后在显微镜下拍照并计数。在进行侵袭实验时,需提前在Transwell上室底部预铺Matrigel基质胶,其余操作与迁移实验一致。
1.2.6 双荧光素酶报告基因实验验证lncRNA OIP5-AS1、miR-217和USP7的靶向关系
取对数期生长的肝癌细胞按照细胞传代的方法接种至24 孔板中,构建lncRNA OIP5-AS1和USP7pmirGLO荧光素酶报告基因表达载体,获得lncRNA OIP5-AS1,USP7野生型载体(pmirGLO-lncRNA OIP5-AS1-WT/pmirGLO-USP7-WT)以及lncRNA OIP5-AS1,USP7突变载体(pmirGLO-lncRNA OIP5-AS1-MUT/pmirGLO-USP7-MUT),根据实验分组将相应的质粒和模拟物按照细胞转染的方法转染至接种好的细胞中,恒温细胞培养箱(37 ℃、5% CO2)中培养48 h,按照双荧光素酶报告基因实验检测试剂盒的操作说明,用酶标仪检测荧光素酶活性。
1.2.7 统计学分析

2 结果
2.1 IncRNA OIP5-AS1在肝癌细胞系中高表达
qRT-PCR结果显示:与正常肝细胞HL-7702比较,lncRNA OIP5-AS1在肝癌细胞系中均呈明显高表达(P<0.05或P<0.01,图1),且在MHCC97H细胞中表达水平最高,因此,选取MHCC97H细胞进行后续实验。

*P<0.05;**P<0.01。图1 IncRNA OIP5-AS1在肝癌细胞系中高表达Fig.1 IncRNA OIP5-AS1 is highly expressed in HCC cell lines
2.2 IncRNA OIP5-AS1的表达影响肝癌细胞EMT 及侵袭迁移能力
qRT-PCR实验结果显示:在肝癌MHCC97H细胞中转染sh-lncRNA OIP5-AS1后,lncRNA OIP5-AS1的表达明显下调(P<0.05,图2a)。结果显示:与NC组比较,shOIP5-AS1-1组和shOIP5-AS1-2组肝癌细胞EMT相关蛋白N-cadherin和Vimentin表达均明显下调,同时E-cadherin 表达明显上调(P<0.05或P<0.01,图2b和2c)。Transwell实验结果表明:与NC组比较,shOIP5-AS1-1组和shOIP5-AS1-2组肝癌细胞的侵袭迁移能力也明显下降(P<0.05,图2d和2e)。
2.3 LncRNA OIP5-AS1靶向下调miR-217对USP7的抑制作用
通过Starbase数据库检索预测与lncRNA OIP5-AS1可能存在相互作用的miRNA,发现lncRNA OIP5-AS1与miR-217存在匹配的结合位点(图3a)。双荧光素酶报告基因实验结果显示:miR-217 mimics 显著抑制了野生型(WT) lncRNA OIP5-AS1的3′ UTR荧光素酶活性,而对突变型(MUT) lncRNA OIP5-AS1的3′ UTR荧光素酶活性无影响(P<0.05,图3b)。qRT-PCR实验检测结果显示:敲降lncRNA OIP5-AS1可显著上调miR-217的表达水平(P<0.05,图3c)。

(a)qRT-PCR分析MHCC97H细胞的转染效率;(b)和(c)Westernblot分析E-cadherin、N-cadherin和Vimentin的表达;(d)和(e)Transwell法检测MHCC97H细胞的迁移和侵袭。*P<0.05,**P<0.05。图2 敲降lncRNA OIP5-AS1抑制MHCC97H细胞EMT及侵袭迁移Fig.2 Knockdown of lncRNA OIP5-AS1 inhibits the EMT, invasion, and migration of MHCC97H cells

(a)和(d)使用Starbase数据库分别预测lncRNA OIP5-AS1和miR-217,miR-217和USP7的结合位点,同时显示了lncRNA OIP5-AS1和USP7的野生型(WT)和突变型(MUT)3′UTR;(b)和(e)采用双荧光素酶报告基因法测定MHCC97H细胞的荧光素酶活性;(c)qRT-PCR分析miR-217在MHCC97H细胞中的表达;(f)Western blot分析MHCC97H细胞中USP7的蛋白表达。*P<0.05。图3 IncRNA OIP5-AS1靶向下调miR-217对USP7的抑制作用Fig.3 IncRNA OIP5-AS1 targeted down-regulates the inhibitory effect of miR-217 on USP7
2.4 MiR-217通过下调USP7抑制肝癌细胞的EMT以及侵袭转移
qRT-PCR结果显示:在肝癌MHCC97H细胞中转染miR-217 mimics后miR-217表达显著上调(P<0.05,图4a)。蛋白质印迹结果显示:在肝癌MHCC97H细胞中转染miR-217 mimics后,EMT相关蛋白N-cadherin 和Vimentin表达均明显上调,同时E-cadherin蛋白表达显著下调,但共转pcDNA3.1-USP7后USP7和EMT相关蛋白表达水平与对照组比较差异无统计学意义(P<0.05,图4b、4c)。Transwell实验结果显示:过表达miR-217可显著抑制肝癌MHCC97H细胞的迁移和侵袭能力(P>0.05,图4d、4e),但共转pcDNA3.1-USP7 能够减弱miR-217的抑制作用。
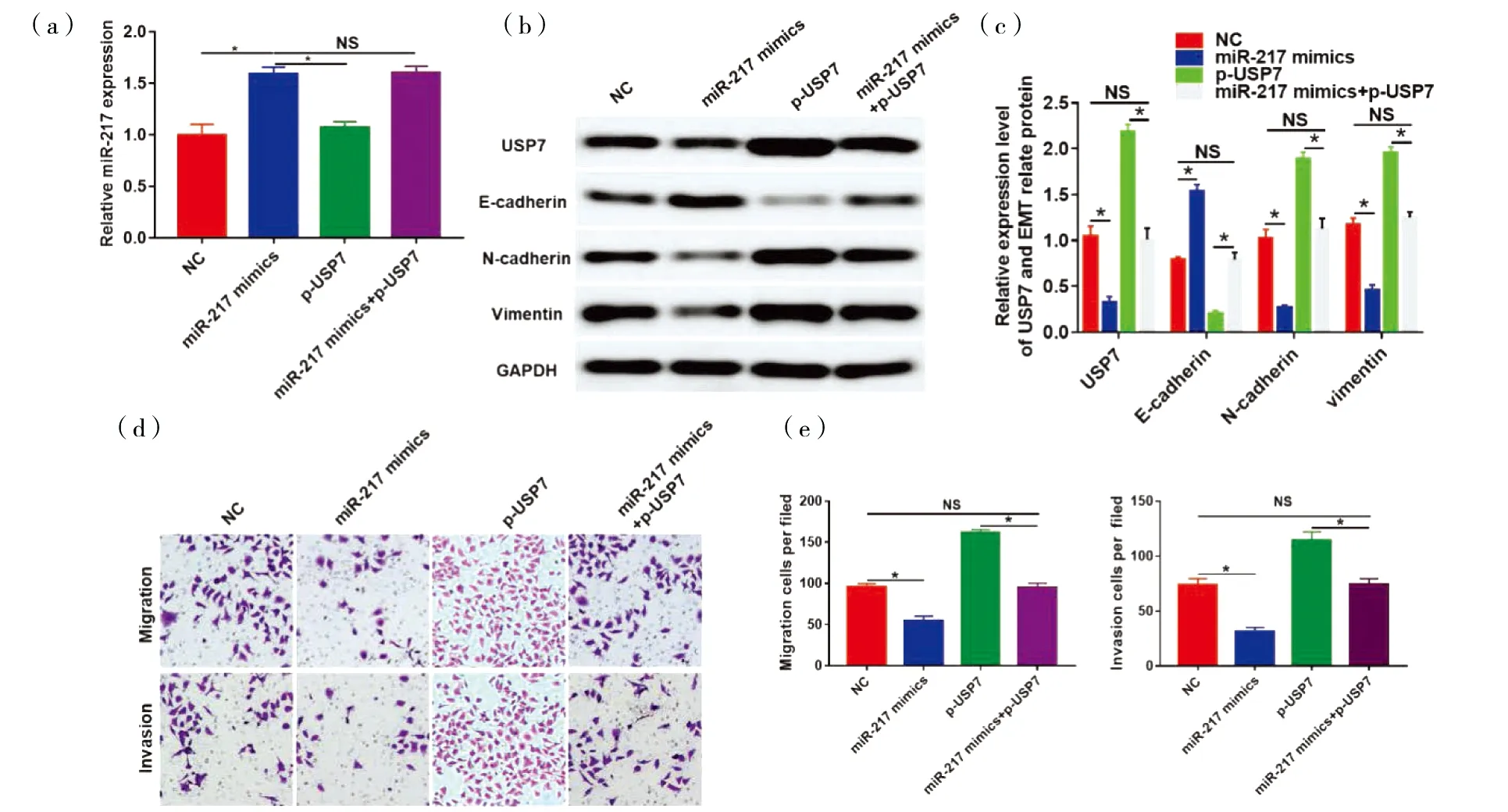
(a)qRT-PCR分析miR-217在MHCC97H细胞中的表达;(b)和(c)Western blot分析MHCC97H细胞中USP7和EMT相关蛋白的蛋白表达。(d)和(e)Transwell法检测MHCC97H细胞的迁移和侵袭。*P<0.05。图4 lncRNA OIP5-AS1/miR-217/USP7分子轴调控MHCC97H 细胞EMT及侵袭迁移Fig.4 lncRNA OIP5-AS1/miR-217/USP7 axis regulated EMT, invasion and migration of MHCC97H cells
3 讨论
肝癌是世界上最常见的癌症之一,肝细胞癌占肝癌病例的绝大多数[2]。由于肝癌起病隐匿,进展迅速,80%的患者丧失了手术机会。虽然姑息性手术切除、射频消融术、经动脉化疗栓塞(TACE)、全身化疗、中药治疗可减轻患者症状,延缓肝癌进展,但这些治疗措施并不能明显提高晚期肝癌患者的生存期,还给患者带来严重的精神压力和经济负担[15-18]。而肝癌治疗疗效达不到理想效果的关键原因之一在于肝癌细胞发生EMT及侵袭转移[19]。因此,研究肝癌细胞EMT及侵袭转移的确切分子机制对于提高肝癌治疗疗效是至关重要的。
研究发现lncRNAs在不同肿瘤组织中的表达存在显著差异[13-14],关于这些差异表达的lncRNAs与肿瘤发生发展机制之间的关系的研究也在逐步开展和深化。研究表明:lncRNA OIP5-AS1在肺癌、乳腺癌、多发性骨髓瘤等肿瘤中高表达,且可以促进肿瘤的发生发展[20-22]。本研究对lncRNA OIP5-AS1在肝癌细胞中的表达及其在EMT和侵袭转移过程中发挥作用的机制进行了全面的探索。研究中明确了肝癌细胞中lncRNA OIP5-AS1的表达均明显上调,下调lncRNA OIP5-AS1的表达可抑制肝癌细胞的EMT 及侵袭迁移能力。这表明:lncRNA OIP5-AS1可能参与了肝癌的发生发展,且有望成为肝癌治疗新的靶点和诊断标志物。目前有研究提出lncRNAs作为miRNAs的ceRNAs,在肿瘤的发生发展中发挥关键作用[23]。如研究报道lncRNA XIST通过充当miR-429的分子海绵调节ZEB1表达促进胰腺癌发生发展[24];lncRNA-CTS竞争性结合miR-505上调ZEB2的表达,促进宫颈癌细胞的侵袭转移和EMT[25];PTTG3P通过海绵吸附miR-383增加致癌基因CCND1和PARP2的表达[26]。本研究发现lncRNA OIP5-AS1与miR-217具有直接靶向关系,敲降lncRNA OIP5-AS1显著上调miR-217在肝癌MHCC97H细胞中的表达水平;过表达miR-217显著抑制肝癌MHCC97H细胞的EMT及侵袭迁移过程。这表明lncRNA OIP5-AS1通过竞争性结合miR-217并调控其表达,促进肝癌细胞的EMT及侵袭迁移过程。
利用生物信息学方法进一步预测miR-217的潜在下游靶基因。分析表明USP7可能是miR-217的下游靶基因。USP7是一种进化保守的蛋白质,最初被认为是单纯疱疹病毒蛋白的分子伴侣,与生长、发育和应激相关的几种细胞功能密切相关[27],如USP7通过去除Axin多聚泛素化修饰从而稳定其表达,并抑制Wnt/β-catenin信号通路进而调节Wnt依赖性成骨细胞分化和脂肪细胞分化[28]。USP7通过稳定Foxp3促进调节性T(Treg)细胞的发育和功能,而敲除Treg细胞中的USP7则在小鼠中引起致命的全身性自身免疫[29]。USP7在肿瘤发生中的作用同样也很重要,文献[30]报道USP7在肝癌组织中高表达并与较差的生存预后相关,且可通过去泛素化作用来稳定TRIP12,从而使p14(ARF)失活并促进肝癌进程。过表达miR-217可显著下调USP7的表达,同时过表达USP7可逆转miR-217的抑制作用。结果表明:lncRNA OIP5-AS1可通过负性调控miR-217,上调USP7的表达,进而促进肝癌细胞的EMT和侵袭迁移能力。
综上所述,lncRNA OIP5-AS1可通过靶向下调miR-217对USP7的抑制作用,进而影响肝癌细胞的EMT和侵袭迁移过程。因此,本研究加深了对肝癌细胞EMT及侵袭转移的确切分子机制的认识,为肝癌的诊断和治疗提供了重要理论依据。
