霍山石斛对Lewis肺癌和原发性肺癌的抑制作用及机制研究
2022-07-01曹培常郑士宏任荟蓉翁海燕韩际宏余茂耘
曹培常, 郑士宏, 任荟蓉, 翁海燕, 韩际宏, 余茂耘
(1.合肥工业大学 食品与生物工程学院,安徽 合肥 230601; 2.重大疾病代谢及营养调控安徽普通高校重点实验室,安徽 合肥 230601; 3.中国科学技术大学附属第一医院(安徽省立医院),安徽 合肥 230001; 4.皖西学院 生物与制药工程学院,安徽 六安 237012)
肺癌是发病率和死亡率增长最快,对人群健康和生命威胁最大的恶性肿瘤之一,约占全世界癌症死亡人数的28%。从临床角度出发,结合生物学特点,可以将肺癌划分为非小细胞肺癌(non-small cell lung carcinoma,NSCLC)和小细胞肺癌(small cell lung carcinoma,SCLC)。其中非小细胞肺癌占所有肺癌病例的85%~90%,并且非小细胞肺癌患者在发现时一般均处于晚期,治愈几率大幅度降低[1-2]。尽管在过去的十多年中,肺癌的早期检测和化学治疗取得了重大进展,但Ⅳ期非小细胞肺癌患者的五年生存率[3]不到1% 。
核因子κB(nuclear factor kappa-B,NF-κB)广泛参与炎症反应和免疫应答,其异常表达会导致机体免疫疾病和癌症的发生。细胞因子和病原体通过刺激细胞表面受体,如Toll样受体4(Toll-like 4,TLR4),激活NF-κB信号通路,进而促进肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和白介素-1β(interleukin-1β,IL-1β)等炎症因子的释放,引起炎症级联反应[4]。NF-κB是炎症过程的主要介质,也是肿瘤发展的驱动因素[5]。此外,NF-κB的过表达会促进肺腺癌产生耐药性[6]。
肺癌的治疗策略主要为手术、放疗和化疗,而化疗被认为是所有肺癌的主要治疗方法。但随着化疗的进行,癌细胞会产生耐药性,主要的机制是继发性表皮生长因子受体(epidermal growth factor receptor,EGFR)T790M突变,蛋氨酸(methionine)扩增和上皮间充质转化(epithelial-mesenchymal transition,EMT)[7-8],因此新型抗癌药物越来越受到关注。近年来,天然产物成为抗癌候选药物,与传统抗癌药物相比,中药可作用于多个靶标而杀死癌细胞且副作用很小[9-10]。
霍山石斛(Dendrobiumhuoshanense)俗称米斛,是一种特殊的兰科属物种[11]。该药草始记于《神农本草经》,在历代本草文献中都有记载[12],并被收录至2020版《中国药典》。霍山石斛具有多种有效成分,包括多糖、生物碱、酚、氨基酸、类黄酮等[13],因此其药理活性受到广泛研究。在现代研究中发现,石斛在抗炎、提高免疫力、抗肿瘤等方面都具有优良表现。目前,关于霍山石斛抗肿瘤的报道较少,且动物模型大多为皮下移植瘤模型。因此,本实验建立Lewis肺癌(Lewis lung carcinoma,LLC1)和原发性肺癌2种小鼠肺癌模型,并着重探究霍山石斛对尿烷诱导的原发性肺癌的治疗效果和作用机制。此外,本实验使用厄洛替尼作为阳性对照药物,以判定石斛的抗肿瘤效果,并将厄洛替尼与霍山石斛联合处理,旨在探究霍山石斛与厄洛替尼是否具有协同作用。
1 实验材料
1.1 主要药品与试剂
霍山石斛(安徽同济生生物科技有限公司);厄洛替尼(MCE),货号:HY-50896;尿烷(Sigma),货号:U2500-100G;苏木素染液(索莱宝),货号:H8070-10g;伊红染液(Biosharp),货号:BL703B;DMEM培养基(Corning Subsidiary),货号:27017008;NF-κB单克隆抗体(Abclonal),货号:A16271;TLR4单克隆抗体(Proteintech),货号:19811-1-AP;β-actin单克隆抗体(Abclonal),货号:AC026;逆转录试剂盒(南京维诺赞生物科技有限公司),货号:R123-01;TNF-α ELISA试剂盒(北京义翘神州生物技术有限公司),货号:SEK50349。
1.2 动物和细胞
6~8周龄SPF级C57BL/6J雄性小鼠20只、6~8周龄BALB/c雄性小鼠40只,均购于江苏集萃药康生物科技有限公司,生产许可证号:SCXX(苏)2019-0008;LLC1细胞购于ATCC。
2 实验方法
2.1 动物实验分组及给药情况
6~8周龄C57BL/6J小鼠,共20只,随机分为对照组、石斛组、厄洛替尼组、药物联用组,每组5只;6~8周龄BALB/c小鼠,共40只,分组方式同上,每组10只。
厄洛替尼每天给药量为50 mg/kg。根据《中国药典》(2015版)鲜石斛每天给药量为5 g/kg。
2.2 动物模型建立
2.2.1 Lewis肺癌模型
LLC1细胞体外培养至足够数目后,用胰酶消化为悬浮细胞,并用预冷 PBS 清洗2遍。剃除小鼠右肋附近毛发,在肋皮下注射100 μL(1×106个LLC1细胞)细胞悬液。待小鼠皮下成瘤后,每2天测量1次肿瘤最长和最短的直径。21 d后实验结束。小鼠安乐死后,取出相应组织。肿瘤体积的计算公式为V=ab2/2,其中:a为肿瘤长度;b为肿瘤宽度。
2.2.2 原发性肺癌模型
将4组BALB/c小鼠喂食普通食物或含药物的食物。1周后,所有小鼠腹腔注射尿烷(1 g/kg),每5 天注射1次,共注射8次。从第1次注射开始,共计60 d,在此期间记录小鼠体质量和生存情况。至第60 天,将存活小鼠进行安乐死,取出相应组织。
2.3 H&E染色
肿瘤组织脱水、包埋后切取5 μm石蜡切片,使用二甲苯进行脱蜡处理(2×10 min),并分别在100%、95%、90%、80%、70%的乙醇中水化处理5 min。苏木素染液染色1 min后,用蒸馏水漂洗5 min。然后在伊红染液中染色2 min,再用蒸馏水漂洗5 min。随后依次在70%、80%、90%、95%、100%的乙醇中浸泡5 min,最后在二甲苯中浸泡(2×10 min)后,封片,晾干。用显微镜获取染色图像,然后使用Image J软件统计癌变面积。
2.4 免疫组化
首先将5 μm石蜡切片进行脱蜡与水化处理,然后使用0.1% Trion X-100孵育5 min进行破膜处理,PBS洗涤3次。使用3%的H2O2室温孵育10 min,PBS洗涤3次。将切片放入柠檬酸钠溶液(0.01 mol/L,pH值为 6.0)中于95 ℃加热20 min进行抗原修复。冷却至室温后将切片用山羊血清封闭15 min,然后用相应一抗在4 ℃孵育过夜。洗涤去除一抗后,使用生物素标记的山羊抗兔/鼠IgG室温孵育10 min,PBS洗涤3次,然后滴加辣根酶标记链霉卵白素工作液于室温孵育10 min。二氨基联苯胺(DAB)显色完成后,再用苏木素复染切片,脱水封片,充分干燥后用显微镜获取图像,然后使用Image J软件统计阳性区域面积。
2.5 支气管肺泡灌洗液的获取和处理
剖开小鼠胸腔,露出肺部,剪开颈部皮层,露出气管。将留置针插入气管中,并用缝合线系紧,以固定留置针。随后通过留置针向肺部注入1 mL无菌PBS,再抽出至EP管中,反复3次。随后用缝合线系住肺部一角,注入1 mL 4%多聚甲醛。被缝合线系住的部分肺组织用于提取蛋白质和RNA,剩余部分置于多聚甲醛中固定。
支气管肺泡灌洗液的后续处理:将灌洗液在4 ℃下1 000 r/min离心10 min,然后用200 μL无菌PBS重悬细胞沉淀,其中3×50 μL用于涂片,剩余的进行细胞计数。涂片晾干之后,用4%多聚甲醛固定10 min,再用蒸馏水冲洗。最后使用H&E染色,晾干后用显微镜获取图像。
2.6 组织总RNA提取和实时荧光定量PCR
将30 mg组织用500 μL RNA提取试剂研磨后,加入100 μL三氯甲烷,4 ℃ 12 000 r/min离心10 min,取上清液至新管。加入等体积异丙醇,吹匀后放在-20 ℃过夜沉降。次日离心后,除去上清液。依次用500 μL 75%、100%乙醇清洗RNA沉淀。待乙醇完全挥发后加入60 ℃无菌水溶解RNA并测量质量浓度。随后取1 μg RNA经过逆转录实验得到cDNA,用于实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)。所用引物见表1所列。

表1 引物序列
2.7 Western Blot检测
将30 mg组织同裂解液研磨后,4 ℃ 离心机12 000 r/min离心10 min,取上清液至新管。然后用BCA法测定总蛋白质量浓度。定量60 μg的总蛋白于100 ℃加热变性5 min后,在SDS-聚丙烯酰胺凝胶中进行电泳、转膜。根据相应蛋白分子量剪下目的条带,用5%脱脂牛奶室温封闭1 h,再与相应一抗(NF-κB、TLR4、β-actin)于4 ℃过夜孵育。PBST洗涤3次后用二抗孵育60 min,再用PBST洗涤3次。然后通过ECL化学发光检测试剂盒在成像设备中进行检测。
2.8 数据统计与分析
实验数据以(平均值±标准差)表示,使用GraphPad Prism 7 软件进行数据统计分析。采用t检验方法分析各组间显著性差异。*P<0.05,**P<0.01,***P<0.001。
3 实验结果
3.1 霍山石斛对小鼠LLC1的抑制作用
为了探究霍山石斛是否能抑制NSCLC肿瘤以及霍山石斛与厄洛替尼是否具有协同作用,本实验将小鼠随机分成4组,皮下注射LLC1细胞构建荷瘤小鼠模型。霍山石斛抑制小鼠肿瘤的发生和发展结果如图1所示。

图1 霍山石斛抑制小鼠肿瘤的发生和发展情况
从图1a可以看出,在注射后第4 天,对照组小鼠已全部长出肿瘤,而霍山石斛和厄洛替尼组均能明显推迟肿瘤的成瘤时间。由图1b可知,石斛组和厄洛替尼组小鼠肿瘤体积显著低于对照组,然而药物联用组并没体现出叠加效应,表明在该模型下,霍山石斛能有效抑制肿瘤的发生发展,且效果与厄洛替尼类似,但是两者并无协同作用。
3.2 霍山石斛对小鼠生存率和癌变的影响
尿烷是一种强效致肺癌物质,存在于烟叶和烟草烟雾中[14]。该药物处理的小鼠能在2个月内形成肿瘤结节,形成的肿瘤是上皮恶性肿瘤,与人类腺癌具有一致性[15]。因为尿烷诱导肺部发生癌变的过程与人类肺癌的发病过程相近,所以尿烷被广泛用于原发性肺癌模型的构建[16]。尿烷能诱发肺部炎症并导致小鼠死亡,因此本实验探究霍山石斛能否抑制原发性肺癌的发生并改善小鼠生存状况,结果如图2所示。

图2 霍山石斛提高BALB/c小鼠生存率
从图2可以看出,对照组死亡6只小鼠,其余组皆死亡2只小鼠,表明药物处理组小鼠生存活率高于对照组,然而根据Gehan-Breslow-Wilcoxon检验可知,只有石斛组具有统计学显著差异。表明霍山石斛对尿烷处理小鼠具有保护作用,能够改善小鼠生存状况。
小鼠肺部组织H&E染色结果如图3所示,其癌变面积如图4所示。
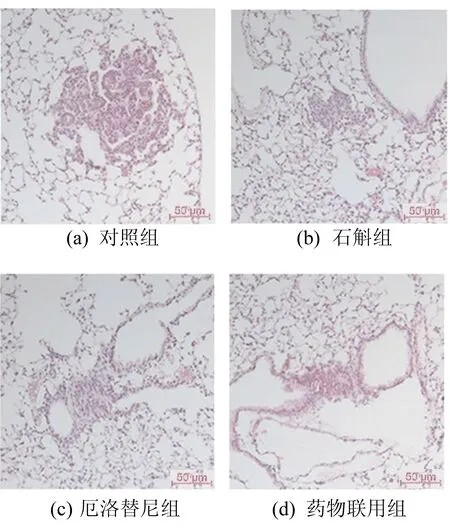
图3 小鼠肺部组织H&E染色染色结果

图4 霍山石斛抑制尿烷诱导肺部癌变面积占比
由图4可以看出,3个药物处理组小鼠的肺部腺癌面积均明显减少,表明霍山石斛能有效抑制尿烷诱导的肺部癌变。
3.3 霍山石斛对癌变组织增殖的抑制作用
Ki-67作为癌细胞增殖标志物,它的高表达预示着癌变组织细胞的过度增殖。对小鼠肺部组织进行免疫组化检测,结果如图5所示,霍山石斛抑制小鼠肺部Ki-67表达和mRNA水平如图6所示。
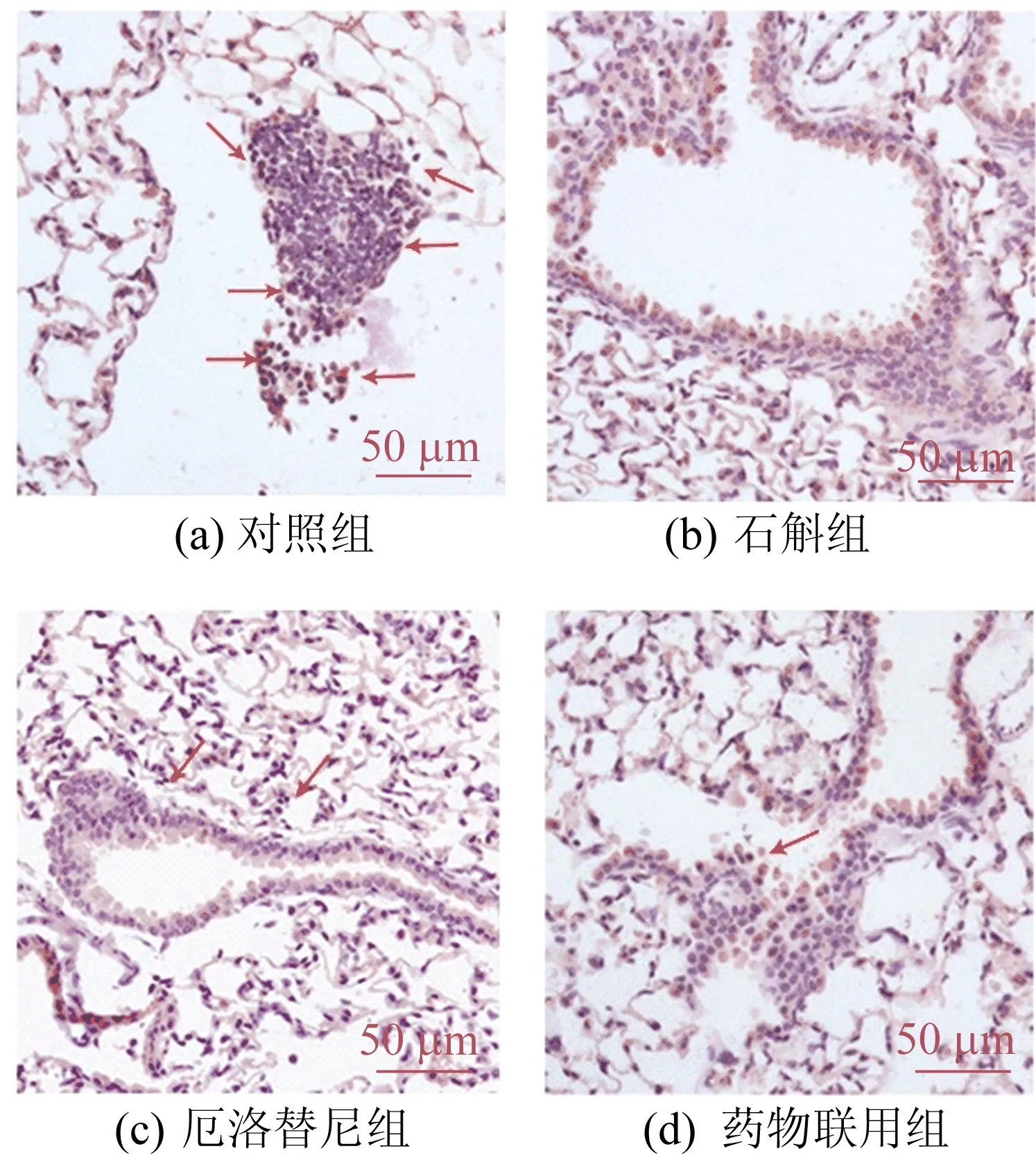
图5 免疫组化分析结果
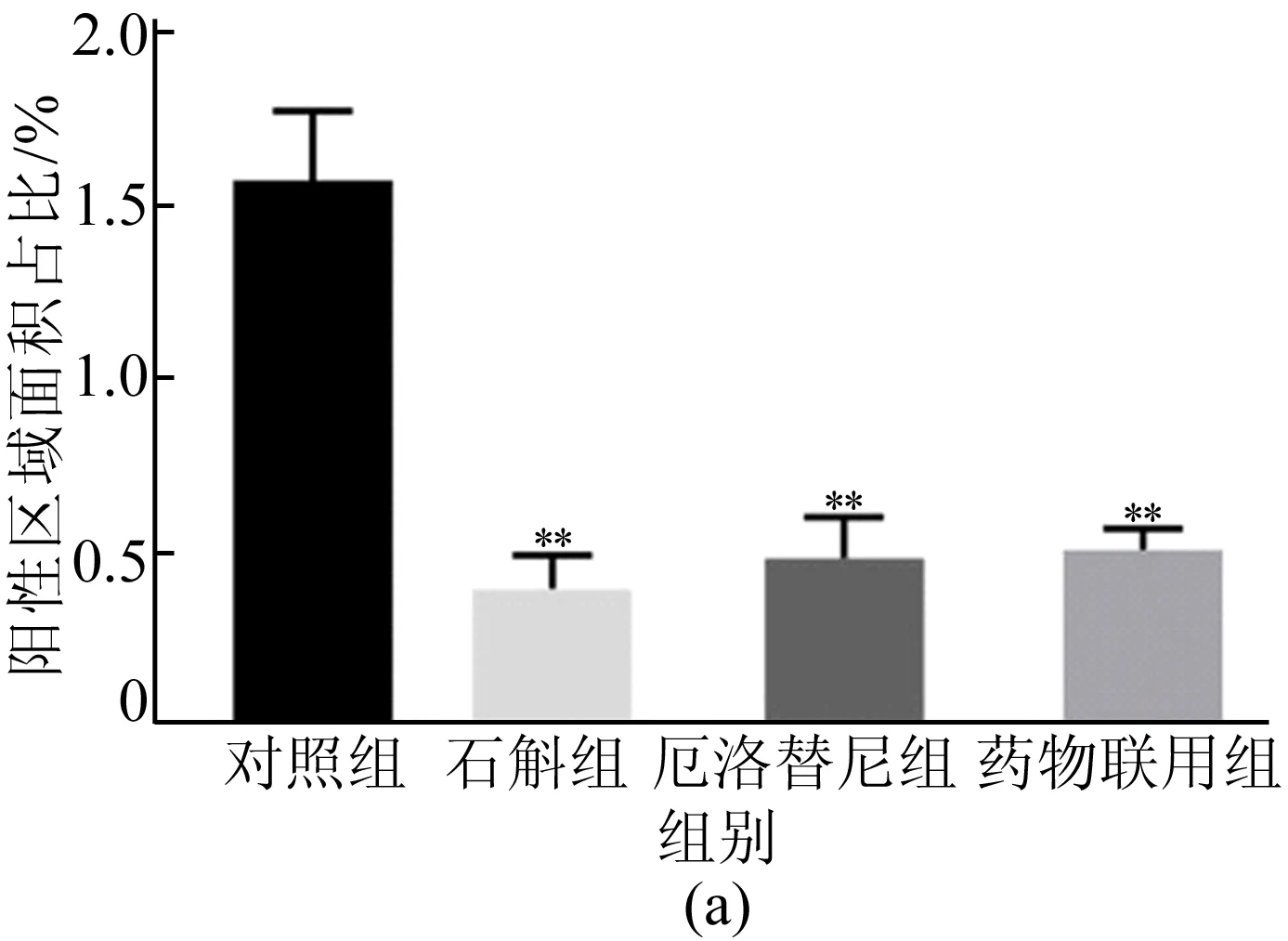
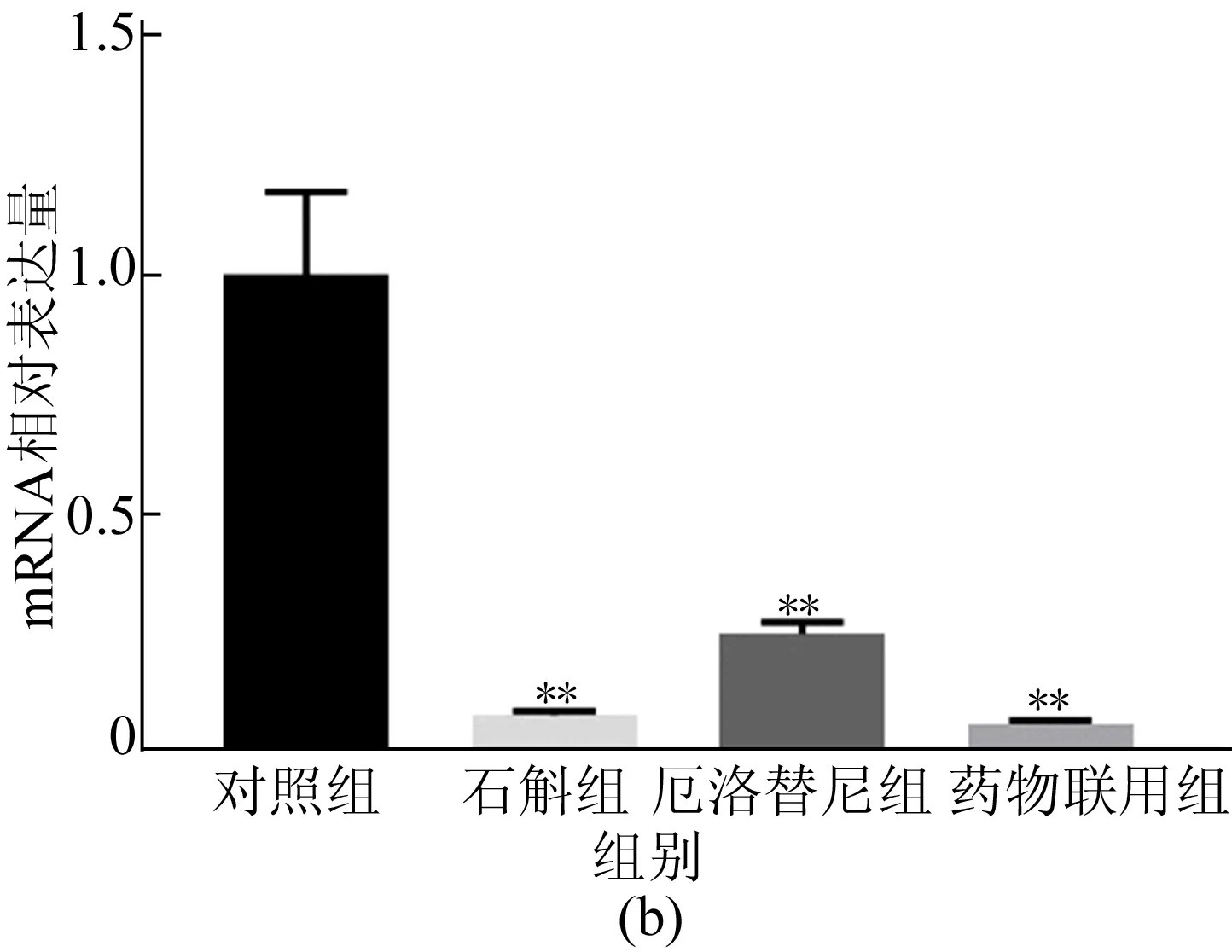
图6 霍山石斛抑制癌变组织Ki-67表达及mRNA水平
从图6可以看出,霍山石斛明显抑制Ki-67蛋白表达,霍山石斛显著降低肺部组织Ki-67的mRNA水平。结果表明,霍山石斛能显著抑制尿烷诱发的原发性肺癌和肺部细胞异常增殖。在该模型下,霍山石斛比厄洛替尼具有更佳的抑增殖效果,但是药物联用后没有明显的叠加效果。
3.4 霍山石斛对小鼠肺部炎症细胞募集的阻止
肺部持续暴露于炎性环境,会导致正常组织细胞转化为癌细胞。肺部炎症多由中性粒细胞(NEU)、淋巴细胞(LYM)和巨噬细胞(MQ)引发,而中性粒细胞也能够促进癌细胞转移[17]。因此,为了明确霍山石斛抑制尿烷诱导的原发性肺癌的机制,本实验提取小鼠支气管肺泡灌洗液,用血细胞计数板计算总炎症细胞数。随后将细胞涂片进行H&E染色,再根据细胞形态差异,分析中性粒细胞、淋巴细胞和巨噬细胞的细胞数。H&E染色后显微镜(200倍)下的细胞形态如图7所示,霍山石斛对小鼠肺泡灌洗液炎症细胞数量的影响如图8所示。
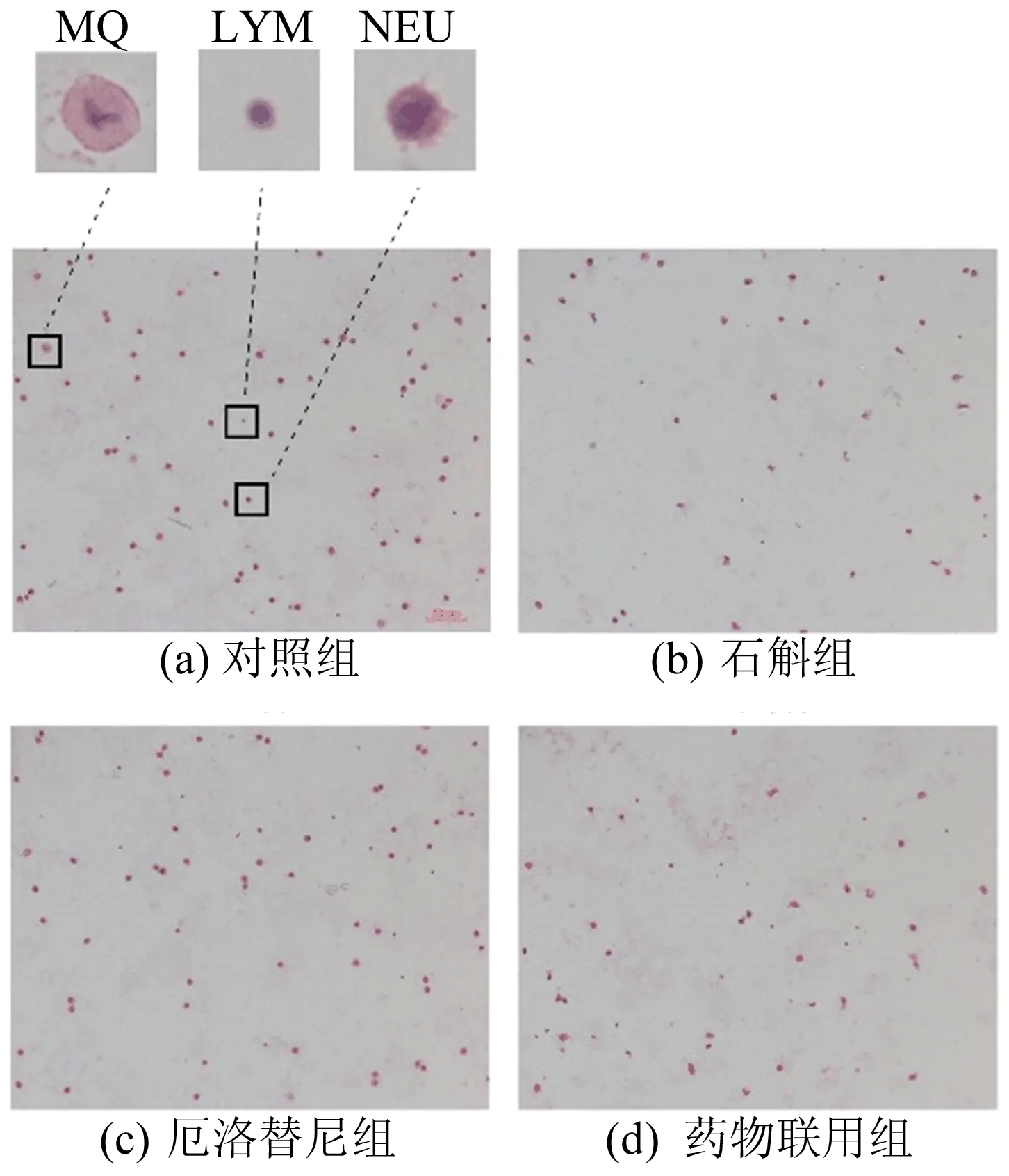
图7 肺泡灌洗液涂片H&E染色
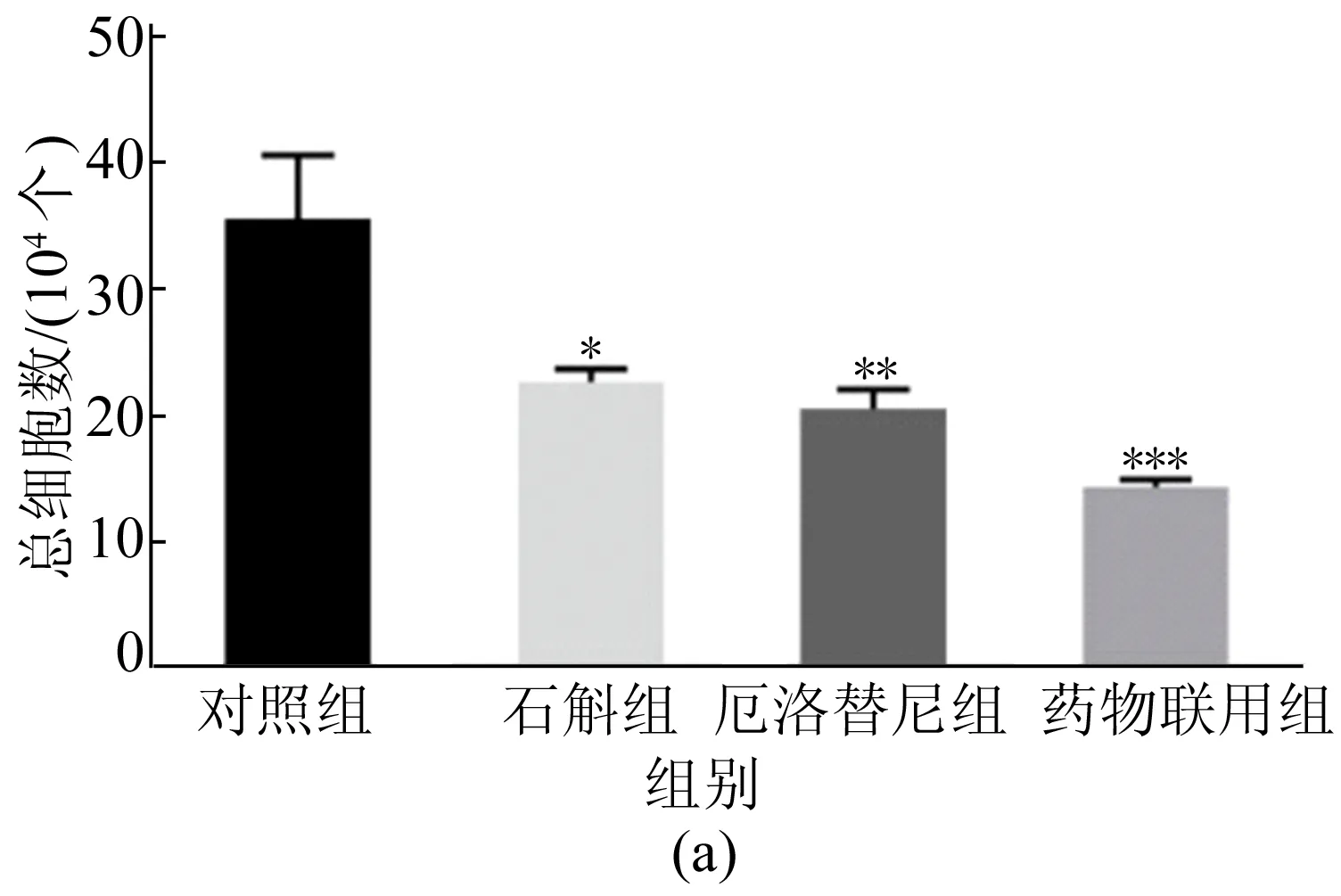

图8 霍山石斛对小鼠肺泡灌洗液炎症细胞数量的影响
从图8可以看出,石斛组和厄洛替尼组炎症细胞数均显著降低,并且药物联用后,炎症细胞数量减少更多,另外药物处理均能降低中性粒细胞、淋巴细胞的数量,而巨噬细胞仅在药物联合处理后才显著降低。
这表明霍山石斛抗炎效果明显,并且能通过与厄洛替尼的联用,更好地抑制尿烷诱导的肺部炎症细胞的募集。
3.5 霍山石斛对肺部炎症的抑制
文献[18]表明尿烷促进炎症因子(IL-1β、IL-6和NF-κB等)的表达而引发肺肿瘤形成。NF-κB转录因子家族是炎症过程的主要介质,并且NF-κB在多种癌症被激活,参与癌症进程。鉴于霍山石斛的抗炎抗肿瘤效果,本文对NF-κB信号通路进行研究。肺部组织NF-κB免疫组化如图9所示。由图9可知,尿烷显著提升肺部NF-κB的表达量,而经过药物处理后,NF-κB表达明显下调。

图9 肺部组织NF-κB免疫组化
本实验检测肺泡灌洗液中TNF-α的质量浓度,结果如图10所示,由图10可知,霍山石斛明显降低了肺泡灌洗液中TNF-α的水平,而厄洛替尼组无明显变化,并且药物联用组效果不显著。
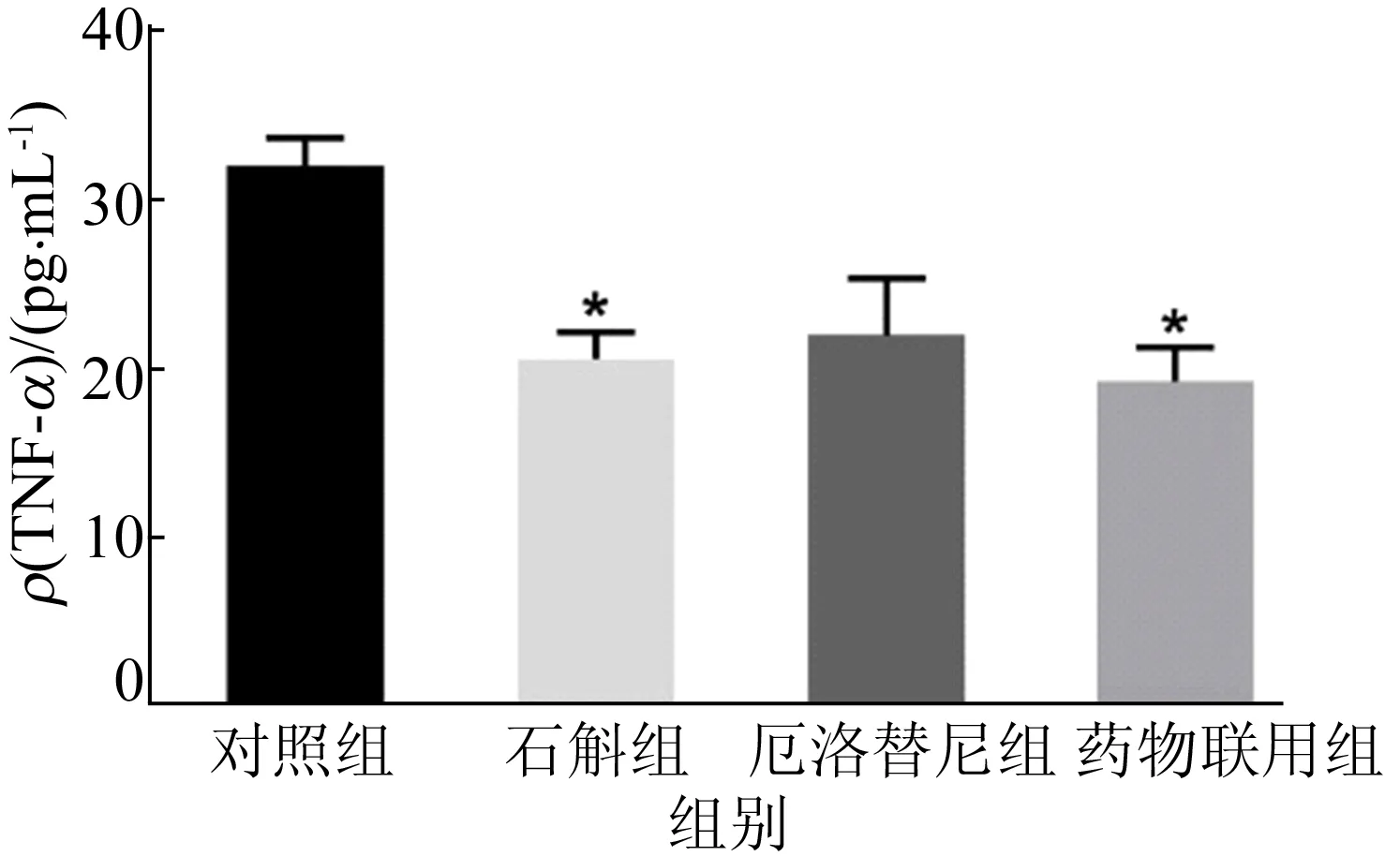
图10 霍山石斛抑制小鼠肺泡灌洗液中TNF-α的水平
此外,本文还通过Western Blot和实时荧光定量PCR检测NF-κB信号通路相关基因表达情况,结果如图11、图12所示,从图11、图12可看出,霍山石斛能明显抑制TLR4、NF-κB、TNF-α、IL-1β表达水平;与厄洛替尼相比,霍山石斛抑制NF-κB、TNF-α、IL-1β的效果更明显;然而,霍山石斛与厄洛替尼联用对NF-κB信号通路无叠加效应。结果表明霍山石斛通过TLR4-NF-κB信号通路降低尿烷诱导的炎症,从而抑制原发性肺癌的发展。另外,虽然霍山石斛和厄洛替尼在抑制炎症细胞数量中具有叠加作用,但在抑制炎症相关分子方面并无类似作用。

图11 霍山石斛抑制TLR4和NF-κB的蛋白表达水平

图12 霍山石斛抑制TNF-α和IL-1β的mRNA表达水平
4 讨 论
霍山石斛作为传统药食同源植物,具有更高的安全性和更少的副作用。霍山石斛可以用于日常服用,增强人体免疫力,具有很高的药用价值。近几年的研究表明霍山石斛具有抗肿瘤活性,但是关于肺癌特别是原发性肺癌的研究较少。本文旨在探究霍山石斛对肺癌发生发展过程中的作用和分子机制。在本实验2种动物模型中,霍山石斛能抑制非小细胞肺癌的发展,且抑癌效果与临床上抗癌经典药物厄洛替尼相近。
炎性环境和炎症细胞能促使正常细胞向癌细胞转化,促进癌症的发生和发展[19]。炎症因子的不断分泌导致白细胞在肺部积累,这些炎症的侵扰可能会导致肺部发病风险增加,包括肺癌[20]。在原发性肺癌模型实验中,本文发现霍山石斛能明显提高小鼠生存率,降低肺部炎性浸润和癌变。另外,霍山石斛与厄洛替尼联用能更显著地阻止肺部炎症细胞募集,但是对肺部炎症因子的抑制作用并没有叠加效应。厄洛替尼对Lewis肺癌模型(即局部复发肿瘤模型)小鼠具有最佳的治疗效果,而在原发性肺癌中,其效果不如霍山石斛。这可能是由于厄洛替尼作为表皮生长因子酪氨酸激酶抑制剂(EGFR-TKI),主要用于治疗已经接受过化疗的局部晚期和转移的非小细胞肺癌,其作用机制是抑制EGFR基因上外显子的异常缺失和突变,而抗炎并非其功效所在,但当霍山石斛和厄洛替尼联用时,能更显著地抑制炎症细胞数量,提示临床上将两者联用可能会对应晚期肺癌患者的治疗具有更佳的疗效。
关于石斛抗癌的报道较多,铁皮石斛提取物通过阻断Wnt/β-catenin途径抑制肝癌细胞增殖并促进凋亡[21];从美花石斛中提取的金霉素能抑制癌干细胞(CSC)活性[22];来源于铁皮石斛的联苯苄可诱导肺癌细胞凋亡[23];铁皮石斛多糖通过调节Wnt/β-catenin途径抑制大鼠胃癌[24];从石斛茎中提取的Lusianthridin能减弱肺癌CSC特性[25]等。上述研究大多是以石斛促凋亡、诱导细胞周期停滞以及抑制癌干细胞为研究重点。而本实验旨在探究霍山石斛能否减弱肿瘤或肺组织炎性环境,从而抑制肿瘤发展。
厄洛替尼对EGFR突变阳性肺癌患者的预后有极佳的效果。但是尼古丁(烟草的成分之一)可通过促进EGFR/AKT/ERK磷酸化来诱导NSCLC细胞对厄洛替尼产生耐药性[26-27]。另外,NF-κB的活化能促进NSCLC细胞获得厄洛替尼和顺铂耐药性[28-29]。无论是传统的毒性药物还是新型分子靶向药物,都遭受耐药性的挑战,耐药性已经成为癌症治疗失败与癌症相关死亡率的主要因素[30]。肿瘤的耐药性可分为内在性和获得性耐药。产生耐药性的机制十分复杂,包括药物透过组织的能力和肿瘤异质性等。耐药性会导致癌症的恶化和复发。
因此,人们迫切需要新型药物以解决耐药性问题。近年来,研究者发现天然物质(如槲皮素、姜黄素、黄芩素等)能通过抑制耐药性相关蛋白表达以及靶向非凋亡细胞死亡,从而降低癌细胞的耐药性[31]。天然药物与临床药物联用来解决耐药性问题已成为热门研究方向。本研究证明,霍山石斛能通过抑制NF-κB信号通路降低肺部炎症并阻止肺癌的发展。由于NF-κB参与癌细胞获得耐药性的过程,霍山石斛可能具有逆转耐药性的能力。因此将霍山石斛与其他抗癌药物的联合用药以解决耐药性问题将具有良好前景。
5 结论
本文通过建立原发性肺癌和Lewis肺癌模型,发现霍山石斛能通过NF-κB信号通路抑制肺部炎症,阻止肺癌发生发展,提高存活率。本研究为霍山石斛的临床应用提供理论依据。
