EDN1和CFH的基因多态性与2型糖尿病增生性视网膜病变的相关性
2022-06-30蒋冬冬靳荷郑柳杨彬彬丁芝祥
蒋冬冬,靳荷,,郑柳,杨彬彬,丁芝祥
(1.桂林医学院临床医学院,广西 桂林 541000;2.桂林医学院附属医院眼科,广西 桂林 541000)
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病患者致盲的主要原因之一[1],也是糖尿病最常见的慢性微血管并发症[2]。糖尿病病程的延长、血糖控制不良、高血压、高血脂、肾功能不全等被认为是与DR相关的重要危险因素[3-5],但是Sobrin等[6]的临床研究发现:一些患者虽然血糖控制不佳或病程较长,最终却没有发展为DR;一些患者即使血糖控制相对较好,也会很快发展为严重的DR,严重影响视功能。这些患者之间存在着个体化差异,提示遗传因素可能在DR的发生、发展中起重要作用,因此了解DR的基因遗传特性将有助于对DR患者的早期诊断和疾病管理。本研究以广西汉族2型糖尿病(type 2 diabetes mellitus,T2DM)人群为研究对象,通过竞争性等位基因特异性聚合酶链反应(kompetitive allele specific polymerase chain reaction,KASP)基因分型检测技术进行单核苷酸多态性(single nucleotide polymorphism,SNP)分型,检测并分析T2DM患者rs5370、rs800292这2个SNPs位点的基因多态性,旨在探讨其与DR的相关性,为DR的临床预防及个性化治疗提供理论依据。
1 对象与方法
1.1 对象
纳入2019年1月至2020年9月至桂林医学院附属医院眼科、内分泌科就诊的T2DM患者为研究对象。患者均在桂林医学院附属医院眼科接受了详细的眼科检查(最佳矫正视力、眼内压、裂隙灯和散瞳眼底检查等)。结合眼底照相、眼底血管造影和眼底光学相干断层扫描的结果并参照《眼科学八年制》第3版中[7]的DR国际分型标准分为无糖尿病性视网膜病变(non-diabetic retinopathy,NDR)组与增生性糖尿病性视网膜病变(proliferative diabetic retinopathy,PDR)组(如果双眼的病变程度不一致,按照病变程度严重的一眼进行诊断、分级)。出现新生血管生成、玻璃体积血、视网膜前出血任一改变的患者为PDR组,没有发生DR的患者为NDR组。纳入标准:1)符合《中国2型糖尿病防治指南(2017版)》[8]诊断标准;2)均为汉族人,并且在桂林居住10年以上,彼此间无血缘关系。排除标准:1)排除1型糖尿病、妊娠糖尿病和其他特殊类型糖尿病;2)排除严重糖尿病肾病、高度近视、单纯高血压、肿瘤等其他原因导致的眼底病变患者;3)排除患有冠状动脉疾病,周围血管疾病,任何血栓形成史,急性感染等的患者。最终纳入386例NDR患者和314例PDR患者。本研究经桂林医学院附属医院医学伦理委员会批准(GLMU1A2019120),并遵守《赫尔辛基宣言》的宗旨。患者均自愿参与本研究,并已签署知情同意书。
1.2 方法
1.2.1 一般临床资料的收集
收集年龄、性别、体重指数(body mass index,BMI)、收缩压、舒张压、高血压史、胰岛素治疗史及糖尿病病史等基本信息,及糖化血红蛋白(hemoglobin A1C,HbA1c)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、肾小球滤过率(glomerular filtration rate,GFR)等实验室检查的临床资料。
1.2.2 基因多态性检测
将所有患者的全血标本收集在EDTA管中,于-20 ℃下保存。使用TIANamp基因组DNA试剂盒[天根生化科技(北京)有限公司]从全血中提取基因组DNA。基于KASP检测技术对SNP位点筛选分析进行基因分型。将来自PDR或NDR患者的等量基因组DNA(0.8 μL/人)与KASP Master Mix和KASP assay mix混合,然后通过PCR扩增含有SNP的DNA片段。PCR程序如下:1)在94 ℃下预变性,时间为15 min;2)在94 ℃下变性,时间为20 s,在65 ℃下退火(每循环降低0.8 ℃),时间为1 min,以上步骤进行10个循环;3)最后在57 ℃下延伸,时间为1 min,进行27个循环。使用Primer Premier 5.0设计用于KASP SNP分析的引物(表1),并使用IntelliQube软件(英国LGC Genomics)分析等位基因频率。

表1 引物序列Table 1 Primer sequences
1.3 统计学处理
采用SPSS 19.0统计学软件对数据进行分析处理。采用Hardy-Weinberg平衡定律进行检验rs5370、rs800292位点的基因型分布是否具有群体代表性。计量资料以均数±标准差()表示,两组间比较采用独立样本t检验;计数资料以频率(百分比)表示,组间比较采用χ2检验。在采用logistic回归分析rs5370、rs800292与T2DM患者视网膜病变的关系时,对具有统计学意义的变量进行校正。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料比较
NDR组和PDR组的年龄为(58.50±11.44)岁、(58.95±10.16)岁,女性比例分别为44.04%、44.59%,差异均无统计学意义(P年龄=0.699,P女性=0.826)。糖尿病病程、BMI、HbA1c、TC、HDL-C、LDL-C的组间差异也均无统计学意义。收缩压、使用胰岛素治疗以及GFR的分析结果显示两组间差异有统计学意义(P收缩压=0.025,P胰岛素=0.001,PGFR=0.013;表2)。
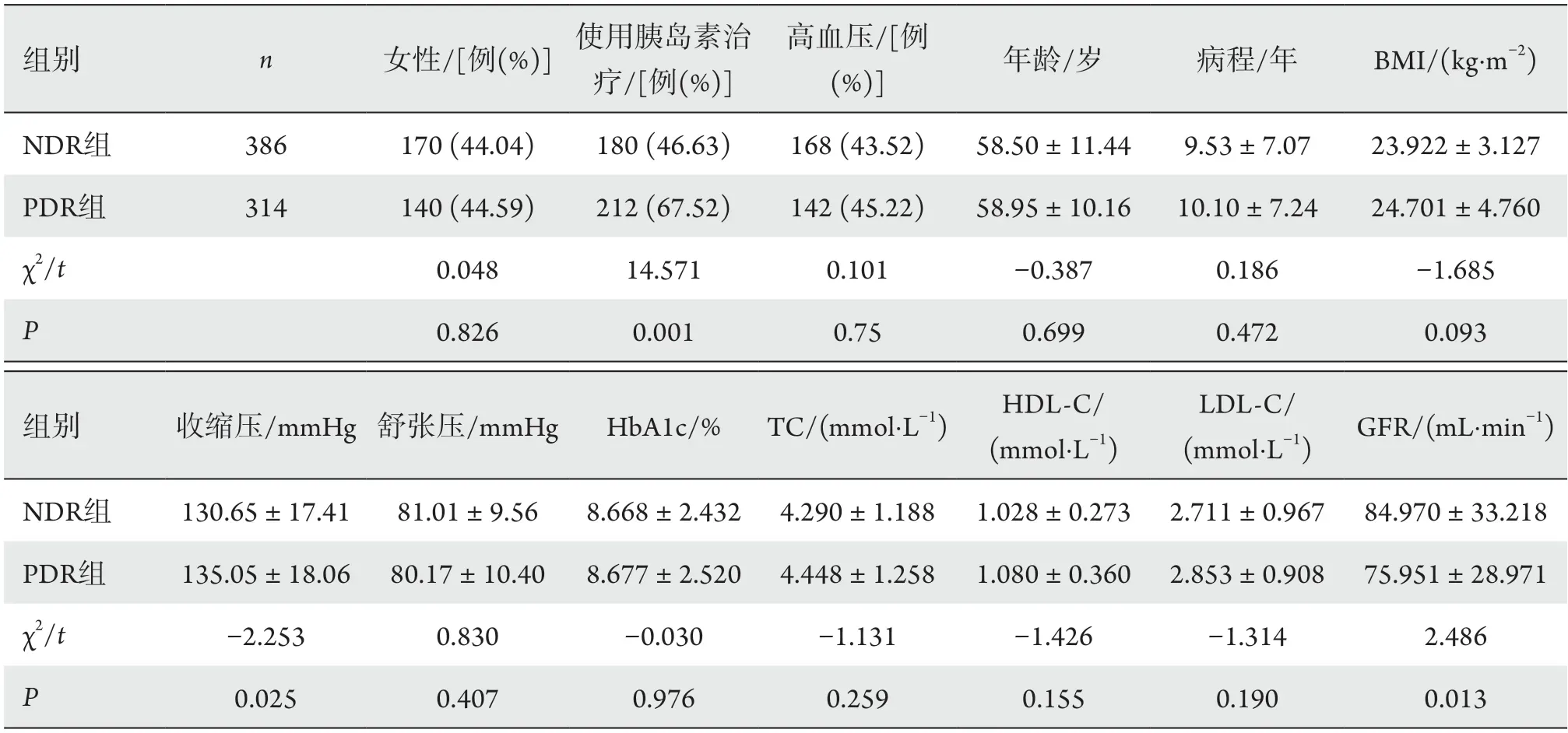
表2 一般临床资料比较Table 2 Comparison of general clinical data
2.2 rs5370、rs800292基因位点的分型结果
分型检测结果显示:rs5370位点存在TT、GT和GG三种基因型,NDR组其频率分别为8.47%、40.74%和50.79%,PDR组其频率分别为13.50%、42.00%和44.50%;rs800292位点存在AA、GA和GG三种基因型,NDR组其频率分别为11.23%、51.87%和36.9%,PDR组其频率分别为16.77%、46.45%和36.78%(图1)。
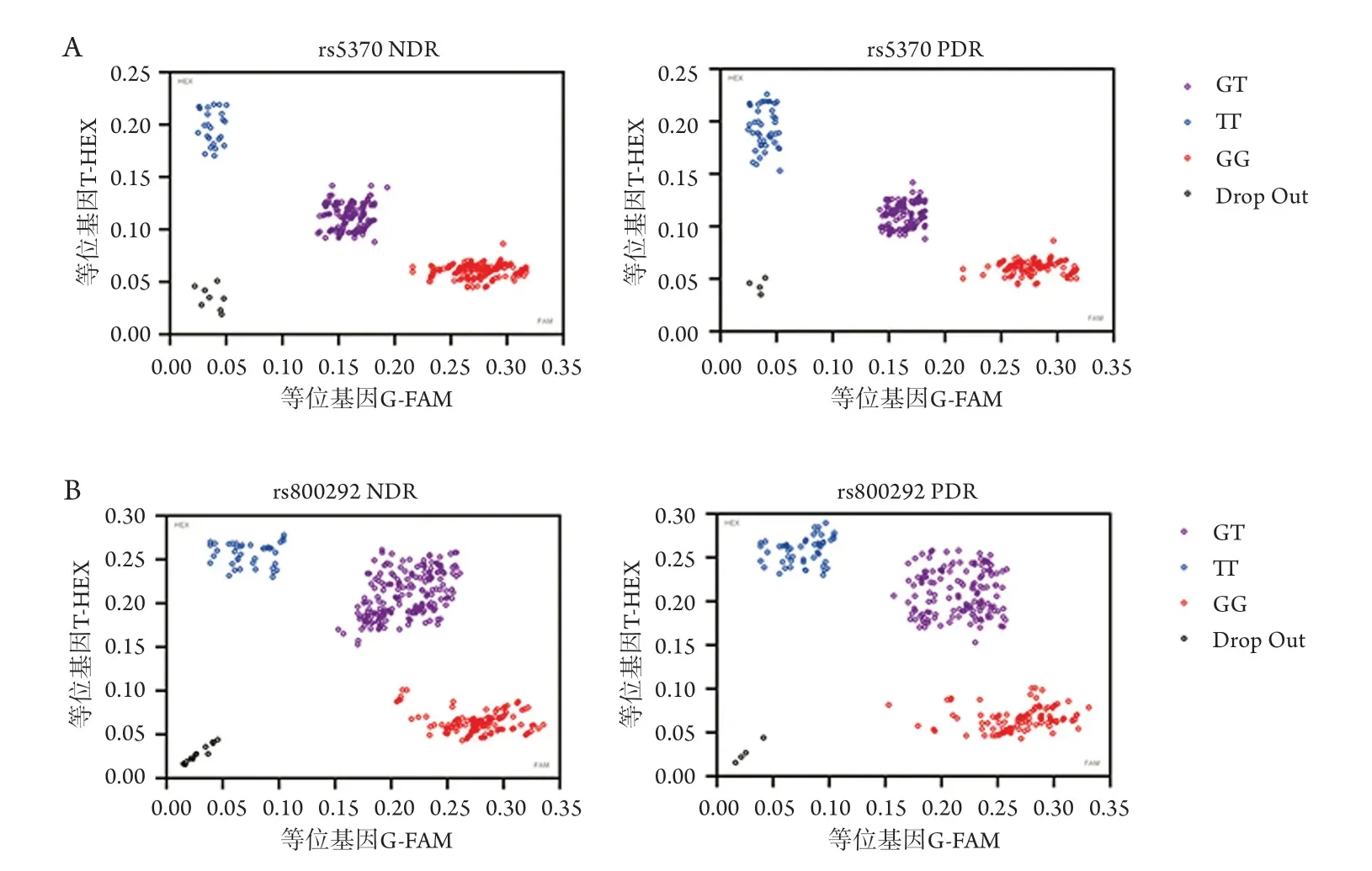
图1 KASP基因分型图Figure 1 KASP genotyping map
2.3 Hardy-Weinberg检验
经Hardy-Weinberg检验,rs5370、rs800292位点基因型分布符合Hardy-Weinberg遗传平衡定律(rs5370:PNDR=0.994,PPDR=0.454;rs800292:PNDR=0.097,PPDR=0.869),因此,2个位点选择的样本均具有群体代表性(表3)。
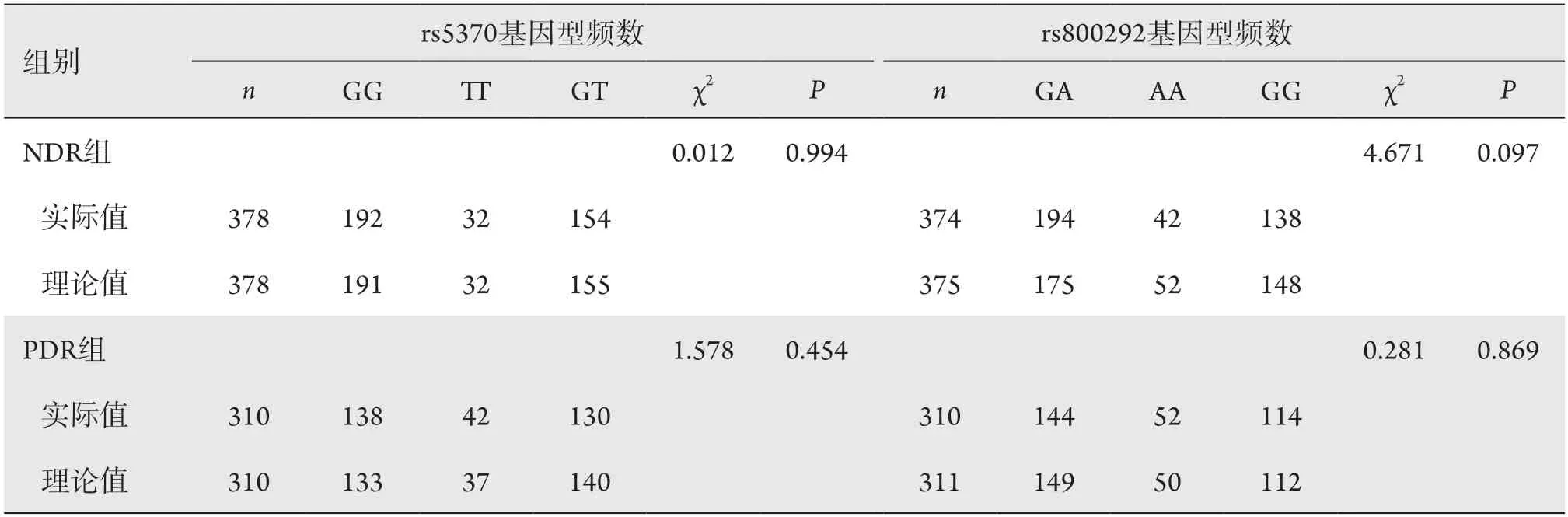
表3 Hardy-Weinberg平衡检验Table 3 Hardy-Weinberg balance test
2.4 NDR组与PDR组rs5370、rs800292两个基因位点的基因型分布频率的比较
在内皮素-1(endothelin 1,EDN1)基因的rs5370位点上,两组间TT基因型与GG+GT基因型频率比较,差异有统计学意义(P=0.032)。在补体因子H(complement factor H,CFH)基因的rs800292位点上,两组间AA基因型与GA+GG基因型频率比较,差异有统计学意义(P=0.036,表4),其余基因型组间差异无统计学意义(P>0.05)。
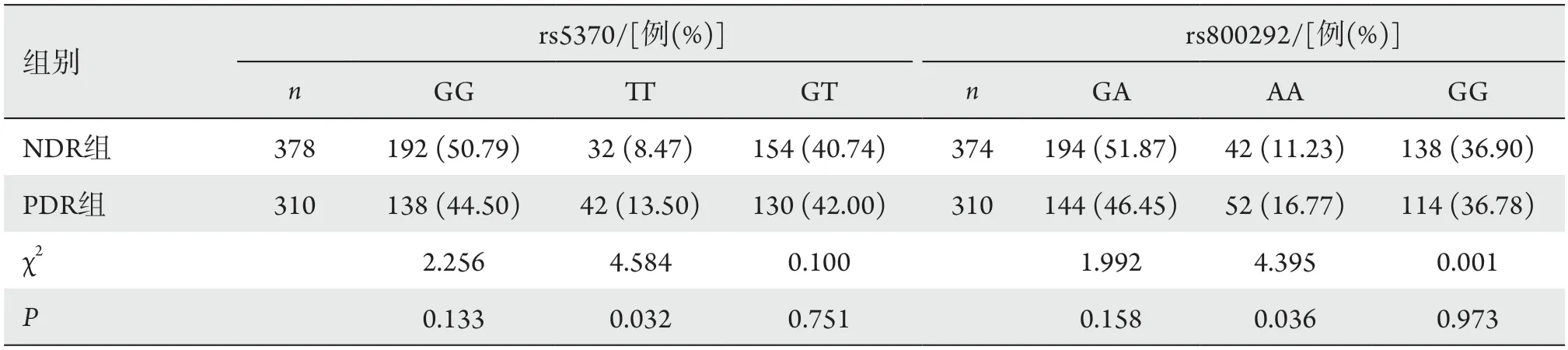
表4 NDR组和PNR组的2个SNP位点的基因型频率分布比较分析Table 4 Comparative analysis of genotypic frequency distributions at two SNP loci in the NDR group and the PNR group
2.5 Logistic回归分析rs5073、rs800292与T2DM患者视网膜病变的关系
以是否发生PDR作为因变量,以rs5370位点基因型为自变量,进行logistic回归分析。根据AIC标准决定最优的遗传模型[9],发现在没有做任何修正时,在隐性模型下携带EDN1基因rs5370位点的TT基因型T2DM患者比GG或GT基因型患者患PDR的风险高2.973倍(OR=2.973,95%CI:1.446~6.112,P=0.003);在隐性模型下,携带CFH基因rs800292位点的AA基因型T2DM患者比携带GG或GA基因型患者患PDR的风险高1.949倍(OR=1.949,95%CI:1.042~3.647,P=0.037)。在校正了收缩压、GFR以及是否使用胰岛素等混杂因素后,在隐性模型下,携带EDN1基因rs5370位点的TT基因型T2DM患者比携带GG或GT基因型患者患PDR的风险高2.718倍(OR=2.718,95%CI:1.254~5.894,P=0.011);在隐性模型下,携带CFH基因rs800292位点的AA基因型T2DM患者比携带GG或GA基因型患者患PDR的风险高2.058倍(OR=2.058,95%CI:1.019~4.158,P=0.044;表5)。
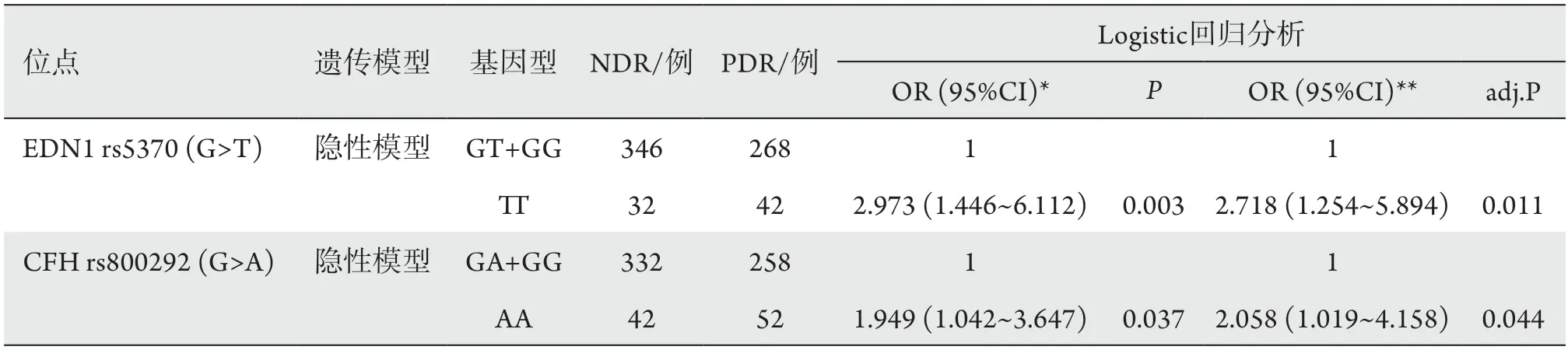
表5 Logistic回归分析 rs5370、rs800292与T2DM患者增生性视网膜病变的关系Table 5 Logistic regression analysis of rs5370,rs800292 and retinopathy proliferative in patients with type 2 diabetes mellitus
3 讨论
单核苷酸多态性(single-nucleotide polymorphisms,SNPs)是脱氧核糖核酸(deoxyribonucleic acid,DNA)序列,通常在不同的群体中这些DNA序列的变化对基因的表达影响也有所不同[10]。如果这些DNA序列的改变发生在假定的调节区,那么它们可能会影响基因的表达[10]。Liu等[11]及Graham等[12]利用全基因组关联研究(Genome-Wide Association Studies,GWAS)检测技术,在不同的种族中检测与DR相关的新基因位点,发现了许多与DR易感性相关的SNPs位点。但目前还没有关于这些位点在中国广西汉族人群中的作用的系统性研究,因此本研究首次集中探讨了EDN1基因的rs5370位点以及CFH基因的rs800292位点在中国广西壮族自治区汉族T2DM人群中的多态性及其对PDR遗传易感性的影响。
T2DM是由于内源性胰岛素分泌缺陷或胰岛素抵抗导致的疾病。Jingi等[13]研究发现:长期使用胰岛素控制血糖会增加DR发生的风险,与本研究结果一致。血糖控制不稳定是糖尿病患者发生DR的高危因素,胰岛素可以帮助患者控制血糖的稳定,然而众多研究证明使用胰岛素治疗可能会增加并发DR的风险[13-14]。这种矛盾的联系背后的机制还不是很清楚。这可能与胰岛素在降糖的同时会降低脂蛋白酯酶活性,使其失去对血管的保护作用有关,同时,胰岛素还会联合生长激素增加血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,进一步刺激眼底新生血管的生成[13]。但是在本研究中,我们认为患者使用胰岛素治疗存在主观因素的影响,使用胰岛素治疗可能并不是发生PDR的危险因素。因为本研究中PDR组纳入的是发生最严重DR的患者,大部分患者因血糖控制不佳,已经在内分泌医生的指导下使用了胰岛素控制血糖。因此,胰岛素与DR之间的矛盾关系及其诱导机制仍需要更多临床数据分析,以及对胰岛素的详细使用时间、种类等进行进一步研究。
英国糖尿病专家共识[15]指出糖尿病患者合并高血压时会增加并发DR的风险,使用血管紧张素转换酶抑制剂等控制血压的药物治疗可显著降低发生并发症的风险,这与本研究结果一致。推测原因可能为高血糖损害了视网膜微血管的压力自动调节机制,使血管内皮细胞更易受到高血压的损伤。收缩压升高造成血管内皮细胞的持续性损伤,血小板附着性增加,最后导致视网膜血管无灌流,组织缺氧诱导新生血管生成[16]。因此推测收缩升高可能与T2DM患者发生PDR相关。
肾小球与视网膜血管具有相似的生理结构,发生病变时均属于糖尿病的微血管病变[17]。T2DM患者的机体持续处于高血糖环境下时,体内血浆渗透压升高对肾小管造成损伤,引起GFR降低。陶俊等[18]的临床研究表明T2DM患者GFR的降低与DR的发生相关,与本研究结果一致。
HbA1c可能和糖尿病糖代谢异常存在关联[19]。当HbA1c水平升高时,会使红细胞加速聚集,容易在毛细血管形成血栓,且红细胞对氧的亲和力也会增加,氧解离减少,引起组织缺氧,刺激血管生成因子的产生[20]。Shurter等[21]研究发现:当T2DM患者的血糖水平控制不佳时,HbA1c水平会明显升高。但本研究发现HbA1c在NDR和PDR组之间差异无统计学意义。这可能与本研究未能检测影响HbA1c水平稳定性的混杂因素有关,例如饮食、熬夜和其他生活方式因素等。其次,此次纳入研究的大多数PDR患者均已经使用了胰岛素治疗,血糖控制较稳定,因此两组间HbA1c无明显统计学差异。
EDN1基因的rs5370位点所在区域是第5外显子的第61个核苷酸[22]。Dubovyk等[23]也认为EDN1的基因多态性与动脉硬化等心血管相关疾病密切相关。PDR在病理生理学上属于新生血管型疾病,因此其发生发展必然与新生血管的调控失常存在必然联系[24]。本研究发现携带TT基因型比携带GG或GT基因型发生PDR风险增加2.718倍。因此,TT基因型可能增加了T2DM患者PDR易感性,可能是PDR的易感基因型。由此推测rs5370区域在第1次酶切的过程中被剪切,该位点发生G等位基因到T等位基因的突变,通过改变前EDN1的氨基酸序列以及干扰酶切的过程来影响成熟EDN1的形成,进而影响血管内皮生长因子VEGF基因的表达,诱导新生血管形成,最终导致T2DM患者进展为DR。因此,T2DM患者EDN1基因rs5370位点的多态性与视网膜的新生血管形成相关。这一研究结果与Li等[25]在中国安徽省人群中的研究结果一致。rs5370位点可能是中国广西壮族自治区汉族T2DM患者进展为PDR的重要遗传标记。
补体系统是先天免疫的关键组成部分,参与调节各种免疫和炎症反应[26-27]。在生理条件下,绝大多数补体成分以无活性酶前体形式存在,在不同激活物作用下发生一系列级联酶促反应被激活,表现出多种生物学活性[26]。T2DM患者的机体长期处于一个高血糖环境下,早期的副炎症和持续的高血糖环境可以诱导补体系统的激活[28]。Tang等[29]的研究也表明DR是与炎症相关的视网膜疾病。因此,CFH基因rs800292位点的多态性可能对补体系统的激活存在影响。本研究发现携带AA基因型比携带GG或GA基因型发生PDR风险增加2.058倍。因此,AA基因型可能增加了T2DM患者PDR易感性,可能是PDR的易感基因型。由此推测T2DM患者的PDR易感性可能与rs800292位点G等位基因到A等位基因的突变有关,与此位点的氨基酸由缬氨酸变成异亮氨酸有关。氨基酸的变化会影响C3b结合能力的结构变化,并降低补体替代途径的激活,随后导致补体系统过度激活,进而诱发炎症性疾病的发生[26]。这一研究结果提示rs800292位点可能为中国广西壮族自治区汉族T2DM患者进展为PDR的另一重要遗传标记。Wang等[30]的研究结果与本研究结果相反。这可能与样本大小、生存环境因素不同以及研究对象的纳入标准、排除标准、分组方法等不同有关。后续仍需更大样本的研究来对结果进一步验证。
本研究也存在一些局限性。首先,病例纳入的只是广西地区的汉族人群,因此得出的结论可能不适用于全国的总体人群。在未来的研究中还需要对不同地区、不同种族的人群进行更大规模的队列研究。其次,由于NDR存在多个病情分级,需要更大的样本数量,我们将在进一步研究中进行统计分析。最后,本研究为PDR的发生提供了提示性证据,为表明该基因对PDR的发病是否起到实际性的作用,在接下来的研究中我们将对该基因的相关表达、血清学检测以及相关通路的机制继续深入研究。
综上所述,临床指标中收缩压升高、GFR降低与T2DM患者发生PDR相关。EDN1基因rs5370位点以及CFH基因rs800292位点的多态性与中国广西壮族自治区汉族T2DM人群发生PDR的风险显著相关,这些位点的基因多态性可能参与了PDR的发病机制,可能是T2DM人群发生PDR的易感基因位点。我们后续仍会收集更大的样本量、进行更深入的研究对数据予以进一步的证实。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-ncnd/4.0/。
