阿托品近视防控的临床与实验室研究进展
2022-06-30陶春文综述林亮汪育文徐菁菁陈杨军南开辉审校
陶春文 综述 林亮,汪育文,徐菁菁,陈杨军,南开辉 审校
(1.温州医科大学附属眼视光医院眼科生物材料实验室,温州医科大学眼视光学院,浙江 温州 325000;2.眼视光学和视觉科学国家重点实验室,浙江 温州 325000;3.温州医科大学附属眼视光医院视光诊疗中心,浙江 温州 325000;4.温州医科大学附属眼视光医院斜弱视专科,浙江 温州 325000)
近视人口在全球范围内逐年增长,预计至2050年近视人口接近50亿,占总人口50%,其中高度近视人口接近10亿[1]。我国等东亚国家近视发生率最高[2]。据报道,我国7~14岁学龄儿童近视发生率约为34%~54%[3-5],随年龄增长近视率快速增长,至18岁,近视人口占比80%~90%[6-7]。由于遗传风险及环境因素暴露增多,近视在低龄儿童中的发生率增加[8]。近视进展在学龄儿童达75~100度/年,随年龄增加进展减缓[2]。因此,近视年龄提前,近视进展时间更长,进展速度更快,发展为高度近视概率增加[9]。近视可以引起集合不足、外斜等双眼视问题[10],也会造成儿童心理健康问题[11],带来家庭及社会的经济负担[12]。高度近视并发症,如青光眼、视网膜脱离、黄斑变性,是致盲的重要原因[13]。近视相关问题已经成为21世纪亟待解决的全球公共健康问题[7,14]。减缓近视进展是近视防控的关键之一。
近视防控的方法主要包括药物及光学方法。Huang等[15]使用荟萃分析对16种近视防控方法进行比较,以眼轴变化为指标,效果依次为高、中、低浓度阿托品、角膜塑形镜、周边离焦软镜、派仑西平、棱镜+双焦组合镜、双焦镜、周边离焦框镜、渐变多焦点镜。具体来讲,低浓度阿托品与屈光方法(角膜塑形镜、周边离焦、双焦、渐变多焦点镜等)进行比较,阿托品减缓屈光度进展0.53 D/年,屈光方法减缓 0.14~0.21 D/年,阿托品减缓眼轴进展-0.15 mm/年,屈光方法减缓-0.04~-0.15 mm/年,药物防控效果更好。阿托品作为近视防控药物,已经在新加坡、中国台湾等地使用,在中国其他地区如上海、北京、温州等地医院有售自制阿托品滴眼液,众多临床试验也在进行中[16-19]。其防控效果及影响因素、防控机制等在全世界范围内备受关注。
1 阿托品近视防控效果的纵向变化
1.1 初次使用近视进展情况
纵向观察阿托品使用过程中屈光度与眼轴的变化,利于研究者及使用者理解其近视防控效果。综合2000年至今已发表的关于学龄儿童使用0.01%低浓度阿托品纵向随机对照临床试验,香港中文大学关于低浓度阿托品防控近视LAMP项目采用双盲设计,0.01%阿托品使用2周没有表现出远视飘移[18]。中国学者Fu等[17]的双盲试验结果表明:使用1个月后,屈光度相对增长-0.01 D,眼轴相对减少-0.03 mm,也没有表现出明显的近视进展减缓,这或许和使用时间有关。延长使用时间,阿托品的近视防控效果逐渐体现,使用4个月后,阿托品组近视进展减缓0.12 D(-0.01 mm),然而作者没有列出统计学结果。在LAMP项目[18]中,4个月后屈光度进展减缓0.12 D,眼轴进展减少-3 mm,具有统计学差异。然而,在新加坡国立眼科中心关于阿托品治疗儿童近视ATOM项目[20]中,实验组儿童使用4个月时仍没有表现出阿托品的近视防控效果,但作者没有列出具体屈光度或眼轴改变数值。使用0.01%阿托品6个月,中国学者Wei等[16]的双盲试验表明阿托品组近视进展明显减缓0.16 D(-0.05 mm);但日本Hieda等[21]的双盲试验表明阿托品组只减缓0.0 7 D(-0.05 m);使用8个月后,LAMP项目[18]0.01%阿托品组近视进展减缓0.18 D(-0.14 mm);若使用1年后,Fu等[17]的研究表明近视进展减缓0.17 D(-0.03 mm);LAMP[18]项目研究中阿托品组减缓0.22 D(-0.05 mm);Wei等[16]的研究结果表明减缓0.26 D(0.09 mm);ATOM[20]的研究中阿托品组近视进展相对减缓0.33 D(+0.04 mm)。印度地区Jethani的研究[22]中,近视进展减缓更多,为0.45 D(-0.09 mm),但Hieda等[21]认为阿托品组近视进展减缓只有0.08 D(-0.04 mm)。使用2年后,Hieda等[21]的研究表明其减缓屈光度为0.22 D(-0.14 mm);LAMP[18]的研究中减缓0.50 D(-0.23 mm);ATOM[20]的研究中减缓0.71 D(+0.03 mm);Jethani等[22]的研究中减缓更多,为1.15 D(-0.27 mm)。我们根据上述研究样本量及报告的减缓屈光度均值,重新计算加权平均数(图1),以直观显示低浓度阿托品使用过程中相对对照组的近视控制效果。图1表明:以屈光度改变量为指标,阿托品使用4~6个月时开始表现出近视进展减缓作用,到8~12个月时近视防控效果较明显,到第2年,防控效果仍然得到维持。
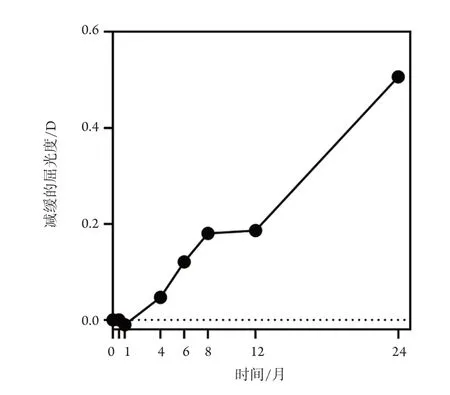
图1 低浓度阿托品滴眼液使用过程中屈光度进展减缓作用变化Figure 1 Myopic controlling effect during the use of lowconcentration atropine
1.2 药物停用后近视进展情况
ATOM项目[23-24]在使用0.01%阿托品2年后进行停药1年观察,近视儿童在停药后第2个月、第8个月、第12个月近视分别进展-0.04 D(0.03 mm)、-0.20 D(0.13 mm)、-0.28 D(0.19 mm),
而对照组近视进展-0.60~-0.76 D/年(0.14~0.20 mm/年)[25],表明药物停用会引起屈光度回退。在另一项研究中[26],0.01%阿托品使用2年停用后随访,3年内近视儿童屈光回退达到-0.43 D/年。
1.3 再次使用近视进展情况
ATOM项目[27]进行了第3阶段的工作,即对停药后近视再次快速进展(-0.50 D及以上)的儿童继续使用0.01%阿托品2年,近视进展量由停用期间的-0.62~-1.09 D/年减缓到-0.38~-0.50 D/年,表明停药后屈光度回退严重、进展变快的儿童再次使用阿托品仍能有效控制近视进展,同时停药后近视进展缓慢的儿童继续停药仍可以保持缓慢进展,为-0.30~-0.38 D/年。
2 阿托品近视防控效果的影响因素
2.1 使用浓度对减缓近视进展的影响
2.1.1 初次使用
本文中把阿托品使用浓度≥0.5%归为高浓度,>0.01%且<0.5%归为中浓度,0.01%归为低浓度分析阿托品的近视防控效果。Huang等[15]的荟萃分析表明:高(1%,5%)、中(0.1%)、低(0.01%)浓度分别减缓屈光度进展0.68 D/年、0.53 D/年、0.53 D/年,减缓眼轴进展-0.21 mm、-0.21 mm、-0.15 mm。Gong等[28]的荟萃分析表明:高(0.5%,1%)、中(>0.01%,<0.5%)、低(0.01%)浓度阿托品分别能减缓近视进展0.62 D/年、0.57 D/年和0.50 D/年。表1对相关研究结果进行了汇总。ATOM项目[20,25]研究了高、中、低浓度阿托品的近视防控效果,2年观察结果表明:低浓度(0.01%)阿托品仍然有比较好的近视防控效果(59%),高浓度(1%)2年的近视防控效果为77%。早期Shih等[29]研究了高、中浓度阿托品,LAMP项目[18,30]研究了中、低浓度阿托品,结果表明其近视防控效果具有更明显的浓度依赖性,随浓度降低,近视防控效果下降显著,分别从高浓度(0.5%)阿托品的96%下降到中浓度(0.1%)的56%,从中浓度(0.05%)的66%下降到低浓度(0.01%)的31%。Li等[31]对LAMP项目进行二次分析,也证实4~12岁儿童对阿托品的近视防控效果存在明显的浓度依赖。总体而言,首次使用阿托品,其近视防控效果表现出浓度依赖性,依赖程度略有差异。另一方面,从ATOM[20,25]及LAMP[18,30]的结果来看,使用0.025%浓度或高于该浓度的阿托品,第1年的防控效果优于第2年,而使用0.01%阿托品近视防控效果则是第2年优于第1年,推测阿托品的近视防控效果与其眼组织内积累浓度相关。因此,通过增加低浓度阿托品的用药频率或进一步提高其生物利用率,可以提高低浓度阿托品的临床应用效果。
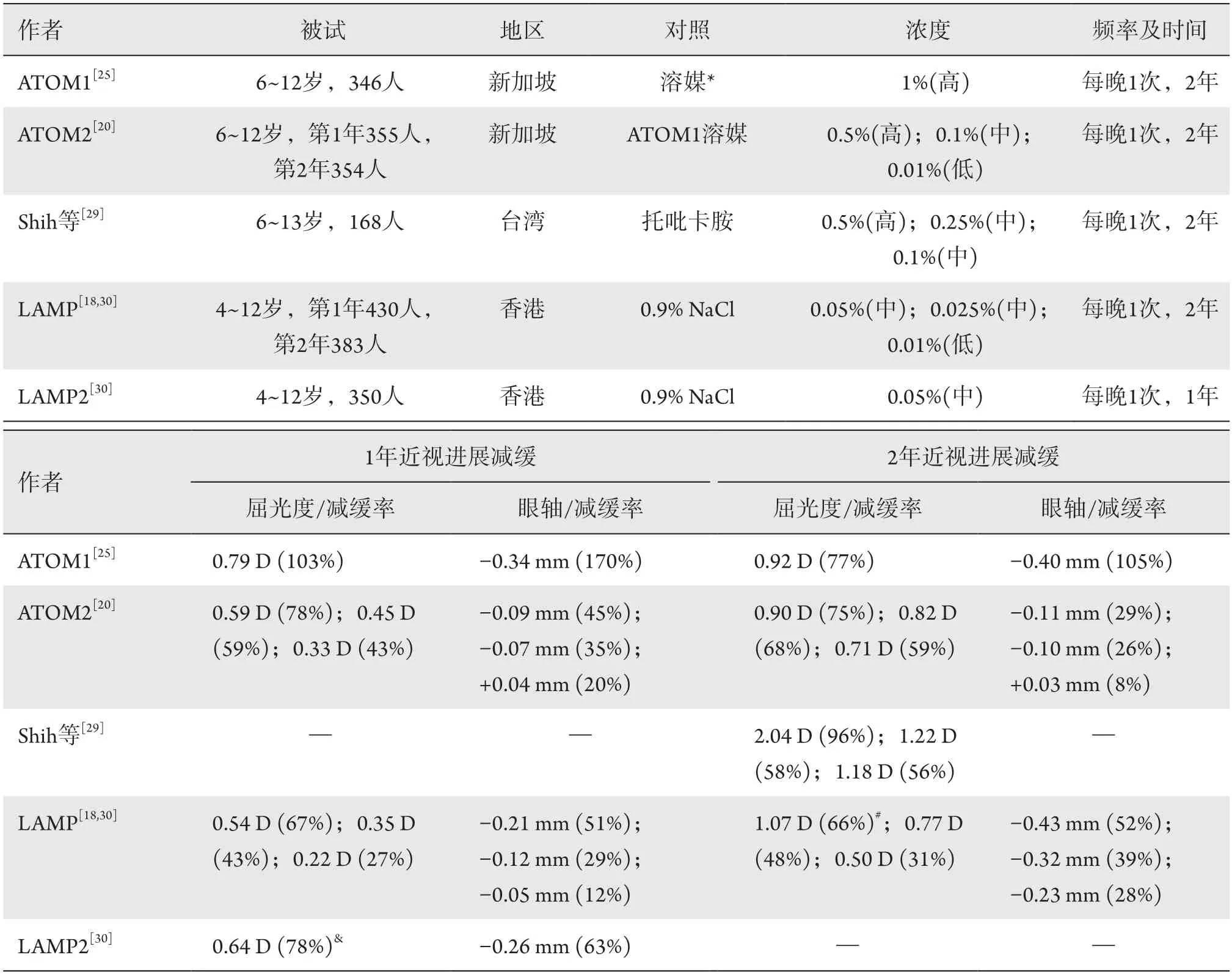
表1 临床试验研究中使用不同浓度阿托品控制近视进展效果Table 1 Effects of different concentrations of atropine on controlling myopia in clinical trials
2.1.2 停用后屈光回退
ATOM2项目[23]对使用2年后停用阿托品的受试者继续随访,考察药物停用1年后近视进展情况,结果显示:使用高浓度(0.5%与0.1%)阿托品受试者停用1年后,其近视进展明显高于使用低浓度(0.01%)阿托品的受试者,屈光度进展分别为-0.87±0.52 D、-0.68±0.45 D和-0.28±0.33 D,眼轴进展分别为0.35±0.20 mm、0.33±0.18 mm和0.19±0.13 mm。
综合使用2年后停用1年的结果来看,使用低浓度阿托品的总体近视延缓程度是最大的,近视进展最少,屈光度进展分别为-1.15±0.81 D、-1.04±0.83 D和-0.72±0.72 D。在更高浓度情况下,ATOM1[24]中1%阿托品使用2年停用1年,总体近视进展为-1.37±0.78 D,屈光回退更明显。
结合5年观察研究,不管是停用1年后再次使用低浓度阿托品治疗组或进展缓慢继续停药观察组,各组中初始2年使用高浓度的儿童,其近视防控效果并没有与初始使用低浓度治疗的儿童产生统计学差异。在停药1年后再次使用阿托品治疗组中,使用高、中、低浓度阿托品儿童5年近视进展分别为-2.36D、-2.32 D、-2.13D,在继续停药观察组,使用高、中、低浓度阿托品儿童5年近视进展为-1.31 D、-1.15 D、-1.06 D,低浓度阿托品的使用也能达到理想的防控效果,甚至在数值上来看进展更少[27]。
由此可见,使用低浓度阿托品受试者在停用后近视进展更缓慢。因此,综合考虑停用后屈光回退的影响,低浓度阿托品在整体上防控效果更突出。
2.1.3 不良反应
不良反应也具有浓度依赖性。Gong等[28]通过荟萃分析指出其不良反应的浓度依赖性。使用1%浓度阿托品可以引起较明显的不良反应,其畏光发生率报道有18%[32],也有100%[33],还包括因散瞳和睫状肌麻痹引起的眩光、畏光、近视力下降引起的近距离工作困难[25]。Yam等[18,30]使用0.05%、0.025%、0.01%低浓度阿托品的为期2年的临床研究表明调节幅度和瞳孔大小的改变是浓度依赖的,眩光症状在短时间内明显。同时第二阶段将原对照组儿童转变为0.05%阿托品治疗组后,受试者及家长也表现出更多担忧,更倾向于使用变色镜片以预防其不良反应。为了减少不良反应,并且得到好的防控效果,需要做更多研究。Foo等[34]通过减少1%阿托品用药频率,1个星期使用1次、2次、3次,使用15个月后近视进展分别为-0.26 D、-0.51 D与-0.46 D,提示在维持近视防控效果的同时可以减少眼部不适、近距离模糊及眩光等不良反应。
2.2 个体差异对近视防控的影响
个体差异对阿托品的使用效果亦存在影响。ATOM2项目[20]中,分别有37%、42%和50%使用0.5%、0.1%及0.01%阿托品儿童近视进展超过0.5 D,且均有约18%≥1.0 D。Fang等[35]研究的结果表明:0.025%浓度阿托品预防近视发生效果良好,但是治疗组仍有8%儿童进展≥0.5 D。在LAMP1研究[18]中,也有40%~60%的阿托品被试近视进展≥0.5 D,15%~18%近视进展≥1.0 D。其他研究[16,29,30]中也有类似的报道。Loh等[36]研究了单眼使用阿托品,纳入年龄、性别、种族、屈光度、父母的社会经济、教育水平、近视情况及户外活动时间和近距离工作活动时间等因素,结果表明使用阿托品后近视仍进展的风险与父母近视相关度最高,其次为对侧对照眼近视进展情况与年龄。Lyu等[37]的研究对近视进展与性别、年龄、父母近视状况、眼压、角膜曲率、前房深度和基线屈光度进行多元回归分析,结果表明发生年龄越早及治疗基线眼轴更短,阿托品治疗组儿童近视进展更快。Ye等的研究[38]表明:除了低龄,视盘旁萎缩同样是影响阿托品近视防控效果的因素。
近视进展的因素主要包括环境因素与遗传因素,研究阿托品防控近视的个体差异也要更全面具体地包含这些因素。需要对使用者年龄、屈光度、眼轴、生长发育及父母近视情况、种族等遗传因素及近距离工作、户外活动、光照等环境因素进行综合分析,以明确个体差异的原因。最近,Li等[31]对LAMP项目进行回顾性二次分析,综合分析了4~12岁近视儿童治疗年龄、性别、基线屈光度、父母近视情况、户外活动时间、近距离工作时间以及治疗依从性等对治疗效果的影响,发现年龄是屈光度进展和眼轴增长的唯一因素,年龄越小,阿托品治疗效果越差,并表现出阿托品浓度依赖的防控效果,6岁儿童使用0.05%阿托品与8岁儿童使用0.025%阿托品以及10岁儿童使用0.01%近视防控效果类似。
2.3 阿托品眼内分布和生物利用度对近视防控的影响
用于近视防控的阿托品大多是滴眼液,滴眼的过程中损失多,生物利用度低,往往小于5%。阿托品作为一种水溶性药物,角膜渗透性差,可经结膜和巩膜渗透分布于眼内组织[39]。Meisner等[40]将[3H]标记阿托品溶液应用于兔眼1次,至8 h,眼组织中始终有阿托品分布,并且放射性含量在角膜、结膜中最高,其次是巩膜、虹膜/睫状体、房水,而在晶状体和玻璃体含量很少,在结膜、虹膜/睫状体、巩膜中0.5 h即达到峰值,在角膜中1 h达到峰值,在晶状体中4 h达到峰值,在玻璃体中8 h达到峰值。
阿托品在眼内被推测主要通过膜扩散。阿托品结膜下注射,角膜中也能检测到阿托品,并且30 min内含量增加,而在房水中没有增加,虹膜和睫状体中含量下降,同时在注射后数分钟内,阿托品在脉络膜和巩膜的含量达到最高[41]。MALDI图像技术通过阿托品滴眼后信号不在晶体及玻璃体分布再次证实其通过眼周-巩膜达到眼后段,同时角膜上皮层的亲脂性使阿托品信号在眼表聚集,角膜渗透受阻[42]。在活体动物和刚处死新鲜兔眼中局部应用阿托品,其均能到达眼的所有部位,并且在后者中浓度更高,说明阿托品主要通过扩散作用到达眼内不同组织,而眼内液的循环不是主要方式[41]。
眼内色素组织(视网膜色素上皮、虹膜、睫状体、脉络膜和视网膜)特别容易结合阿托品,有色素虹膜(正常兔)结合阿托品能力是无色素虹膜(白化兔)的8倍[43]。Wang等[44]在阿托品滴眼3 d后仍都能检测到阿托品。因此,长期局部应用0.01%阿托品可能导致其眼部浓度远远高于单次给药后的浓度,细胞内的细胞器,如黑色素颗粒,可以作为药物缓慢释放的贮存器[43,45]。尽管如此,Ji等[46]通过制备阿托品药膜,增加阿托品眼部停留时间,仍能提高其生物利用度,增强阿托品的近视防控效果。
阿托品单侧滴眼,会在对侧眼造成相对低浓度分布。Wang等[44]在兔中单眼使用1%阿托品,5 h后在对侧眼检测到阿托品,说明单眼使用阿托品,对侧眼会受到影响。Barathi等[47]发现阿托品滴眼后,对侧未使用眼的瞳孔反应下降到75%,但实验眼与对侧未使用眼的近视防控效果仍然有显著差异。可能与阿托品在双眼的眼内浓度不同有关。
3 阿托品的近视调控机制
3.1 调控眼轴长度
阿托品已经在临床中被证实能有效防控近视。在机制方面,LAMP项目[48]在不同低浓度阿托品临床试验中测量随访眼结构,结果表明低浓度阿托品主要延缓眼轴增长达到减缓近视屈光度进展的目的。Ye等[38,49]研究阿托品使用后脉络膜厚度与眼轴增长的关系,使用1%阿托品儿童,6个月时脉络膜厚度变化与内眼轴(眼轴与黄斑下脉络膜厚度之和)变化成负相关,脉络膜厚度与阿托品延缓眼轴增长可能有关。
3.2 近视离焦
Chen等[50]发现联合使用低浓度阿托品与角膜塑形镜(OK镜)防控近视,效果好于单纯使用OK镜,推测是因为两者机制不同得到的叠加效应,但也可能是由于低浓度阿托品带来的散瞳增加了OK镜周边离焦范围引起的。另一方面,Ross等[51]通过配戴隐形眼镜增加眼部滴眼液的眼表滞留时间,提高生物利用度,使其在眼后段的浓度提高与作用时间延长,提示OK镜与阿托品的联合使用效果更好可能是通过增加阿托品眼表滞留,提高了阿托品的生物利用度而起到更好的近视防控作用。Sun等[52]测量阿托品使用儿童的周边屈光,发现与对照组相比,阿托品组在周边呈现相对近视离焦状态。而目前的研究多表明近视离焦是近视的保护因素,比如OK镜等[53-54]被推测通过周边近视离焦有效防控近视。
3.3 巩膜层面——毒蕈碱型乙酰胆碱受体通路
实验室研究中,研究者们也证明阿托品能减缓或阻碍动物近视的发生与进展[55-56]。阿托品作为非选择性胆碱受体拮抗剂,可以放松睫状肌,减少调节痉挛,治疗调节过强引起的近视。早期,阿托品被认为通过调节机制减缓近视进展[57]。但是,McBrien等[58]研究发现阿托品可以减少小鸡的形觉剥夺型近视进展,鸡瞳孔收缩肌为横纹肌,其受体为烟碱型受体,阿托品不能作用于该受体产生调节与缩瞳作用,研究者因此推测阿托品通过毒蕈碱型乙酰胆碱受体(M受体)延缓近视进展。在眼内组织中,角膜,虹膜,睫状体和晶状体上皮中主要存在的乙酰胆碱受体是M3[59-60],在视网膜中主要是M3和M4受体[59],在巩膜中同时存在M1、M2、M3、M4、M5这5种毒蕈碱受体[61]。视网膜内乙酰胆碱主要来源于内核层中的和神经节细胞层中置换的无长突细胞,毒蕈碱受体位于视网膜及其色素上皮层中。视网膜外胆碱能神经支配起源于睫状神经节中的交感神经副细胞群,这些神经元投射至虹膜,睫状肌和脉络膜血管等平滑肌,使脉络膜和巩膜软骨细胞中的毒蕈碱受体受神经支配[62]。多个研究[63-64]表明去除睫状体和虹膜括约肌的胆碱能神经支配对正视化过程或延缓形觉剥夺型近视进展无影响。Fischer等[65]通过破坏小鸡眼内胆碱能途径,包括消除其视网膜乙酰胆碱转移酶活性,破环视网膜无长突细胞和毒蕈碱受体,发现阿托品玻璃体腔注射仍然能抑制形觉剥夺型近视的进展,阿托品调节眼部生长可以不需要视网膜胆碱能无长突细胞或毒蕈碱受体,有可能通过脉络膜,视网膜色素上皮或巩膜中的毒蕈碱受体发挥作用。另一研究[66]在鸡的形觉剥夺型近视发生前后,毒蕈碱受体在视网膜和脉络膜中的密度和亲和力均未改变,表明近视与视网膜和脉络膜中毒蕈碱受体蛋白的表达无关。阿托品在抑制鸡近视进展期间,巩膜的形态学变化比较明显,巩膜神经纤维层增厚,而软骨层变薄[67],所以进一步推测阿托品是通过巩膜纤维层受体发挥近视防控作用。
关于其作用的受体类型,Barathi等[68]敲除小鼠M2受体基因,负镜片诱导4~8周后,对照组小鼠眼轴,晶状体厚度,玻璃体腔深度明显增长,变为近视,而M2基因敲除鼠没有近视化,在M2受体基因敲除鼠中,M1、M4及M5水平增加而M3水平下降,巩膜胶原蛋白I型增加,V型减少。另一研究[69]也证实发生形觉剥夺型近视后,巩膜M1及M4 mRNA及受体蛋白增多。比较不同近视程度中的受体表达,结果显示近视后M3、M2、M4受体拷贝数变异下降,尤其是M3显示与近视存在相关性,叙利亚仓鼠在近视后巩膜上M3受体下调而阿托品治疗后上升[70]。M4选择性拮抗剂MT-3[71]及M1受体拮抗剂派仑西平[72]也表现出阻滞近视进展的作用。Arumugam等[73]在哺乳动物上再次证明了M4及M1拮抗剂对形觉剥夺型近视及负镜片诱导近视的防控作用,表明胆碱能受体拮抗剂可通过M1及M4信号通路防控近视。Barathi等[72]测定阿托品治疗对毒蕈碱受体亚型(M1~M5)的mRNAs水平的影响,结果表明:阿托品治疗后,M1、M3和M4的信息水平在近视巩膜中上调,但M2和M5的变化不大。Qu等[61]通过证明人巩膜中5种乙酰胆碱受体的存在,推测阿托品局部使用会阻断人巩膜成纤维细胞中乙酰胆碱受体,从而导致巩膜细胞外基质,如胶原蛋白和糖胺聚糖的合成增加或降解减少。这些分子将巩固巩膜强度,从而抑制眼睛轴向伸长。
3.4 视网膜及脉络膜相关受体通路
阿托品也可能通过非胆碱途径减缓近视眼的轴向伸长。视网膜的其他途径也可能受到阿托品作用而起到近视防控作用。Barathi等[74]将负镜片诱导近视小鼠分为阿托品使用组与未使用组,并进行视网膜蛋白组进行定量iTRAQ蛋白组学分析,GABA转运蛋白1(GAT-1)在近视小鼠中升高,但阿托品治疗后下降,表明GAT-1在阿托品减缓近视作用中起了关键作用。α2肾上腺素受体拮抗剂被报道能抑制豚鼠的形觉剥夺型近视[75],Carr等[76]研究发现阿托品也能阻断α2肾上腺素能受体的激活。Schwahn等[62]的研究表明玻璃体腔内注射阿托品可以增加眼内多巴胺的含量,多巴胺信号与近视密切相关[77-79],内源性多巴胺的合成能减缓近视进展,D1受体激动剂可起到抑制作用,D2受体激动剂在低剂量下也可抑制形觉剥夺型近视的形成。户外光照是近视的保护因素[80-81],阿托品的使用可以引起瞳孔不同程度的扩大,增加了紫外线的入瞳量及眼内多巴胺生成。另外,也有研究者提出阿托品治疗近视与近视眼炎症反应相关[82]。
Zhou等[56]开展了一系列研究,发现巩膜缺氧是近视形成的原因,近视豚鼠脉络膜厚度变薄,血流灌注减少[83],通过阿托品球旁注射等方式增加脉络膜血流灌注可抑制豚鼠形觉剥夺型近视的进展[84]。
4 结语
阿托品的近视防控效果已有诸多报道,但目前在临床应用及机制研究方面仍存在诸多挑战:1)关于阿托品能达到防控效果最大化及不良反应最小化的使用浓度是多少?目前根据临床观察,综合屈光回退的影响,认为0.01%阿托品的整体近视防控效果更好,同时引起的不良反应最小,多作为推荐浓度。低浓度阿托品连续治疗2年,药物停用后屈光进展不稳定的受试者再次用药仍有减缓近视进展的效果[27]。2)近视防控存在个体差异,因此随访中需要根据近视儿童实际情况进行调整。增加阿托品浓度可以提高其初始治疗效果,因此低浓度阿托品治疗效果不佳的受试者或许可以使用更高浓度阿托品。为了得到更佳的近视防控效果,在控制不良反应的基础上,开始时使用较高浓度的阿托品,之后再降低浓度[85]或者提高低浓度阿托品有效生物利用度[46]可能是可行方法。个体差异中,阿托品的近视防控效果主要受到年龄的影响。在低龄儿童中使用较高浓度阿托品,在高龄儿童中使用较低浓度阿托品,比如6岁儿童0.05%,8岁儿童使用0.025%[31],也是达到更好近视防控效果的手段之一。3)阿托品使用过程中存在明显的屈光回退现象,其具体机制尚不明确,但低浓度阿托品可以减少屈光回退,在保障近视防控效果的情况下,应优先使用低浓度阿托品。4)目前的研究结果表明:阿托品的使用存在一定的浓度依赖性,中、高浓度阿托品减缓近视进展效果第1年最好,第2年降低,而0.01%阿托品则相反,因此,需要思考是否使用略高于0.01%的浓度,可以起到更快更好的防控效果。5)通过提高阿托品生物利用度或联合使用屈光方法(多焦点镜、角膜塑形镜)[50,86-87],发挥不同防控机制的协同作用可以提高近视防控效果。
明确阿托品减缓近视进展的作用机制可以更好地提高近视防控效果并减少不良反应。目前的研究表明:利用巩膜内M1~M5受体信号通路或调控视网膜GAT-1水平,减少ɑ2肾上腺素能受体的激活,以及增加眼内多巴胺含量都可能是阿托品调控近视进展的机制。此外,阿托品亦可通过增加脉络膜血流灌注,改善巩膜缺氧,增加脉络膜厚度抑制近视进展。因此,阿托品发挥近视防控作用是多途径的,可归纳为通过眼后段视网膜-脉络膜-巩膜层面发挥作用。提高阿托品眼后段的相对浓度及组织分布,特别是巩膜水平的靶向性是增强其近视防控效果、减少其不良反应的可行措施。
开放获取声明
本文适用于知识共享许可协议(Creative Commons),允许第三方用户按照署名(BY)-非商业性使用(NC)-禁止演绎(ND)(CC BY-NC-ND)的方式共享,即允许第三方对本刊发表的文章进行复制、发行、展览、表演、放映、广播或通过信息网络向公众传播,但在这些过程中必须保留作者署名、仅限于非商业性目的、不得进行演绎创作。详情请访问:https://creativecommons.org/licenses/by-nc-nd/4.0/。
