气相分子吸收光谱法测定水质氨氮试剂条件的优化研究
2022-06-30李晓燕张振欣张慧敏陈常东彭刚华
李晓燕 张振欣 高 明 张慧敏 陈常东 彭刚华*
(1.江西省生态环境监测中心,南昌 330039;2.山东省日照生态环境监测中心,日照 276800)
氨氮是指水中以游离氨(NH3)和铵离子(NH4+)形式存在的氮,是水体中的主要耗氧污染物,是水质质量评价的重要指标,是生态环境监测的常规必测指标之一[1]。
近年来,气相分子吸收光谱法以自动化程序高,测定范围宽,适用范围广,检出限低,适合大批量样品的快速分析等特点脱颖而出。随着仪器技术的日趋完善,相关标准方法《水质氨氮的测定 气相分子吸收光谱法》(HJ/T 195-2005)[2]、《水质 氨氮的测定 气相分子吸收光谱法》(T/CHES 12-2017)[3]应运而生,其方法研究和应用文章相继发表,气相分子吸收光谱法在生态环境监测工作中应用越来越广泛。据统计,2005年以来所有排放标准均引用了气相分子吸收光谱法。
在实际测定中,随着样品类型越来越复杂,现有的标准方法[2,3]试剂条件受到氧化能力弱、氧化时间长、抗干扰能力差等因素的制约。增加溴酸钾与溴化钾的用量,使生成的有效氧化物质增加,可以提高氧化剂的氧化效率,但随着溴酸钾与溴化钾的用量提升,样品实验室空白的吸光度值也随之升高,使得测定结果偏大。文献[4-6]对气相分子吸收光谱法测定水中氨氮试剂条件的研究方法尚不完善。
本研究在理论计算结果的基础上开展单因素实验和正交实验,较系统地研究优化试剂条件,优化气相分子吸收光谱法测定水质氨氮的试剂条件。并选取地表水、地下水、海水、生活污水、工业废水等5种适用范围水体为研究对象,探讨该试剂条件下,气相分子吸收光谱法与分光光度法测定氨氮的可比性。
1 实验部分
1.1 仪器和试剂
AJ-3700 气相分子吸收光谱仪(与分光光度法比对实验);GMA 376 气相分子吸收光谱仪(单因素实验和正交实验);TU-1901 紫外可见分光光度计;ST106-3RW 全自动蒸馏仪。
市售纯水;氧化剂次溴酸盐混合液(由溴酸钾、溴化钾、盐酸、氢氧化钠配制);催化剂载流液(由盐酸、无水乙醇配制);氯化铵;硼酸;轻质氧化镁;溴百里酚蓝;盐酸或氢氧化钠;纳氏试剂(碘化汞-碘化钾-氢氧化钠)。以上均为分析纯试剂。
1.2 实验步骤
气相分子吸收光谱法参照HJ/T 195-2005[2],校准曲线的标准系列(0.00 mg/L、0.10 mg/L、0.20 mg/L、0.80 mg/L、1.60 mg/L、2.00 mg/L)采用水中氨氮标准贮备溶液(ρ=1000 mg/L)逐级稀释配制,仪器条件参照仪器说明书。
纳氏试剂分光光度法参照HJ 535-2009[7]。
2 结果与讨论
2.1 理论计算结果
以GMA 376型号仪器为例进行理论计算:
由此得出,1 mol 溴酸钾对应1 mol 的氨氮,并得出以下算式:
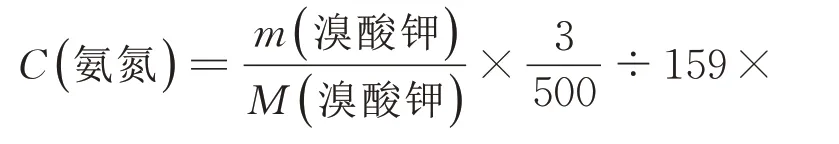

159——氧化剂体积和,即100 mL 水,3 mL 溴酸盐混合液,6 mL 盐酸,50 mL 氢氧化钠;
500——溴酸钾和溴化钾定容到500 mL。
由理论计算结果可知:在GMA 376 现有仪器条件、目前样品泵和氧化剂泵的转速下,2.81g 溴酸钾(按从500 mL 中取3 mL 溴酸盐混合液来计算)理论可以氧化4.0 mg/L 氨氮。
理论计算是不考虑干扰和试剂纯度的,实际情况更复杂,可能无法达到理论计算对应量,因此,该实验应使溴化钾过量保证反应中能获得足够的溴。HJ/T 195-2005[2]校 准 曲线最 高 点 为2.0 mg/L 氨氮,设计实验时以2.81g 溴酸钾为基础。
2.2 相关标准和方法
相关标准和方法中氧化剂试剂条件见表1。
由 表1 可 以 看 出,HJ/T 195-2005[2]、GB 17378.4-2007[8]的试剂条件,因氧化能力弱、氧化时间长、抗干扰能力差,现阶段实际样品分析已不适用。结合2.1 理论计算结果,实验室在氧化剂(2.81g 溴酸钾、30g 溴化钾,3 mL 溴酸盐混合液,6 mL 盐酸,50 mL 氢氧化钠,100 mL 水)和载流液(25%盐酸和30%无水乙醇)基础上开展单因素实验和正交实验,以期研究出适用、有效的最佳试剂条件。
2.3 单因素实验
采用2.0 mg/L 氨氮标准溶液,每次只改变其中一种试剂用量做梯度实验,筛选出开展正交实验的最佳试剂条件范围内的3个值。寻找出满足测定浓度相对误差小于±5%,且吸光度最大的试剂条件附近的3个值。
2.3.1 氧化剂试剂条件选择
2.3.1.1 改变溴酸钾与溴化钾试剂条件
采用2.0 mg/L 的氨氮标准溶液,改变溴酸钾与溴化钾试剂条件。实验结果见表2。
由表2 可以看出,满足测定浓度相对误差小于±5%,且吸光度最大为序号6 的试剂条件,正交实验溴酸钾与溴化钾3个试剂条件值为溴酸钾(2.75g、2.81g、3.25g)、溴化钾(25g、30g、35g),定容到500 mL。
2.3.1.2 改变氧化剂试剂条件
分别测试2.0 mg/L 的氨氮标准溶液,改变氧化剂中溶液量实验结果见表3。
由表3 可以看出,满足测定浓度相对误差小于±5%,且吸光度最大,实验1 为序号3 的试剂条件,正交实验溴酸盐混合液3个试剂条件值为2.5 mL、3.0 mL、3.5g mL;实验2为序号4的试剂条件,正交实验6 mol/L 盐酸3个试剂条件值为5.0 mL、6.0 mL、7.0 mL;实验3为序号3的试剂条件,正交实验40%氢氧化钠3个试剂条件值为45 mL、50 mL、55 mL。
2.3.2 载流液的试剂条件选择
保持盐酸占比25%,改变无水乙醇的占比5%~50%(5%递加);保持无水乙醇占比30%,改变盐酸的占比10%~35%(5% 递加),分别测试2.0 mg/L 的氨氮标准溶液,实验结果见表4。
由表4 可以看出,盐酸占比20%以下测试氨氮标准溶液准确度差,盐酸占比30%以上吸光值差别不大。无水乙醇占比15%以下测试氨氮标准溶液准确度差,无水乙醇占比20%以上吸光值差别不大。筛选出正交实验最佳试剂条件范围内的3个值分别为盐酸(20%、25%、30%)、无水乙醇(20%、25%、30%)。
2.4 正交实验
在单因素实验的基础上,实验设计一组7 因素,3 水平的正交实验L18(3×7),分别测试2.0 mg/L的氨氮标准溶液。其中7 因素为以下7种试剂的用量:溴酸钾、溴化钾、溴酸盐混合液、40%氢氧化钠、6 mol/L 盐酸,盐酸、无水乙醇;3 水平:单因素实验中筛选出的3个试剂条件值。吸光度最大的那个试剂条件认为是最佳试剂条件。
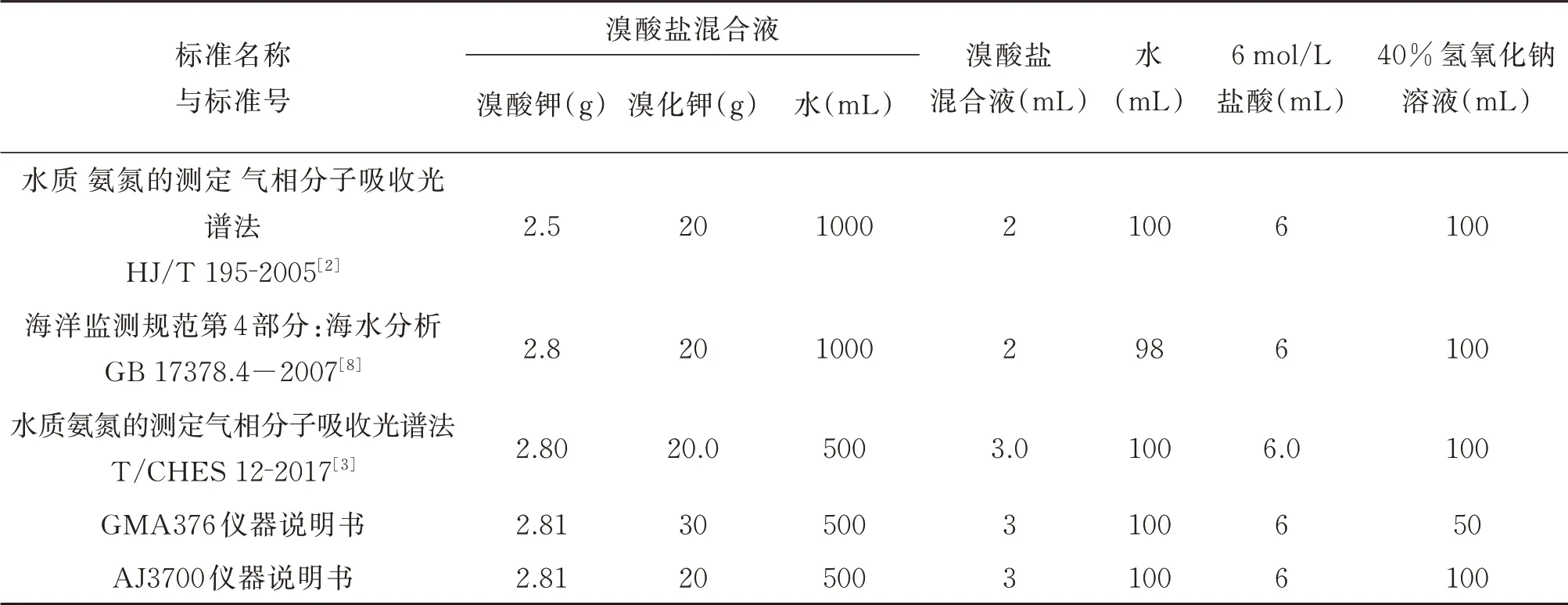
表1 相关标准和方法中氧化剂试剂条件
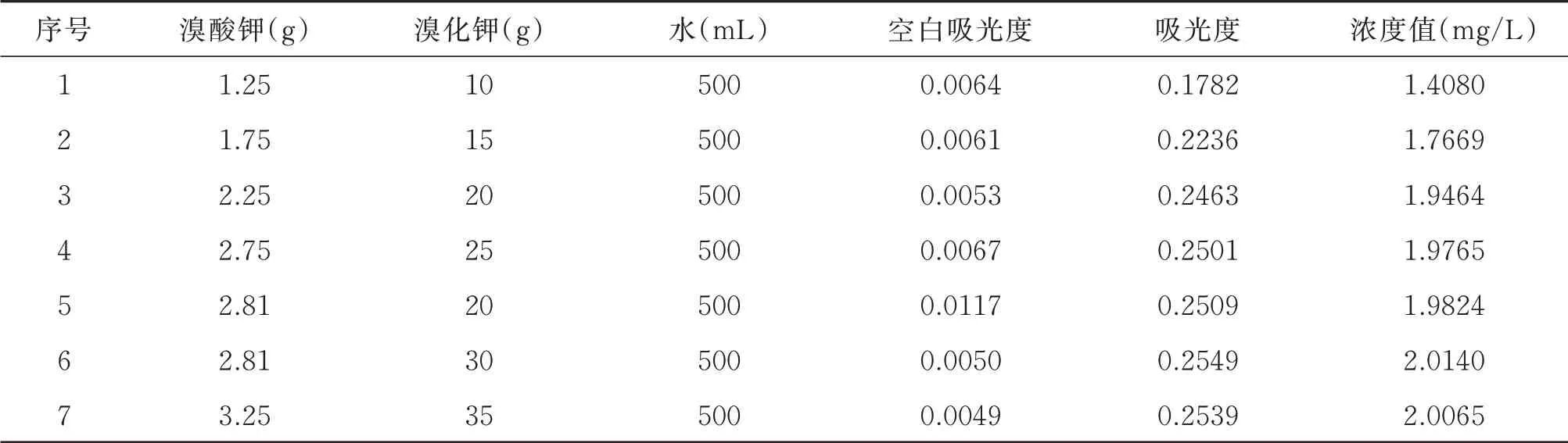
表2 改变溴酸钾与溴化钾试剂条件实验结果
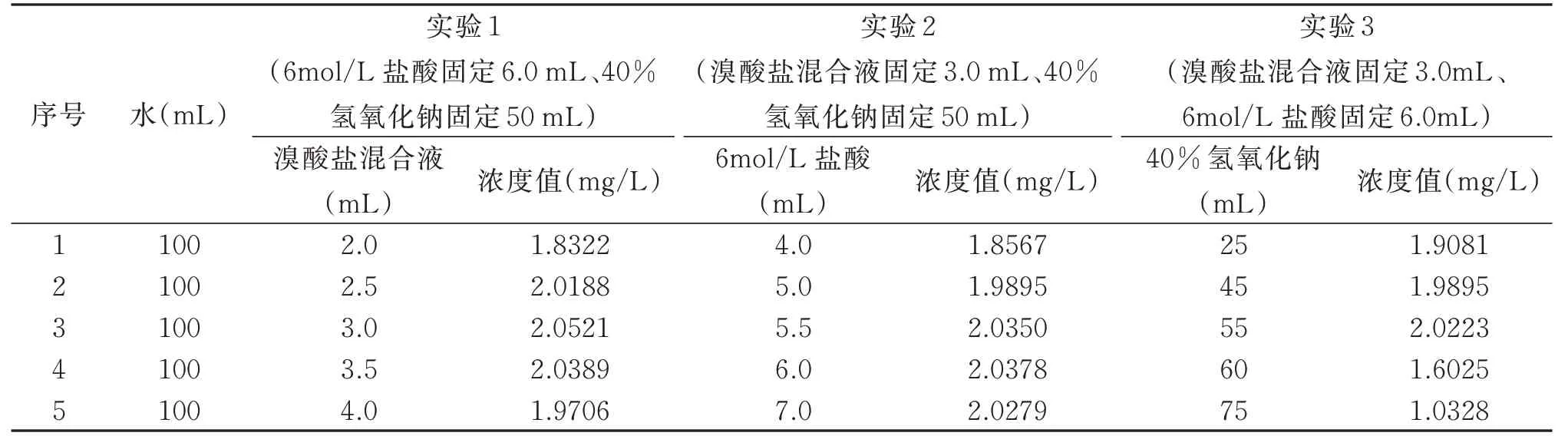
表3 改变氧化剂试剂条件实验结果
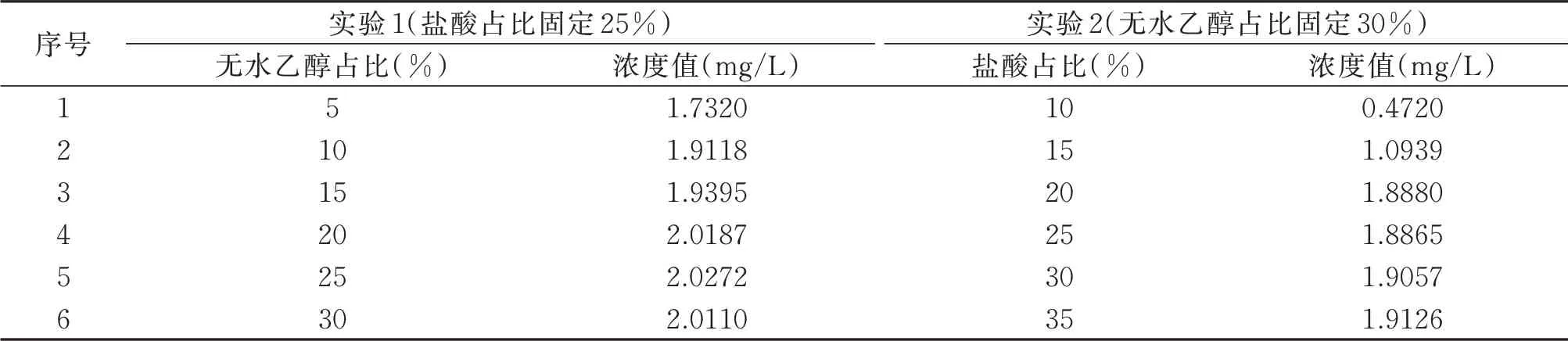
表4 改变载流液试剂条件实验结果
正交实验计划见表5,正交实验结果见表6。
由表6 可以看出,正交实验14 吸光度最大,为最佳试剂条件。由此可知,气相分子吸收光谱法测定水质中氨氮最佳试剂配制方法如下:
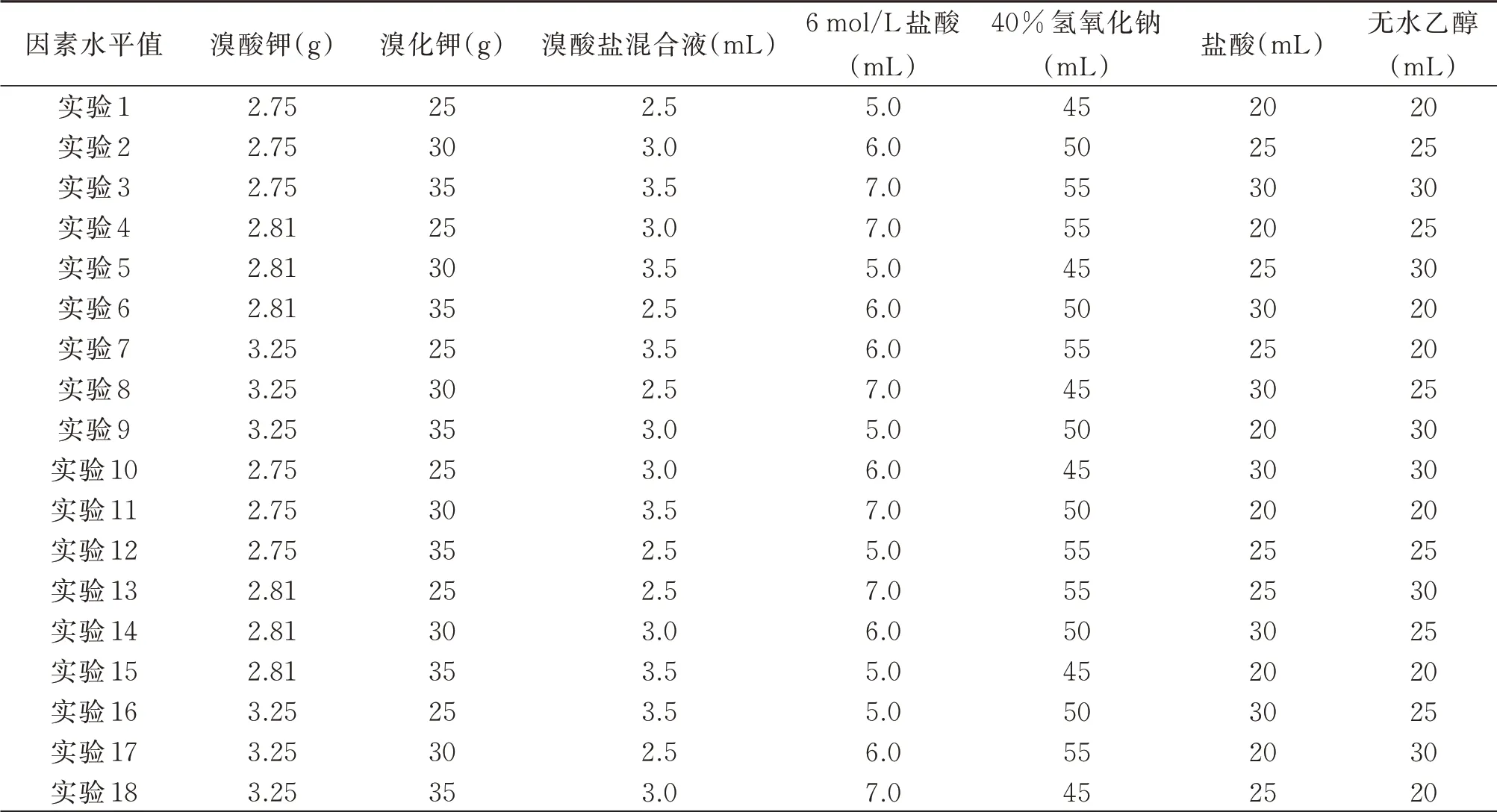
表5 正交实验计划表
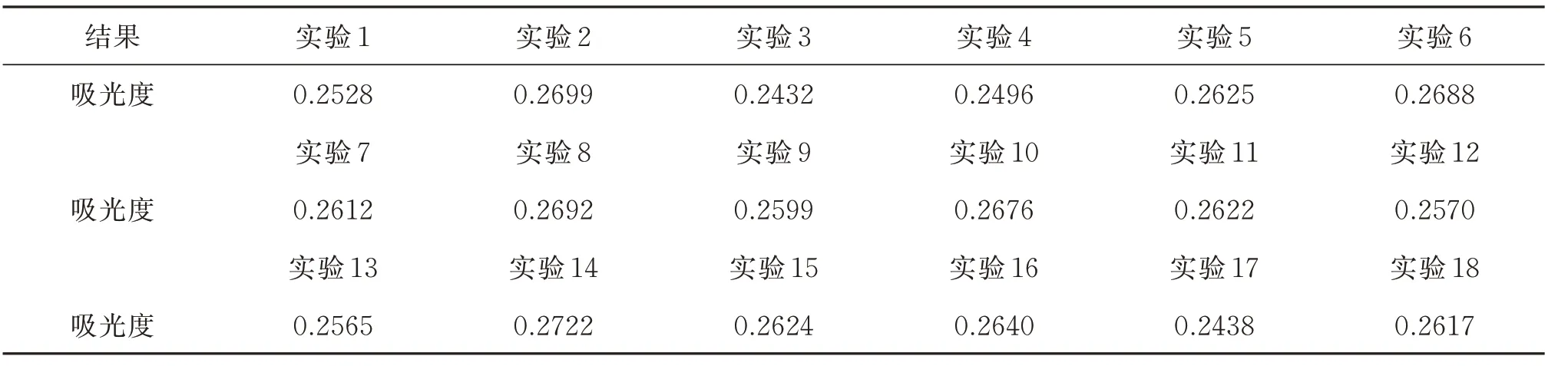
表6 正交实验结果表
1)溴酸盐混合液:2.81g 溴酸钾和30g 溴化钾,溶解于500 mL 水中,摇匀,贮存于玻璃瓶中。
2)氧化剂:3 mL 溴酸盐混合液于棕色磨口试剂瓶中,加入100 mL 水及6 mL 盐酸(6 mol/L),立即密塞,充分摇匀,于暗处放置10 min~20 min,加入50 mL40%氢氧化钠,充分摇匀,待小气泡逸尽再使用。该试剂临用时配制,配制时,所用试剂、水和室内温度应在18 ℃~30 ℃。
3)载流液:30%浓盐酸和25%乙醇,充分摇匀或超声,静置2 h 以上。
2.5 与分光光度法的比对
选取地表水、地下水、海水、生活污水、工业废水等5种适用范围水体为研究对象,地表水、地下水、生活污水、工业废水与纳氏试剂分光光度法[7]进行比对,海水与《海洋监测规范第4 部分:海水分析》(GB 17378.4-2007)(36.2)次溴酸盐氧化法[8]进行比对,计算相对偏差,确定在该试剂条件下,气相分子吸收光谱法测定氨氮与分光光度法测定氨氮的可比性[9]。
气相分子吸收光谱法与分光光度法测定水中氨氮比对结果见表7。
由表7可以看出,地表水、地下水、生活污水、工业废水(石化废水)和海水等5种适用范围水体,气相分子吸收光谱法与分光光度法测定水中氨氮结果相对偏差-11%~10%,说明气相分子吸收光谱法与分光光度法测定水中氨氮结果可比。
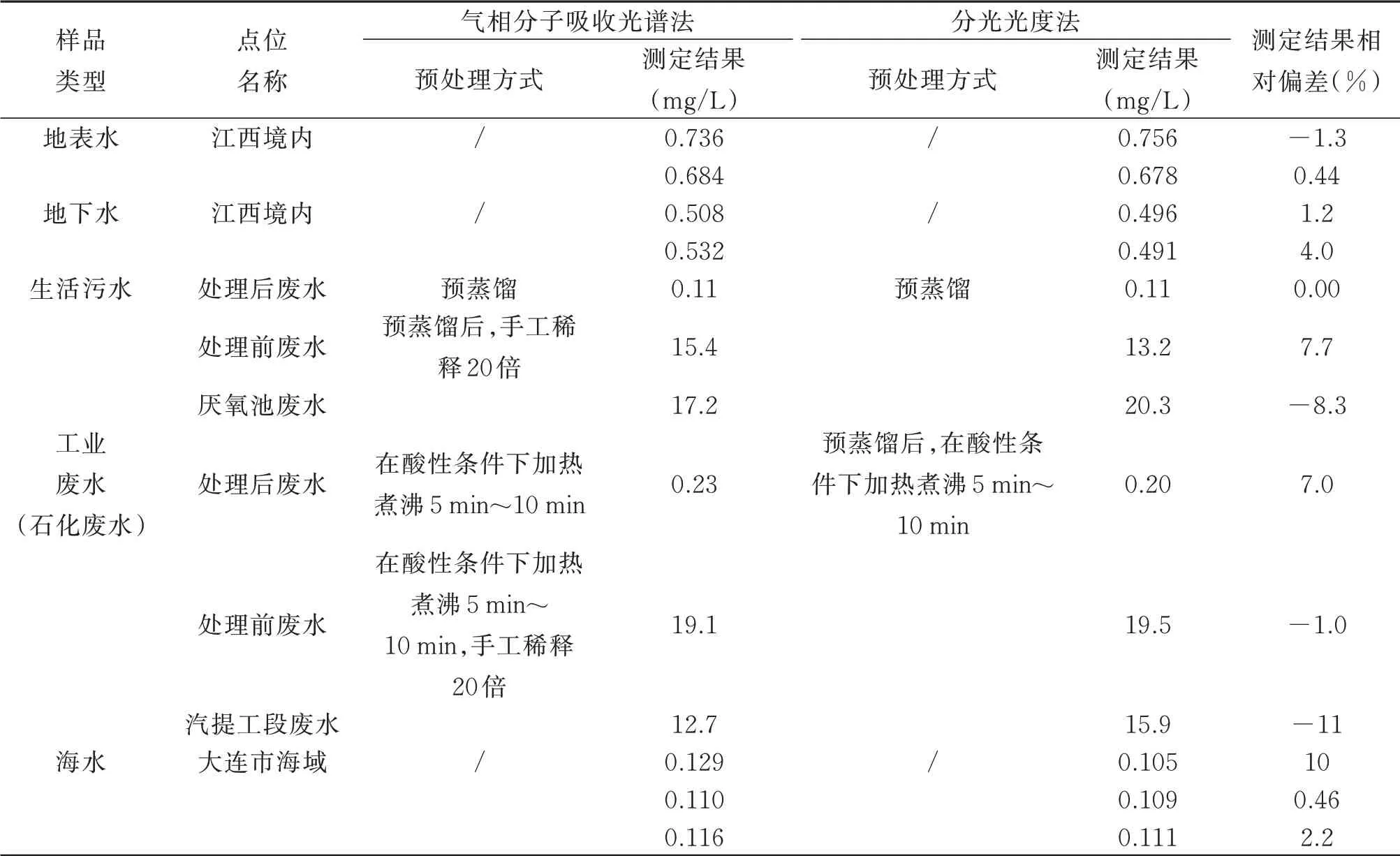
表7 气相分子吸收光谱法与分光光度法测定水中氨氮方法比对结果
3 结论
1)本研究确定的气相分子吸收光谱法测定水中氨氮最佳试剂配制方法为:
载流液:分别量取300 mL 盐酸和250 mL 无水乙醇,用水定容到1L。充分摇匀或超声,静置2h 以上。
溴酸盐混合液:称取2.81g 溴酸钾及30g 溴化钾,溶解于500 mL 水中,摇匀,贮存于玻璃瓶中。此溶液为贮备液,常年稳定。
氧化剂:吸取3 mL 溴酸盐混合液于棕色磨口试剂瓶中,加入100 mL 水及6.0 mL 盐酸(6 mol/L),立即密塞,充分摇匀,于暗处放置10 min~20 min,加入50 mL 氢氧化钠(40%),充分摇匀,待小气泡逸尽再使用。该试剂临用时配制,配制时,所用试剂、水和室内温度应在18 ℃~30 ℃。
2)由本研究实验结果可知,地表水、地下水、海水、生活污水、工业废水等5种适用范围水体在该最佳试剂条件下,气相分子吸收光谱法与分光光度法测定水质中氨氮具有可比性。
