NO-AMPK通路对牛肉宰后成熟过程中蛋白特性与肉品质的影响
2022-06-30马纪兵余群力
李 乔 马纪兵 余群力,* 韩 玲
(1 广东理工学院,广东 肇庆 526100;2 甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
动物宰后,肌细胞会在缺血、缺氧等应激条件下通过一氧化氮合成酶(nitric oxide synthase,NOS)催化产生一氧化氮(intric oxide, NO)[1]。NO作为一种气体信号分子广泛存在于肌肉组织内,参与调节机体生理活动[2]。研究报道,NO和一磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)之间存在联系。正常生理状态下,NO通过增加胞内Ca2+水平,提高AMPK活性[3]。Vitor等[4]使用NO供体对小鼠骨骼肌细胞进行处理,发现p-AMPK表达升高,结果确定AMPKα1亚型是NO诱导骨骼肌细胞效应的介质。NO供体是AMPK有效的激活剂,但在NOS抑制剂存在的条件下,这种激活作用明显减弱[5-6],说明在活体动物细胞中NO对AMPK具有重要调节作用。
肌肉宰后供氧中断,有氧呼吸作用停止,糖酵解反应开始。已有研究证实,宰后AMPK促进糖酵解进程,促使乳酸积累,pH值降低,最终影响肉品质[7-8]。当pH值下降至最小时,肌肉达到最大化僵直,此时肉的蛋白特性和各项品质均较差[9]。pH值不仅可以评估宰后肌肉的成熟进程,其高低还会影响肌肉蛋白特性,进而影响肉品质[10],当pH值接近蛋白等电点时,肌球蛋白、肌动蛋白等发生收缩,游离水增加,此时肉的嫩度和保水性变差。此外,肌原纤维蛋白的水解程度也会影响肉品嫩度和保水性[11]。Farouk等[12]发现动物宰后肌原纤维蛋白的水解会影响蛋白功能特性,如提高溶解度、改善肉品质等;Choe等[13]也提出宰后肌原纤维蛋白功能特性的改变对改善肉品质和加工性能有很大作用。可见,动物宰后AMPK活性对肉的蛋白特性和品质具有重要影响。
然而,肌肉宰后成熟过程中,NO是否调控AMPK活性,以及NO通过AMPK途径对肌肉蛋白特性和肉品质造成何种影响,尚未见相关报道。因此,本研究以牛臀股四头肌为研究对象,经过L-NAME(NOS抑制剂,抑制NO生成)、Compound C(AMPK抑制剂)处理,在不同成熟时间点分别测定NO-AMPK通路、蛋白功能特性、肉品质及肌肉微观结构等相关指标,以期揭示宰后成熟过程中NO-AMPK通路对牛肉蛋白特性及肉品质的影响。
1 材料与方法
1.1 试验材料
选取健康、发育正常、平均年龄3~4岁的西门塔尔杂交公牛6头,体重为600±30 kg,购自甘肃康美现代农牧产业集团有限公司。参考国内外对动物福利的相关要求,严格按照《GB/T 19477-2018畜禽屠宰操作规程 牛》[14]屠宰方式进行操作。动物屠宰放血后(45 min内)取臀股四头肌,剔除表面的脂肪和结缔组织备用。
1.2 主要仪器
HI99163型便携式pH计,意大利哈纳HANNA仪器公司;SPectramax M2型酶标仪,美国美谷分子仪器有限公司;DSC25型差示扫描量热仪,美国TA仪器公司;JSM-6701F型扫描电子显微镜,上海立泛机电设备技术有限公司;TX.XT express型质构仪,英国Stable Micro System公司;JSM-6701F型低真空扫描电子显微镜,日本电子光学公司;C-LM4型肌肉嫩度仪,东北农业大学工程学院。
1.3 试验方法
1.3.1 试验设计 将肉样切割成约60 g(2 cm×4 cm×10 cm)左右的肉块,随机分为3个组:1)NOS抑制组,20 mmol·L-1L-NAME;2)AMPK抑制组,40 μmol·L-1Compound C;3)Control组,0.86% NaCl(生理盐水)。其中,L-NAME主要作用于NOS,可以减少机体内NO产生;Compound C作为AMPK抑制剂,可以有效抑制AMPK活性。本试验首先通过L-NAME组与Control组中的NO含量对比,确定L-NAME是否可以改变肌肉中NO含量,再通过L-NAME组、Compound C组和Control组的对比,确定NO通过AMPK对肌肉中蛋白特性和肉品质的影响。为加速处理液渗透至样品中,用20 G针均匀穿刺肉样。肉样与处理液浸泡比例为1∶1(g∶mL),在4℃条件下于保鲜盒中浸泡12 h后取出,用滤纸吸取表面水分,然后于4℃条件下成熟,分别在成熟时间点0、6、12、24、48、72、120 h取出肉样进行测定。对于不便立即测定的指标,将肉样存放在-80℃超低温冰箱待用。每个指标的测定至少重复3次。
1.3.2 NO含量测定 取肉样1.0 g左右,放入50 mL离心管中,按1∶9(g∶mL)加入匀浆介质(0.86%生理盐水),10 000 r·min-1匀浆多次。在4℃、4 000 r·min-1条件下离心10~15 min,弃沉淀取上清液在550 nm波长下,用酶标仪测定各孔吸光度值。具体操作步骤和计算公式参照一氧化氮(NO)测定试剂盒(货号:A013-2-1,南京建成生物工程研究所)说明书进行。
1.3.3 AMPK活性测定 参考Underwood等[15]的方法。取肉样0.6 g左右于10 mL离心管中,1∶5(g∶mL) 加入匀浆液冰浴匀浆,4℃、12 000 r·min-1条件下离心5 min,取上清液在450 nm波长下,用酶标仪测定各孔吸光度值。具体操作步骤参照牛(Bovine)磷酸化腺苷酸活化蛋白激酶(AMPK)ELISA检测试剂盒(上海远慕生物科技有限公司)说明书进行。
1.3.4 牛肉蛋白特性测定
1.3.4.1 蛋白溶解性的测定 肌浆蛋白质溶解性:参照Joo等[16]的方法测定。取1.0 g肉样置于50 mL离心管中,加入10 mL预冷的0.025 mol·L-1磷酸钾缓冲液(pH值7.2),冰浴条件下10 000 r·min-1匀浆30 s,匀浆多次,4℃下振荡抽提12 h。然后进行离心处理(1 500 r·min-1,4℃,20 min),取上清液用双缩脲法测定其蛋白含量。
总蛋白质溶解性:取1.0 g肉样置于50 mL离心管中,加入20 mL经预冷的0.1 mol·L-1磷酸钾缓冲液(pH值7.2),其中含有1.1 mol·L-1碘化钾,冰浴条件下10 000 r·min-1匀浆30 s,匀浆多次,低温状态下振荡抽提12 h。然后进行离心处理(1 500 r·min-1,4℃,20 min),用双缩脲法测定上清液中蛋白含量。
肌原纤维蛋白溶解性按以下公式计算:
肌原纤维蛋白溶解性=总蛋白溶解性-肌浆蛋白溶解性。
1.3.4.2 肌原纤维蛋白(myofibrillar protein,MP)提取 参考Xiong等[17]的方法并稍作修改。按照1∶10(m∶v)加入匀浆液(0.1 mol·L-1KCl,0.002 mol·L-1MgCl2和EGTA,20 mmol·L-1磷酸钾缓冲液,pH值6.8)匀浆,4℃、4 427 r·min-1离心15 min,取沉淀,重复上述步骤2次得到粗MP。用8倍体积缓冲液(0.1 mol·L-1KCl,2 mmol·L-1MgCl2和EGTA,20 mmol·L-1磷酸钾缓冲液,1% Triton-100,pH值6.8)洗2次,最后用多倍体积的100 mmol·L-1KCl洗2次得到较高纯度的MP。采用双缩脲法测定其蛋白浓度。
1.3.4.3 肌原纤维蛋白表面疏水性测定 参考文献[18]的方法。取2 mL 1 mg·mL-1蛋白溶液,加入40 μL 1 mg·mL-1溴酚蓝,振荡10 min,4℃、6 483 r·min-1离心15 min,取上清液稀释10倍,在595 nm处测定吸光度值。空白对照为2 mL(20 mmol·L-1,pH值6.8)磷酸钾缓冲液加入40 μL 1 mg·mL-1溴酚蓝溶液后测定的吸光度值(optical density,OD)。按照公式计算溴酚蓝结合量:
溴酚蓝结合量=40×(OD空白-OD样品)/OD样品。
1.3.4.4 凝胶保水性测定 根据李文博等[19]的方法并做修改,用(20 mmol·L-1,pH值6.8)磷酸钾缓冲液将蛋白浓度调至40 mg·mL-1,取该溶液5 mL装入平底离心管中,25℃水浴锅以 1℃·min-1升至70℃,然后保持20 min,取出冷却至室温,在4℃冰箱放置12 h,制得凝胶待用。取出制好的凝胶在室温下稳定30 min,称重为m1;随后4℃、5 000 r·min-1离心15 min,离心后称重为m2。按照公式计算凝胶保水性:
凝胶保水性=m2/m1×100%。
1.3.4.5 凝胶硬度测定 取上述制得的凝胶样品,在室温下稳定30 min,使用质构仪测定其硬度,单位为g,探头类型:P5;测前速度:1 mm·s-1;测中速度:0.5 mm·s-1;测后速度:0.5 mm·s-1。
1.3.5 差示扫描量热法(diferential scanning calorimetry,DSC)的测定 称取肉样2 mg左右,放入带盖铝坩埚中,平衡时间为2 min,以5℃·min-1从20℃升温至100℃。通过Pyris-12软件(Perkin-Elmer Instruments,美国)从热分析图计算变性焓(ΔH)和峰值温度(Tmax,以℃计)。
1.3.6 肉品质测定
1.3.6.1 蒸煮损失测定 参照王琳琳[20]的方法,称取肉样M1装入蒸煮袋内,置于80℃的恒温水浴锅中,肉样中心温度达到70℃时恒温30 min,取出肉样冷却至室温,测量样品质量M2。按照公式计算蒸煮损失率:
蒸煮损失率=(M1-M2)/M1×100%。
1.3.6.2 剪切力测定 取约50 g左右的肉样,放入蒸煮袋内置于80℃恒温水浴锅中,当肉样中心温度达到70℃时维持30 min,取出肉样放置冷却,用直径1.27 cm的取样器沿着肌纤维方向钻取肉柱,采用嫩度仪自带的“V”型剪切刀架测定。
1.3.7 苏木精-伊红(hematoxylin-eosin,HE)染色 参考文献[21]的方法,从4%多聚甲醛溶液中取出已固定好的牛肉组织,将肉样切成2.5 mm ×2.5 mm×3 mm,用酒精梯度脱水、石蜡包埋后切成5 μm的组织切片,固定于载玻片上。组织切片用苏木精-伊红染色4 min,二甲苯梯度溶液通透10 min,中性树胶封片。制备好的玻片在光学显微镜下观察,用Images Pro Plus 6.0测量肌纤维直径、间距和横截面积。每幅图平均选取不少于30个肌细胞[22]。
1.4 数据分析
上述各项指标至少重复3次。数据全部采用Microsoft Excel 2010软件计算平均值及标准误差,用SPSS 21.0软件进行Duncan’s差异显著性分析(P<0.05)使用Origin 9.0软件制图。
2 结果与分析
2.1 牛肉宰后NO含量变化
NO存在于肌肉组织内,参与调节机体生理活动。如图1所示,宰后NO含量呈下降趋势,6~72 h L-NAME组NO含量显著低于对照组,至120 h,两组NO含量无显著差异,但L-NAME组NO含量仍较对照组低8.21%。由此可见,L-NAME作为NOS的抑制剂,降低了NOS活性,并减少了牛肉宰后成熟过程中的NO含量。

注:不同大写字母表示同一成熟时间下不同处理间差异显著(P<0.05); 不同小写字母表示同一处理下不同成熟时间之间差异显著(P<0.05)。下同。Note: Different capital letters indicate significant differences between different treatments at the same maturity time at 0.05 level. Different lowercase letters indicate significant differences at different times under the same treatment at 0.05 level. The same as following.图1 宰后成熟过程中NO含量的变化Fig.1 Changes in NO content during post-mortem maturation
2.2 牛肉宰后AMPK活性变化
AMPK是细胞内能量平衡的重要感受器与调节器。如图2所示,3个试验处理组中AMPK活性均随着成熟时间延长先增大后减小,均在6 h达到最大值,此时L-NAME组和Compound C组中AMPK活性分别较对照组降低14.78%和26.75%。0~72 h Compound C组中AMPK活性显著低于L-NAME组和对照组,说明L-NAME处理和Compound C处理可有效抑制AMPK活性,进一步表明牛肉宰后NO可以提高AMPK活性。

图2 牛肉成熟过程中AMPK活性变化Fig.2 Changes of AMPK activity during bovines postmortem aging
2.3 牛肉宰后pH值变化
宰后pH值的变化对肉品质起着重要作用,最终影响肉的嫩度和保水性。如图3所示,宰后成熟过程中牛肉pH值呈先减小后增大的趋势。成熟至72 h,L-NAME组、Compound C组和对照组中pH值分别比0 h降低了14.98%、13.03%和15.40%,其中对照组的pH下降幅度最大。L-NAME组中pH值在6~12 h显著高于对照组,Compound C组中pH值在6~120 h显著高于对照组。同时,Compound C组pH值在12、72 h显著高于L-NAME组。以上结果说明,NO可以通过提高AMPK活性促进糖酵解,进而促进pH值的下降。
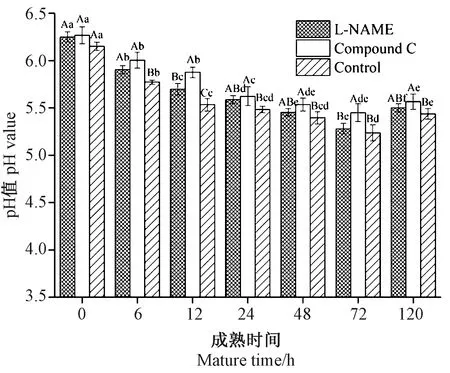
图3 牛肉成熟过程中pH变化Fig.3 Changes of pH during bovines postmortem aging
2.4 牛肉宰后蛋白特性变化
2.4.1 蛋白溶解度变化 如图4-A所示,L-NAME组和对照组中总蛋白溶解性在0~120 h先下降后上升,Compound C组在6~120 h先下降后上升。0~120 h,L-NAME组和Compound C组中总蛋白溶解性显著高于对照组(P<0.05),同时L-NAME组在6、24 h显著低于Compound C组。如图4-B所示,随着宰后成熟时间延长,肌原纤维蛋白溶解性先减小后增大,L-NAME组和Compound C组中的肌原纤维蛋白溶解性分别在6、72 h和6、24、72、120 h显著高于对照组。如图4-C所示,随着宰后成熟时间延长,3个处理组中肌浆蛋白溶解性呈先增大后减小的趋势,0~120 h L-NAME组和Compound C组显著高于对照组,Compound C组在6~24 h、72~120 h显著高于L-NAME组。以上结果表明,NO可以通过增加AMPK活性而降低牛肉蛋白溶解度。

图4 牛肉成熟过程中蛋白溶解性变化Fig.4 Changes of protein solubility during bovines postmortem aging
2.4.2 MP表面疏水性指数 蛋白表面疏水性指数越低,其结合水能力越强[23]。如图5所示,MP表面疏水性指数先增大后减小。L-NAME组和Compound C组中MP表面疏水性指数分别在12、48 h和12~120 h显著低于对照组(P<0.05)。3个处理中对照组MP表面疏水性指数最大,其次是L-NAME组,Compound C组最小,这可能是因为加入L-NAME和Compound C抑制了糖酵解速率,pH值下降速率降低,使得pH值偏离蛋白等电点,溶解性较好,而溶解性与表面疏水性负相关,因此对照组疏水性最大。由此说明宰后NO可通过提高AMPK活性促进糖酵解过程,进而促使pH值降低,最终使得MP表面疏水性增大。

图5 牛肉成熟过程中MP表面疏水性变化Fig.5 Changes of surface hydrophobicity index during bovines postmortem aging

图6 牛肉成熟过程中肌原纤维蛋白凝胶特性变化Fig.6 Changes of myofibrillar protein gel properties during beef maturation
2.4.3 凝胶特性变化 蛋白质凝胶特性也是影响肉品加工的因素之一[24]。如图6-A所示,随着宰后成熟时间延长,蛋白凝胶保水性呈先减小后增大的趋势,在72 h降至最小值。L-NAME组中凝胶保水性在24~72 h显著高于对照组,Compound C组在24~120 h显著高于对照组,同时,Compound C组在72 h显著高于L-NAME组。如图6-B所示,3个处理组中蛋白凝胶硬度均在72 h达到最大值后下降。其中,Compound C组在6~120 h和12~120 h分别显著高于对照组和L-NAME组(P<0.05)。综上,与L-NAME组和Compound C组比较,对照组降低了蛋白凝胶保水性和硬度,进而说明NO通过AMPK降低了蛋白凝胶保水性和硬度。
2.5 牛肉宰后DSC变化分析
DSC热相图中,峰面积可以反映蛋白质的变性程度。图谱中存在2个峰:峰Ⅰ和峰Ⅱ,分别代表肌球蛋白尾部和肌浆蛋白以及肌动蛋白变性引起的热流变化[25]。由图7可知,3个处理组中牛肌肉蛋白的DSC热流曲线分析均出现了吸热峰,峰Ⅰ不明显,峰Ⅱ明显。表1中三组峰Ⅱ对应的温度大小为Compound C组>L-NAME组>对照组。峰Ⅰ中Compound C组变性焓值在48 h显著大于L-NAME组,在48~72 h显著大于对照组(P<0.05);峰Ⅱ中Compound C组变性焓值在48~120 h显著大于L-NAME组,在12~120 h显著大于对照组(P<0.05)。与L-NAME组相比,对照组中蛋白质发生了轻微变性,而与Compound C组比较,对照组发生了严重变性。NO通过提高AMPK活性促进宰后糖酵解过程,使得pH值降低,而pH值的下降会降低肌球蛋白的变性温度点,降低其热稳定性,说明pH值越接近肌原纤维蛋白等电点,肌球蛋白热稳定性越差[26]。因此说明,NO可通过提高AMPK活性促进糖酵解过程,促使pH值下降接近蛋白等电点,降低牛肉蛋白热稳定性。

表 1 宰后牛肉蛋白变性温度与变性焓值的变化Table 1 Changes in denaturation temperatures (Tmax) and denaturation enthalpy (ΔH) of muscle proteins during postmortem aging

注:A:L-NAME组;B:Compound C组;C:Control组。Note: A: L-NAME group. B: Compound C group. C: Control group.图7 不同处理组中牛肉蛋白DSC图Fig.7 DSC chart of beef protein in different treatment groups
2.6 牛肉品质变化
2.6.1 剪切力变化 如图8所示,随着宰后成熟时间延长,剪切力呈先增大后减小的趋势。在24~48 h L-NAME组显著高于对照组,12~120 h Compound C组显著高于对照组,12、48、72 h Compound C组显著高于L-NAME组(P<0.05)。肌肉中的重要蛋白随着pH值的下降达到等电点而沉降,肌肉收缩硬化,水分流失增加,嫩度变差,此时肉样剪切力增大。与L-NAME组和Compound C组相比,对照组中牛肉剪切力降低。可见,NO可通过提高AMPK活性促进糖酵解使得pH值下降,进而降低牛肉剪切力值,改善其嫩度。

图8 牛肉成熟过程中剪切力变化Fig.8 Changes of shear force during bovines postmortem aging
2.6.2 蒸煮损失变化 如图9所示,3个处理组中牛肉蒸煮损失先增大后减小,72 h最大。L-NAME组在12~24 h显著低于对照组(P<0.05),Compound C组分别在12~24 h和12、24、72 h显著低于对照组和L-NAME 组(P<0.05)。牛肉宰后pH值下降接近蛋白等电点,因此蛋白质之间相互吸引,从而对水分吸引减小,导致蛋白溶解度下降,造成肌肉水分流失[27]。一些储存水分的蛋白质也会因为pH值的降低发生变性,肌纤维间的间隙增大也会引起水分流失[28]。以上结果表明,NO可通过提高AMPK活性促进糖酵解使得pH值下降,进而增大牛肉蒸煮损失。

图9 牛肉成熟过程中蒸煮损失变化Fig.9 Changes of cooking loss during bovines postmortem aging
2.7 组织学结构变化
肌肉的肌纤维结构与其保水性和嫩度有着密切联系,随着成熟时间延长,肌纤维的结构被破坏,造成肌肉水分流失,肉质松软等问题。组织结构图像结果如图10所示,肌纤维的横截面面积呈逐渐缩小的状态,而肌纤维之间的距离逐渐增大。与对照组中肌纤维的分布状态相比,L-NAME组和Compound C组的肌纤维排列较紧密。同时,随着成熟时间延长,3个处理组中细胞边缘光滑性逐渐减弱,成熟至120 h,肌纤维横截面积和直径最小,肌纤维的离散程度最大,间距也最大。

注:A、B、C分别代表L-NAME组、Compound C组、Control组,0、6、12、24、48、72、120分别代表成熟0、6、12、24、48、72、120 h的组织学形态。Note: A, B, C represent the L-NAME group, Compound C group, and Control group, respectively. 0, 6, 12, 24, 48, 72, 120 represent mature histological morphology at 0, 6, 12, 24, 48, 72, 120 h.图10 肌细胞横切HE染色成像结果Fig.10 HE staining imaging results of cross-section of muscle cells
由表2可知,随着宰后成熟时间的延长,肌细胞的横截面积和直径呈下降趋势,而肌细胞之间的间隙逐渐增大。L-NAME组肌细胞间隙在6、24~120 h显著小于对照组,Compound C组在6~120 h和12~72 h分别显著小于对照组和L-NAME组。总体上,对照组的肌细胞平均横截面积和直径小于L-NAME组和Compound C组,同时,L-NAME组肌细胞横截面积小于Compound C组。成熟至120 h,3个处理组肌纤维间的分隔进一步加强。结合3个处理组肉样中剪切力和蒸煮损失的变化得出,NO通过提高AMPK活性促进糖酵解促使pH值降低,最终改善了牛肉嫩度,但其保水性变差。

表2 成熟过程中肌细胞面积及间距的变化Table 2 Changes in cross-sectional area and spacing of muscle cells during maturation
3 讨论
NO作为骨骼肌稳态的重要调节剂,通过代谢途径影响肉质。本试验中采用L-NAME处理宰后牛肉,显著降低了牛肉中的NO含量,这与Cottrell等[29]的研究结果一致。AMPK作为细胞内能量平衡的调节器,影响着宰后肌肉代谢过程。为探究NO是否通过AMPK影响牛肉的蛋白特性和肉品质,将L-NAME和Compound C处理的肉样与对照组肉样进行比较,结果显示,随成熟时间延长,3个处理组中AMPK活性先增大后减小,AMPK活性在0~24 h时对照组显著高于L-NAME组、在0~72 h L-NAME组显著高于Compound C组,说明宰后成熟过程中NO提高了AMPK活性。与前人研究结果[30-31]类似,Higaki等[30]报道NO供体可诱导大鼠肌肉中α1-AMPK的磷酸化和激活;Lira等[31]报道,在大鼠体内和体外试验中,NOS和AMPK之间存在正反馈作用。宰后肌肉中AMPK促进糖酵解过程,促使pH值降低,本试验中,pH值随成熟时间的延长先增大后减小,对照组中pH值整体低于L-NAME组、L-NAME组中pH值整体低于Compound C组,说明NO通过AMPK促进糖原分解,使得宰后牛肉糖原含量降低,乳酸含量升高,pH值下降。
肌肉中蛋白质处于高度溶解状态时才能够表现出肌肉蛋白的功能特性。蛋白溶解度作为评价蛋白质变性程度的重要指标之一,是其发挥功能特性的前提[32]。蛋白溶解度受pH值的影响,当pH值偏离等电点时,蛋白具可溶性;当pH值接近等电点时,蛋白产生沉淀,溶解性变差。本试验结果中,随着宰后成熟时间延长,牛肉pH值在48~72 h附近接近等电点,此时蛋白溶解性表现出较低水平,这与惠小洋[22]研究中牛肉蛋白溶解性变化结果一致。对照组中pH值随成熟时间延长下降较快,接近等电点,而Compound C组中pH值下降速率最慢,因此本试验中Compound C组蛋白溶解性最大,对照组最小。蛋白疏水作用对肉品质的影响是间接的[33]。本试验中,3个处理组中随成熟时间延长,MP表面疏水性先增大后减小,可能是肌肉解僵成熟时MP的溶解性增加和肌肉疏水性基团减少的结果[34],这与郭兆斌等[33]的结果一致。有研究表明,蛋白溶解度与凝胶保水性呈正相关性[35],分析本试验中凝胶保水性和凝胶硬度变化趋势的原因,可能是0~72 h时总蛋白质溶解度下降、疏水性升高,导致凝胶保水性下降、硬度提高;而在120 h总蛋白溶解度回升、疏水性下降,改善了凝胶保水性和硬度。牛克兰等[36]提出,当pH值在蛋白等电点附近时,凝胶保水性降低,硬度减小;当pH值偏离蛋白等电点时,分子间净电荷增加,为水分子提供了更多的氢键结合位点,增大水合作用表面积,使凝胶保水性提高[27,37]。因此,推测本试验3个处理组中凝胶保水性和硬度的差异是由不同pH值造成的[35]。NO通过提高AMPK活性加速糖酵解,从而促进肌纤维结构破坏及牛肉宰后成熟,因此,对照组蛋白结构破坏最严重,热稳定性最差;Compound C组蛋白最不容易被破坏,热稳定性最好。
嫩度和保水性也是判断肉品质的重要指标。剪切力值的结果显示,与L-NAME组相比,对照组的牛肉剪切力值减小,说明NO会降低牛肉的剪切力值,这与Cook等[38]研究结果一致。肌肉嫩度与组织结构(肌纤维密度、肌纤维直径、肌纤维面积)也有紧密关系[39],本试验中,牛肉肌细胞的直径和横截面积表现为Compound C处理>L-NAME处理>对照组。已有研究表明,骨骼肌纤维细胞的直径和面积越大,肉的嫩度越差[40],本研究结果与之一致。宰后牛肉成熟过程中,低pH值会导致一些储存水分的肌原纤维蛋白发生变性,破坏维持水分空间的稳定结构[41],从而影响肌肉的持水性。蒸煮损失的结果显示,Compound C处理的牛肉蒸煮损失小于L-NAME处理,L-NAME处理的牛肉蒸煮损失小于对照组,分析原因是成熟过程中牛肉pH值先减小后增大,对照组pH值降低首先达到蛋白等电点,而Compound C处理的牛肉pH值最后降低到等电点,肌肉中的水分流失会在pH值接近等电点时最大[42]。已有研究表明,牛肉pH值下降速率越快,蒸煮损失越严重[43],这与本试验结果一致。综上所述,对照组牛肉嫩度最好,而保水性最差。
4 结论
本研究结果表明,L-NAME能够抑制NOS活性,减少体内NO的产生,Compound C能有效抑制AMPK活性。相比L-NAME和Compound C处理,经生理盐水处理后的牛肉蛋白溶解性、凝胶保水性和硬度、对热稳定性均降低,蛋白表面疏水性增大;同时牛肉蒸煮损失增大,剪切力减小。因此,宰后成熟过程中,NO-AMPK通路降低牛肉蛋白溶解性,促进蛋白质变性,进而使得肉品保水性变差,但是其嫩度有所改善。综上所述,NO-AMPK作为影响宰后牛肉蛋白特性和肉质的一个重要调控途径,对未来牛肉成熟过程中肉品质的改善研究具有一定借鉴作用。
