高产、抗病同源四倍体不结球白菜黄心乌新材料的创制
2022-06-30张昌伟侯喜林王建军刘照坤刘同坤
宋 莹 张 咪 张昌伟 李 英 侯喜林 王建军 刘照坤 刘同坤,*
(1 南京农业大学作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室/园艺作物种质创新与利用教育部工程研究中心/南京苏曼等离子工程研究院,江苏 南京 210095;2 苏州市农业科学院,江苏 苏州 215000)
不结球白菜黄心乌又称乌塌菜,属十字花科芸薹属芸薹种白菜亚种的一个变种,叶面皱缩,植株耐寒,盛产于淮南地区,但其株型塌地、易感病等问题阻碍了新品种的选育,因此培育高产、抗病的黄心乌新种质对不结球白菜育种具有重要意义。
基于多倍体植株表现出植株膨大、抗逆性增强等特点,多倍体育种已成为培育新种质的关键技术之一。该技术目前已取得很大进步,如利用多倍体茶树“巨大性”增强茶树光合作用,促进植株生长以及内含物积累[1];四倍体西瓜较二倍体对枯萎病表现为发病时间延迟、症状减轻,具有明显抗病优势[2];利用秋水仙素诱导技术,选育出高产、抗病的晚抽薹不结球白菜新材料,为进一步选育奠定基础[3];不结球白菜超华一号经诱导、继代选择后,培育出市场前景广阔、性状优良、整齐度高的新品种[4];在不结球白菜华凤育种工作中发现,诱导多倍体能有效地缩短育种年限并筛选出结实率高、花期长、营养品质高的新材料[5]。此外,目前市场上销售的不结球白菜黄心乌品种多数为二倍体,鲜见四倍体品种。因此,本研究采用秋水仙素诱导幼苗生长点的方法,以高产、抗病等性状为目标开展同源四倍体不结球白菜黄心乌诱导工作,培育高产、抗病不结球白菜黄心乌新品种,旨在为不结球白菜育种提供新的种质资源。
1 材料与方法
1.1 试验材料
本试验所需材料不结球白菜二倍体黄心乌(2n=2x=20)由南京农业大学园艺学院白菜系统生物学实验室提供。试验于2019年9月—2021年5月在江苏句容农博园试验基地进行。
1.2 四倍体不结球白菜诱导方法
用0.2%(w/v)秋水仙素溶液以点滴的方式处理二倍体子叶生长点,以点滴蒸馏水为对照(CK),每天分别于9:00和17:00各处理1次,共计处理5 d[6]。
1.3 多倍体的鉴定方法
1.3.1 形态解剖学鉴定 生长期、开花期分别观察诱变植株与二倍体植株叶片、株型、花器官等并比较形态学特征,依据多倍体植株多具有巨大性筛选出疑似植株。对疑似植株解剖学鉴定,主要以气孔和花粉粒作为主要依据[7]。气孔鉴定:选取疑似四倍体植株的平展且生长良好的叶片,避开叶脉,用镊子或强力胶带撕取叶片下表皮,并用平头镊刮去多余叶肉,在正置荧光显微镜(DM6B,Leica,瑞士)下观察和拍照;花粉粒鉴定:以二倍体花粉粒作为对照,在显微镜下观察二倍体与疑似四倍体花粉粒大小及形状的差异。
1.3.2 细胞学鉴定 收取经形态解剖学鉴定过植株的种子于培养皿中在25℃培养箱内催芽,待根长1~2 cm时,切去子叶,将根放在盛有蒸馏水的1.5 mL离心管中,放置在4℃冰箱预处理24 h;用卡诺[v(无水乙醇) ∶v(冰乙酸)=3∶1]固定7~9 h后,蒸馏水洗净,以去除多余的卡诺;然后用1 mol·L-1的盐酸在60℃下解离3~5 min,切取1~2 mm根尖,改良卡宝品红染液染色7 min后,制成临时玻片,在正置荧光显微镜下观察并拍照。
1.3.3 流式细胞仪倍性分析 从黄心乌疑似植株上取0.1 g新鲜幼嫩叶片放置于预冷的玻璃培养皿中,加入1 mL解离液[200 mmol·L-1Tris+4 mmol·L-1MgCl2·6H2O+0.5% (v/v) TritonX-100,pH值7.5],并用冰上预冷过的刀片快速切碎。将切碎后材料使用50 μm过滤网过滤至1.5 mL离心管中,置于冰上10~15 min,离心5 min(4℃、1 000 r·min-1),弃上清。重复上述步骤3~5次,直至沉淀由绿色变为白色。加入染色液(0.5 mL Tris-MgCl2+10 μL RNase+7 μL碘化丙啶)混合均匀,4℃避光放置15 min后取混合液上机检测细胞DNA含量。
1.4 二、四倍体黄心乌的农艺性状统计及营养品质测定
1.4.1 农艺性状测定 将被鉴定为黄心乌同源四倍体的M0代植株蕾期及开花期自交并套袋,单株收种。将M1代种子与其二倍体种子同期播种与定植。随机选取生长健壮、无病虫害的二、四倍体黄心乌各10株,对其株高、十叶厚、全株叶数、叶长、叶宽、叶柄长、叶柄宽、叶柄厚等农艺性状进行统计。
1.4.2 营养品质测定 随机选取二、四倍体黄心乌各3株,取各植株同一部位叶片测定可溶性糖、可溶性蛋白、纤维素、有机酸、叶绿素、硝态氮等营养品质指标。
可溶性糖和纤维素含量分别使用MB-C-B602植物可溶性糖含量测试盒(广州迈博生物),CLL-2-Y纤维素含量测试盒(苏州科铭生物)测定。
1.4.3 可溶性蛋白含量测定 取植物组织0.2~0.3 g于预冷研钵中,加4 mL预冷的磷酸缓冲液在冰浴上研磨至匀浆,离心15 min(4℃、10 000 r·min-1),上清液即为蛋白粗提液;取上述蛋白质粗提液0.1 mL于试管中并加入3 mL考马斯亮蓝G-250蛋白试剂,混匀,室温静置2 min,以空白为对照,测定595 mm处的吸光值(OD595);以蛋白质浓度为横坐标,吸光度值为纵坐标绘制标准曲线,根据上述曲线计算相应可溶性蛋白含量,每组取3次重复。
1.4.4 有机酸含量测定 称取植物叶片5~10 g于研钵中研磨至匀浆,用蒸馏水洗入250 mL三角瓶中,体积约100 mL。于80℃恒温水浴中浸提30 min并不断搅拌。取出,待冷却后过滤,蒸馏水冲洗残渣2~3次,合并滤液,用蒸馏水定容至100 mL,混匀备用。取稀释后的滤液20 mL,加酚酞指示剂2~3滴,用0.1 mol·L-1氢氧化钠标准液滴定至瓶中溶液由无色变为浅红色且保持30 s颜色不变。记录滴定使用的氢氧化钠标准液的体积V1,同时用水做空白试验,记录消耗标准滴定溶液的体积V2。按照公式计算有机酸含量:
有机酸含量=(V1-V2)×C×0.067/m
式中,V1为氢氧化钠标准溶液的滴定体积,mL;V2为空白试验氢氧化钠标准溶液的滴定体积,mL;C为氢氧化钠标准滴定溶液的浓度,mol·L-1;m为样品取样量,g。
1.4.5 叶绿素含量测定 用剪刀将新鲜待测叶片剪碎,以增加萃取面积,取0.2 g放入研钵中,加入提取缓冲液(丙酮∶乙醇∶蒸馏水=4.5∶4.5∶1),放置在4℃避光条件下24 h至样品变白,充分浸提后过滤,取提取液在649 nm波长下测定吸光度值,进行3次重复。根据Chl=27.9×A649计算叶绿素含量。
硝态氮含量测定:称取植物组织2~3 g于试管中,研磨至匀浆,加入10 mL无离子水并用封口膜封口,置于沸水浴中30 min,冷却至室温,将提取液反复过滤至25 mL容量瓶中,定容;取样品液0.1 mL,加入0.4 mL 5%水杨酸-硫酸溶液,混匀后室温下静置20 min,缓慢加入9.5 mL 8%NaOH溶液,冷却至室温,以空白做参比,测定OD410,以硝态氮浓度为横坐标,以吸光度为纵坐标建立标准曲线,由回归方程计算硝态氮含量。
1.5 二、四倍体黄心乌光合特性分析
在光照条件良好的晴天,采用Li6400XT便携式光合仪(北京力高泰科技有限公司)测定光合响应曲线,使用CO2注入系统控制CO2S的浓度为400 μmol·mol-1, 设定光照强度梯度为0、20、50、100、150、250、500、750、1 000、1 200、1 500 μmol·m-2·s-1,每个梯度之间设定等待时间120~200 s,测定单位面积的净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、气孔导度(stomatal conductance,Gs)、胞间 CO2浓度(intercellular CO2concentration,Ci),二、四倍体各随机选取3株并取同一部位作为重复。数据处理后根据非直角双曲线模型拟合光响应曲线,进一步求得光饱和点(light saturation point,LSP)、光补偿点(light compensation point,LCP)、最大净光合速率(maximum net photosynthetic rate,Pmax)、表观量子效率(apparent quantum yield of photosynthesis,AQY)、暗呼吸速率(dark respiration rate,Rd)等光合指标。
1.6 二、四倍体黄心乌抗病测定
1.6.1 灰霉菌小孢子悬浮液的制备及侵染 将灰霉菌接种至36% V8果汁、2%琼脂、0.2% CaCO3配制成V8固体培养基中继代培养,接种后的培养皿放置在恒温避光条件下培养一周左右,待培养皿内长满孢子后,在无菌条件下将菌丝用组培刀刮出并置于1%蛋白胨、4%麦芽糖配制成的重悬液中,震荡30 min,使菌丝中孢子完全释放,使用血球计数板在光学显微镜下计数,并用重悬液调节孢子浓度为1×107个·mL-1。活体接种叶片时,将含孢子的悬浮液点滴在叶片上,每次约20 μL,在植株上方加透明罩子以增加湿度,提高侵染效率,12 h/12 h 光暗交替、光强300 μmol·m-2·s-1、 25℃恒温的培养箱中培养3 d ,观察叶片发病情况。接种3~4 d后,以二倍体黄心乌为对照组,四倍体黄心乌为试验组,取对照组和试验组叶片病斑半径1 cm内的健康组织, -80℃ 条件下备用。每个处理设置3次重复。
1.6.2 总RNA的提取、纯化和cDNA的合成 取 0.1 g 样品于液氮中用磨样机研磨,用植物总RNA提取试剂盒(北京天根生化科技有限公司)提取RNA。按照PrimeScriptTM RT reagent Kit 反转录试剂盒说明书(TaKaRa,日本)进行反转录。
1.6.3 实时荧光定量PCR反应体系和反应程序 使用上海翊圣生物科技有限公司Hieff qPCR SYBR Green Master mix(High Rox Plus)试剂盒进行实时荧光定量PCR(quantitative real-time PCR qRT-PCR)反应,反应体系为20 μL:SYBRPremixExTaq10 μL,cDNA(100 ng·μL-1) 1 μL,正、反引物(10 μmol·L-1)各1 μL,ddH2O 7 μL。反应程序:95℃预变性 5 min;95℃、72℃变性10 s,60℃退火20 s,72℃延伸20 s,40个循环;72℃终延伸10 min。每组设置3次重复。所得数据利用2-ΔΔCT进行分析[6],检测灰霉菌Botrytiscinereaactin基因在不结球白菜中的表达水平,以不结球白菜基因actin作为内参基因(表1)。
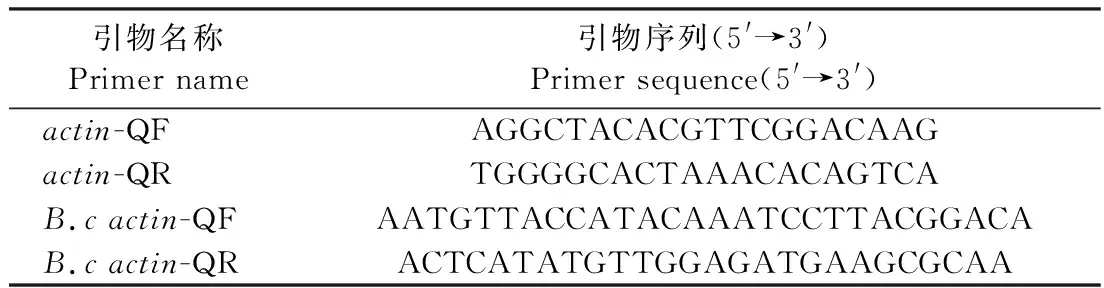
表1 实时荧光定量PCR引物设计Table 1 Primers for qRT-PCR
1.7 数据分析
利用Excel 2019进行数据整理,采用SPSS 26软件进行数据分析。
2 结果与分析
2.1 黄心乌的倍性鉴定
2.1.1 形态学与解剖学鉴定 由图1可知,与二倍体黄心乌相比,其同源四倍体植株粗壮,开展度增加(图1-A);叶长、叶宽,叶柄长、宽增大,且叶片颜色加深,皱缩程度加深(图1-B);花器官膨大,其各个组成部分具有同样趋势(图1-C、D);种子大小无明显差异(图1-E);种荚膨大,但荚内种子数量变少(图1-F);与二倍体形状规则的花粉相比,四倍体花粉膨大至形状不规则的棒状或橄榄形(图1-G、H);显微镜下观察四倍体与二倍体相比,气孔孔径变大,单位面积气孔密度变小(图1-I、J)。
注:A:植株;B:叶片;C:花;D:花器官;E:种子;F:种荚;G、H:花粉粒;I、J:气孔。Note: A: Plant. B: Leaf. C: Flower. D: Floral organ. E: Seed. F: Silique. G、H: Pollen. I、J: Stomata.图1 二倍体(2x)、四倍体(4x)不结球白菜形态比较Fig.1 Comparison of tetraploid (4x) and diploid (2x) plants of non-heading Chinese cabbage
2.1.2 细胞学鉴定 将经形态学鉴定,判定疑似为四倍体的种子进行催芽,做切片染色处理后,在显微镜下观察根尖染色体数,如图2所示。与对照组二倍体染色体数2n=2x=20条相比,疑似植株的染色体数为2n=4x=40,说明本试验成功诱导出黄心乌的同源四倍体,收获种子。

图2 二倍体(2x)、四倍体(4x)不结球白菜细胞学鉴定结果Fig.2 The cytological identification of diploid (2x) and tetraploid (4x) non-heading Chinese cabbage
2.1.3 流式细胞仪鉴定 通过流式细胞仪检测二、四倍体植株细胞内的DNA含量,如图3所示。二、四倍体细胞核内的DNA相对含量峰值分别在50及100处,四倍体荧光值约为二倍体植株的2倍,即四倍体内细胞DNA含量为二倍体的2倍,能够验证本试验中诱导的植株为同源四倍体。
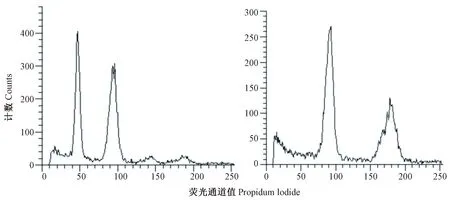
图3 二倍体(左)、四倍体(右)不结球白菜流式细胞仪鉴定结果Fig.3 Identification results of diploid (left) and tetraploid (right) non-heading Chinese cabbage by flow cytometry
2.2 二、四倍体黄心乌农艺性状比较
由表2可知,同源四倍体较二倍体株高增加1.29%,差异不显著;开展度增加30.21%,差异显著;叶长、叶宽、叶数以及十叶厚分别降低1.20%、12.70%、5.63%、11.28%,差异不显著;叶柄长、叶柄宽分别增加28.73%、38.37%,差异极显著;叶柄厚增加21.49%,差异显著。
2.3 二、四倍体黄心乌营养品质比较
由表3可知,同源四倍体与二倍体相比,可溶性糖含量降低0.43%,差异不显著;可溶性蛋白含量增加2.74%,差异不显著;纤维素、有机酸含量分别显著增加42.03%、15.13%;叶绿素含量显著降低2.00%;硝态氮含量极显著降低49.40%。
表2 二、四倍体植株主要农艺学性状比较Table 2 Comparison of main agronomic traits of diploid and tetraploid plants
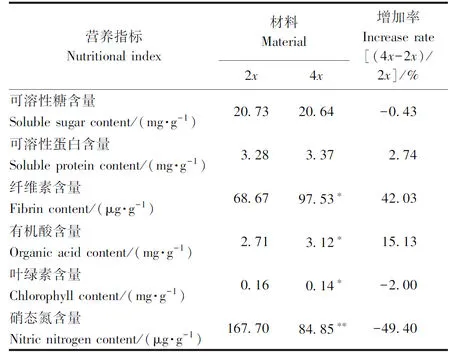
表3 二、四倍体植株主要营养品质比较Table 3 Comparison of content of nutritional substance between diploid and tetraploid non-heading Chinese cabbage

表4 二、四倍体的光响应曲线参数比较Table 4 Comparison of the parameters of response curves of diploid and tetraploid
2.4 二、四倍体黄心乌的光合特性分析
叶片光合速率反映作物代谢强弱,影响作物体内干物质积累。如图4-A光合响应曲线所示,随着光强的变化,二、四倍体净光合速率的变化趋势一致,均保持上升趋势。当光强为0~200 μmol·m-2·s-1时,二、四倍体净光合速率无明显差异;光强高于200 μmol·m-2·s-1,四倍体光合速率明显高于二倍体;当光强达到1 200 μmol·m-2·s-1左右时,二者分别达到饱和光强,净光合速率均达到最大值。表明强光下四倍体黄心乌表现出较高的净光合速率。
气孔导度作为衡量气孔开放程度的标准,是影响植物光合作用、呼吸作用及蒸腾作用的重要因素。如图4-B所示,随着光强增加,二倍体气孔导度的增长趋势变化较为平缓,而四倍体的气孔导度明显呈逐渐增加趋势。四倍体的气孔导度比二倍体强,这与2.1.1得到的二、四倍体气孔孔径变大的结果相一致。
图4-C表明,随着光强增加,二、四倍体的胞间CO2浓度均呈下降趋势,且变化趋势基本一致。具体表现为四倍体的胞间CO2浓度略低于二倍体。
图4-D表明,随着光强增加,二、四倍体单位时间单位叶面积的蒸腾速率平缓增加且保持相同趋势。相同光强下,四倍体的蒸腾速率明显高于二倍体,这与气孔导度的变化趋势大致相同。
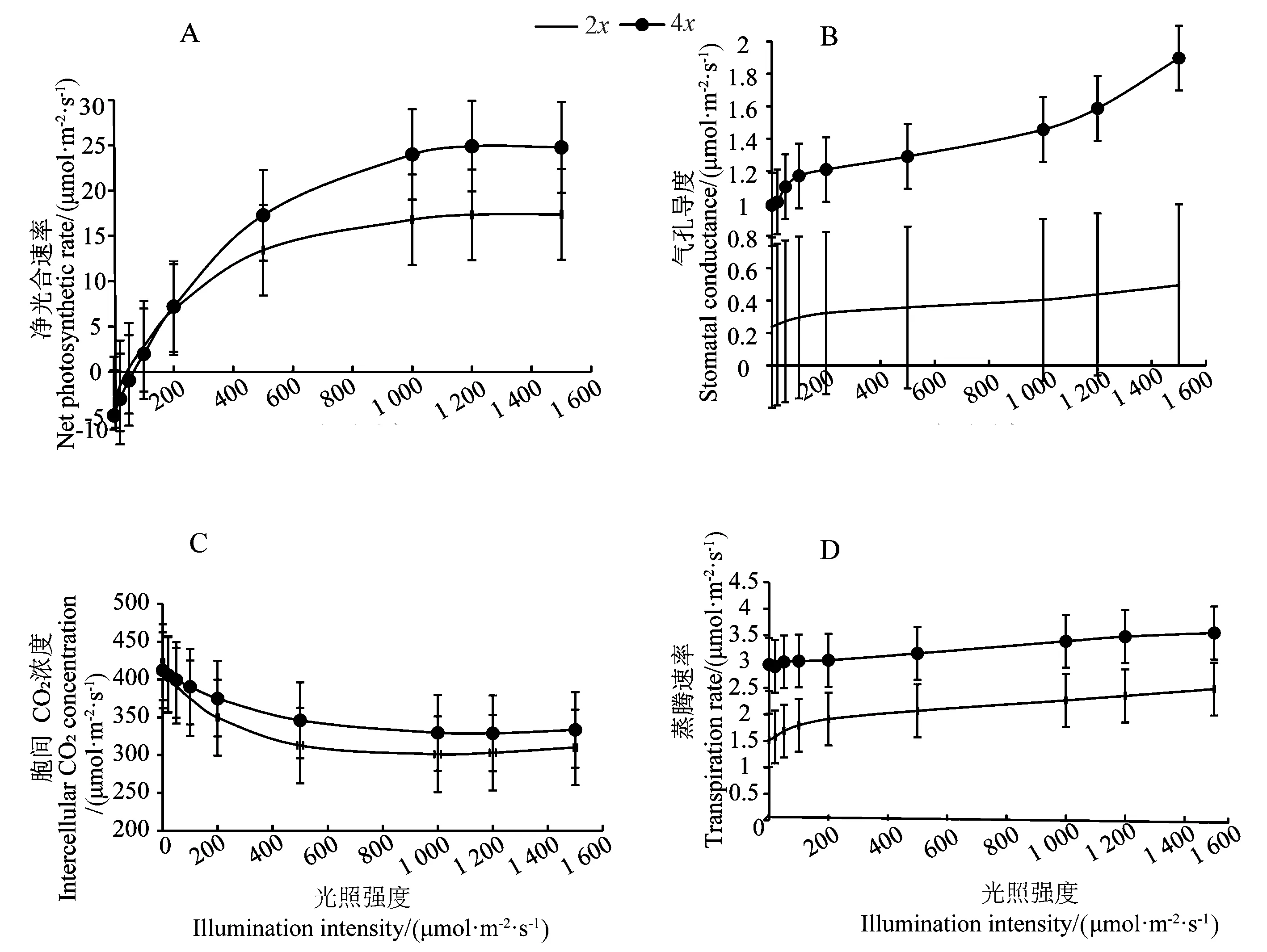
图4 光照强度对光合特性的影响Fig.4 Effects of illumination intensity on photosynthetic characteristics
由表4可知,相较二倍体,四倍体的LSP、LCP、Rd分别显著增加34.09%、75.64%、35.41%;Pmax增加1.24%,无显著差异;AQY显著减少23.58%。
2.5 二、四倍体黄心乌灰霉菌抗性比较
为了比较二、四倍体植株的抗病性,使用灰霉菌侵染二、四倍体植株叶片,结果表明(图5),二者均能被灰霉菌侵染,但较二倍体,同源四倍体叶片灰霉菌量显著降低60.59%,表明诱导后的同源四倍体的抗病性更强。
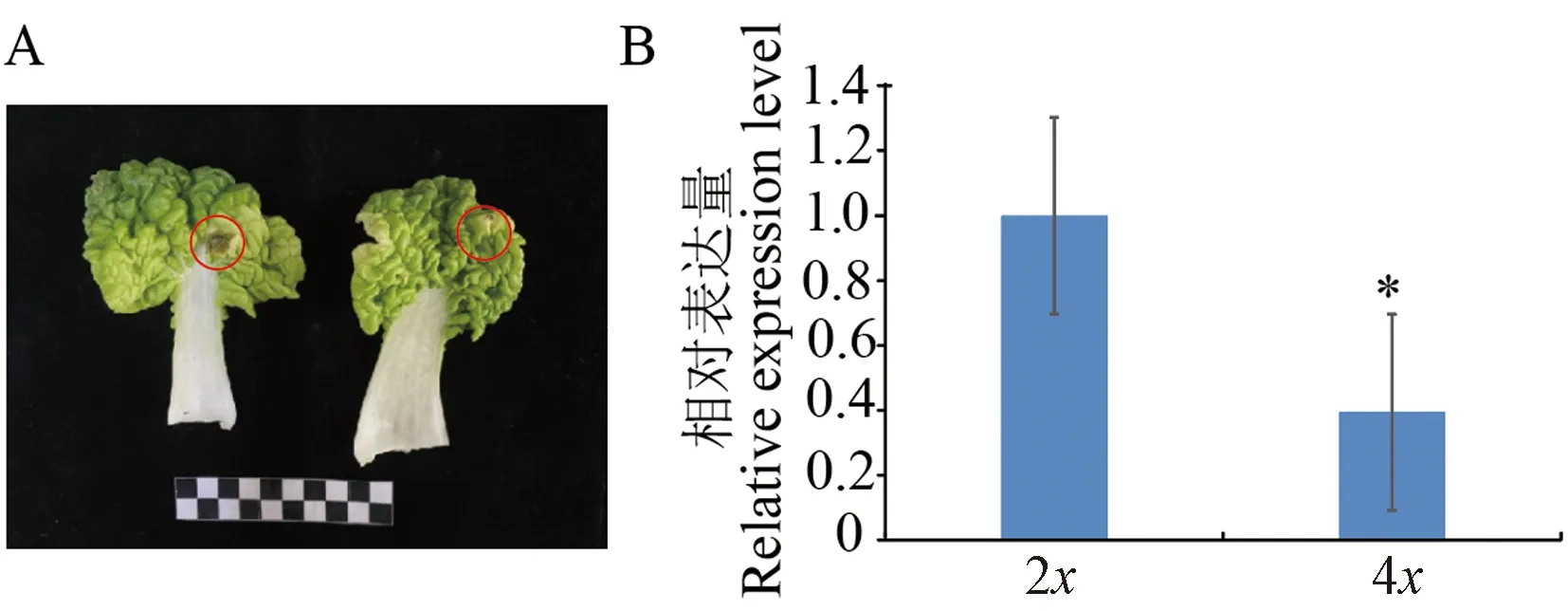
注:A:灰霉菌侵染表型, 红色圆圈内为灰霉菌菌斑; B:灰霉菌定量分析结果。Note: A: Botrytis cinerea infection phenotype, the red circle is Botrytis cinerea plaque. B: Quantitative analysis of Botrytis cinerea.图5 二、四倍体不结球白菜灰霉菌侵染分析Fig.5 Analysis of the infection of Botrytryus cinerea in tetraploid non-heading Chinese cabbage
3 讨论
近年来,多倍体育种已广泛应用于植物新品种培育中,主要以农作物倍性育种为主[7]。国内外已成功研究出小黑麦[8]、水稻[9]、草莓[10]、芦笋[11]等多倍体品种,且部分已投入生产中。本试验通过诱导不结球白菜黄心乌的同源四倍体发现,该四倍体在农艺性状上表现为叶片皱缩程度加深进而导致叶面积变小,植株器官膨大,结实率较低。前人研究指出,皱缩症状叶片的产生可能是由于参与叶片发育过程中产生基因突变以及外界环境因素影响[12];彩色马蹄莲四倍体表现出器官巨大、抗逆性增强、观赏价值增加[13];四倍体萝卜结实率低但经过多代单株选择及驯化,结实率进一步提高[14],与上述结论一致,同时结实率提升方面有待进一步研究验证。营养指标方面,前人研究结果发现二、四倍体营养成分含量有差异[15]。本研究发现四倍体的可溶性蛋白、纤维素、有机酸含量分别比二倍体增加2.74%、42.03%、15.13%,这可能是由于染色体加倍和核质互作的影响,导致多倍体生理活化性增加,进而使代谢产物增加;可溶性糖、叶绿素、硝态氮含量分别比二倍体降低0.43%、2.00%、49.40%,其含量不随倍性水平直线上升,与前人在水稻上研究发现植物的性状并非随倍性增加而增大的结果一致[16],与鼠毛草加倍后次生长代谢产物含量呈随机变化的结果相吻合[17]。
植物光合能力的强弱影响植物对光的适应能力,通过光合响应曲线及相关参数分析比较二、四倍体叶片光合生理特性,能够进一步反映植物在不同光照条件下的适应能力[18]。本试验通过比较二、四倍体的光合特性发现,四倍体的Pmax、LSP、Rd均高于二倍体,表明在强光下,四倍体拥有较强的光合能力,代谢能力强,有利于干物质的积累;LCP、AQY均低于二倍体,表明四倍体弱光耐受力较弱。数种植物多倍体诱导试验发现,多倍体植物光合能力未呈规律性变化,如四倍体紫锥菊的光合效率在生长各个时期均高于二倍体,为四倍体生物量的增加奠定了生物基础[19];二倍体马铃薯与其染色体加倍后的个体相比,多倍体的光合能力强于二倍体,具体表现为多倍体利用弱光的能力较强,CO2的固定和转化能力增强[20];同时在不结球白菜暑绿四倍体中也发现其光适应能力、耐荫性增强[21]。目前,通常用植物LSP和LCP作为植物对光环境适应能力的判断依据,LSP较高、LCP较低表明植物对光环境具有更好的适应能力[22],结合本研究结果表明诱导后的不结球白菜黄心乌同源四倍体的光合能力优于二倍体。此外,在木薯多倍体研究中发现DNA含量增加导致染色体重排及DNA序列的得失等结构变化,基因表达水平发生显著改变并且二、四倍体在蛋白质类型上存在明显差异,主要表现在光合特性及抗病性方面[23],该现象在甘蓝[24]、棉花[25]中也被发现。染色体加倍还可能导致多倍体植物的抗逆性增加[26],通过对二、四倍体植株灰霉菌侵染的分析发现,与二倍体相比,四倍体的抗逆性强。相关抗病机制研究发现,不同品种水稻对黑条萎缩病表现出不同抗性与其体内的激素水平有关[27];烟草抗病品种的光合特性优于感病品种,进而保持较强的抗病性[28],由此推测同源四倍体黄心乌抗病性增强可能与生理活动改变及光合能力增强有关,但其具体抗病机制还有待探索。
4 结论
本研究通过比较二、四倍体黄心乌农艺性状、营养指标、光合特性、抗病性等指标,发现四倍体较二倍体表现出植株巨大性,具有较强的光环境适应能力和抗病性等优良性状,为选育高产、抗病的不结球白菜提供新材料。但不结球白菜黄心乌同源四倍体仍存在结实率低、叶片皱缩等缺点,因此早期加强对叶形及结实率的选择十分重要,这为不结球白菜新品种的育种工作提供了新思路。
