石墨烯负载Ti-Ni双金属对MgH2可逆储氢性能的催化改性及机理
2022-06-29刘永锋高明霞潘洪革
简 旎,刘永锋,高明霞,潘洪革
(硅材料国家重点实验室/浙江省电池新材料及应用技术重点实验室/浙江大学材料科学与工程学院,浙江 杭州 310027)
1 引 言
近年来,MgH2因其较高的质量储氢密度(7.6 wt%)、优良的可逆性和低的成本,备受关注[1-3]。然而,MgH2的热力学稳定性较高(ΔH(MgH2)=76 kJ·mol-1·H2),吸放氢动力学缓慢,导致其放氢温度高于300 ℃,从而阻碍了其实际应用[4]。
改善MgH2吸放氢性能的方法主要有合金化[5-6],纳米化[7-8],催化[9-12]或将上述方法联合使用[13-14]。合金化是从热力学角度提高Mg储氢性能的一种有效方法。合金化元素通常采用过渡金属元素,如Ni、Ti、V、Fe、Cu和Mn等[15],其中Ni是最典型的合金化元素[16-17]。Chen等[18]发现在MgH2中添加少量Ni,在放氢后形成的Mg2Ni可促进MgH2的吸放氢。Mg2Ni/Mg2NiH4在吸放氢过程中起到“氢泵”的作用,能够促进Mg-H键的断裂。纳米化储氢材料由于比表面积高、晶界多、扩散距离短,因此较体相材料具有更好的吸放氢动力学性能。Xia等[8]借助二丁基镁((C4H9)2Mg)的吸氢热解反应,制备得到了负载于石墨烯上的纳米MgH2,其放氢峰值温度为247 ℃,较体相MgH2的峰值温度降低121 ℃。150 ℃下只需10 min即可放氢完全,其放氢产物在250 ℃,0.3 MPa氢压下只需40 min即可吸氢完全,表现出良好的吸放氢动力学性能,但体系有效储氢量明显降低。
与合金化和负载纳米化方法相比,引入催化材料的方法能够在提升MgH2的动力学性能同时,最大程度地保持其储氢容量。作者最近研究发现,N掺杂Nb2O5改性MgH2的起始放氢温度降低至170 ℃,较原始MgH2降低了130 ℃。放氢产物在5 MPa氢压下,随温吸氢至120 ℃即可达到6.3 wt%的吸氢量。此外,体系在70 ℃保温6 h可完全吸氢,表现出优异的动力学性能。为了进一步降低MgH2体系的吸放氢温度,提高其吸放氢速率,本研究通过超声化学方法制备了非晶TiH2和纳米Ni双负载的Ti-Ni@GR催化剂,系统地研究了其对MgH2可逆储氢性能的影响规律和机理。
2 实验材料与方法
2.1 实验原料及制备
实验用材料无水NiCl2和LiH,TiCl4、石墨烯和四氢呋喃,镁粉均为外购。催化剂Ti-Ni@GR的制备流程:首先将一定量石墨烯加入四氢呋喃,搅拌均匀,再将LiH、NiCl2和TiCl4按照物质的量的比6∶1∶1的比例加入其中,超声过夜,经离心、干燥后得到最终产物Ti-Ni@GR。
MgH2的制备方法为:将5 g Mg粉在2 MPa H2下升温至585 ℃,恒温2 h,接着在340 ℃恒温8 h,然后采用球磨细化首次氢化的Mg粉,最后将细化后的粉末装入反应器内,在380 ℃、5 MPa H2下保温12 h得到纯度98.7%的MgH2。所有样品的转移和保存均在充有高纯氩(99.999%)的手套箱(MBRAUN)中进行,其水含量和氧气含量均控制在百万分之一以下。
通过高能球磨将制得的催化剂引入MgH2储氢体系。球磨机为行星式球磨机(QM-3SP4),球磨转速为500 r/min,球磨时间为24 h。
2.2 性能测试
材料在不同升温速率下的放氢采用程序升温脱附(TPD)实时监测。TPD测试装置由反应器、管式电阻炉和气相色谱仪(GC)组成。测试时采用高纯氩气作为载气,气流流速为25 mL·min-1,样品测试所用质量一般为20 mg。材料的吸放氢温度、速率、储氢容量和循环性能等通过体积法测试,测试在实验室自制的Sieverts型气-固反应装置上进行。随温放氢测试升温速率为2 ℃·min-1,等温放氢测试升温速率为10 ℃·min-1。材料的储氢容量通过气体状态方程计算得到,实验过程中计算机自动记录的温度和压力数据。实验测试样品一般用量60 mg。样品放氢的热力学行为通过差式扫描量热法(DSC)在200 F3型热分析仪上进行测试,测试时通40 mL·min-1的载流气(高纯氩),加热速率设置为2 ℃·min-1。通过积分吸热峰的面积可求得放氢反应的焓变。
2.3 结构表征
采用X射线衍射(XRD,MiniFlex600)对材料进行物相分析。XRD测试以Cu的Kα为辐射源,电压为40 kV,电流为250 mA,扫描速率为1(°)·min-1,步长0.01°。采用扫描电镜(SEM,Hitachi-S4800)和透射电子显微镜(TEM, Tecnai G2 F20 S-TWIN)观测材料的形貌。采用X射线光电子能谱仪(XPS,ESCALAB 250Xi)分析样品表面成分及相关元素的化学状态。光源是Al Kα射线,能量为1 486.6 eV。
3 结果和讨论
3.1 石墨烯负载双金属Ti-Ni的结构与形貌
图1为制备的Ti-Ni@GR和Ti@GR的XRD图谱以及Ti-Ni@GR的XPS分析结果。由图1(a)可知,Ti-Ni@GR在44.5°、51.8°和76.4°处有明显的衍射峰,分别对应单质Ni的(111)、(200)和(220)晶面。宽化的衍射峰说明所制备的Ni晶粒尺寸小或是结晶性较差,未观察到Ti基物质的衍射峰。Ti@GR的XRD图谱同样未观察到Ti基物质的衍射峰,说明用该方法制备得到的Ti可能是非晶态。图1(b)XPS全谱证明了制备的Ti-Ni@GR中Ti、Ni、C和O元素的存在。进一步分析Ti 2p和Ni 2p轨道高分辨XPS图谱可知,Ti 2p轨道检测到的结合能为454.3/460.1 eV和457.6/463.4 eV两组XPS峰,这与文献报道的TiH2和Ti2O3的Ti 2p3/2-2p1/2自旋双重轨道峰分别对应[19]。对Ni 2p轨道的分析检测到了结合能为852.6/869.8 eV和856.8/874.0 eV两组XPS峰,分别对应于金属Ni和NiO的Ni 2p3/2-2p1/2自旋双重轨道峰,少量Ti2O3和NiO的出现可能是由于Ti原子和Ni原子表面的吸附氧造成的。由上述分析可知,制备的Ti-Ni@GR催化剂中的活性成分为非晶的TiH2和金属Ni。
图2(a)为Ti-Ni@GR的SEM形貌。从图可见,Ti-Ni@GR具有完好的石墨烯片状结构,片层呈现明显的褶皱形态,但观察不到表面的金属颗粒形貌,可能是因为纳米金属颗粒尺寸太小,在SEM下难以观测到。Ti-Ni@GR的TEM形貌如图2(b,c)所示,从图中可清晰地观察到石墨烯片层上均匀地负载了大量的纳米颗粒,颗粒尺寸分布在5~15 nm范围,主要集中在10 nm以下。图2(c)对应区域的C、Ni和Ti元素EDX面扫测试结果如图2(d~f)所示,分析可知Ni元素面扫信号强度整体高于Ti,表明所制备的Ti-Ni@GR中Ni的含量高于Ti。同时,Ni与Ti元素在相同区域呈现不同的分布规律,在Ni最集中的中间区域,Ti元素的信号强度最弱,证明两者并未形成合金而是各自负载于石墨烯上。结合以上分析,可知制备得到的产物是尺寸约为10 nm的非晶态TiH2与纳米金属Ni共负载于石墨烯的复合材料。

图2 Ti-Ni@GR的SEM图像(a),TEM图像(b, c)以及对应区域的C、Ni和Ti元素的EDS面扫描图谱(d~f)Fig. 2 SEM (a), TEM (b, c) images as well as the corresbonding EDS mappings of C, Ni and Ti (d-f) of Ti-Ni@GR
3.2 Ti-Ni@GR添加的MgH2体系的储氢性能
图3为MgH2-xwt% Ti-Ni@GR(x=0、1、3、5、7和9)体系的放氢性能测试结果。由图可知,不同催化剂添加量的复合体系的起始和峰值放氢温度均明显低于原始MgH2。仅添加1 wt% Ti-Ni@GR,MgH2起始放氢温度降低至230 ℃,比原始MgH2降低70 ℃。Ti-Ni@GR的添加量越高,体系的放氢温度越低,添加量提升至9 wt%时,体系起始放氢温度降低至185 ℃,峰值放氢温度降低至244 ℃。此外,MgH2的分步放氢和拖尾现象随着催化剂添加量的增加逐渐弱化,当Ti-Ni@GR添加量为9 wt%,TPD中MgH2放氢的肩峰基本消除。说明了Ti-Ni@GR的添加有助于MgH2的一步放氢,这是因为Ti-Ni@GR的添加提高了球磨效率,使MgH2的粒径更均匀地分布。同时Ti颗粒和C分散在MgH2基体中,为H扩散提供了通道,改善了MgH2大颗粒的动力学性能[12]。综合峰值放氢温度和放氢量,MgH2-9 wt% Ti-Ni@GR体系在不同添加量的体系中具有较优的性能。该体系从185 ℃开始放氢,峰值放氢温度为244 ℃,分别较原始MgH2降低约115 ℃和82 ℃,且可在315 ℃时结束放氢,放氢量保持在6.76 wt%。
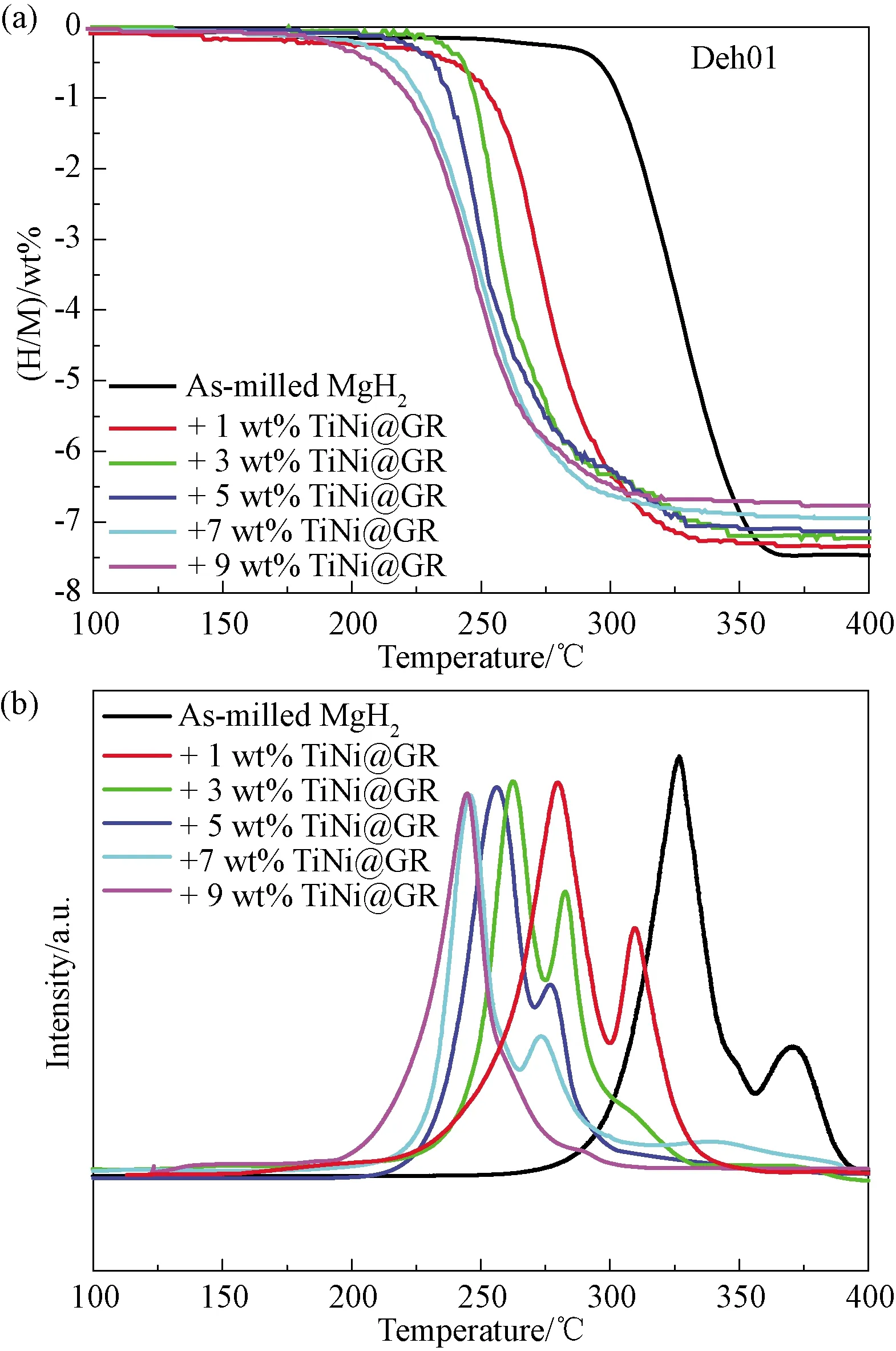
图3 (a)MgH2-x wt% Ti-Ni@GR(x=0、1、3、5、7和9)体系的 首次随温放氢曲线和(b)TPD曲线Fig. 3 (a) Volumetric release curves and (b) TPD curves of the MgH2-x wt% Ti-Ni@GR systems. (x=0, 1, 3, 5, 7, 9)
图4为完全脱氢的MgH2-xwt% Ti-Ni@GR样品的随温吸氢曲线和二次放氢曲线。从图可见,催化剂添加量高于5 wt%的体系可在室温吸氢,较原始MgH2的初始吸氢温度降低了约80 ℃。Ti-Ni@GR催化剂的添加量越高,体系的随温吸氢结束温度越低。其中,添加量为9 wt%的体系表现出最优的吸氢性能,在升温至100 ℃时,体系可吸氢5.35 wt%,该吸氢量是原始MgH2在相同条件下的50倍。升温至150 ℃,该体系总吸氢量为6.3 wt%,且在175 ℃时结束吸氢。从图4(b)可以发现,样品的结束放氢温度相比首次放氢均有明显降低,导致样品的放氢温度区间明显缩短,MgH2-9 wt% Ti-Ni@GR样品的二次放氢从205 ℃开始,至265 ℃结束,放氢温度区间仅为60 ℃,相比首次缩短了约70 ℃,且二次放氢量为6.6 wt%,与其首次放氢量相比,容量保持率高达97.6%。以上结果表明,Ti-Ni@GR的添加显著提高了MgH2体系的低温吸放氢可逆性。

图4 (a)MgH2-x wt% Ti-Ni@GR(x=0、1、3、5、7和9)体系的随温吸氢曲线和(b)二次随温放氢曲线Fig. 4 (a) 4 Non-isothermal hydrogenation curves and (b) the 2nd non-isothermal dehydrogenation curves of the MgH2-x wt% Ti-Ni@GR systems. (x=0, 1, 3, 5, 7, 9)
图5(a)为MgH2-9 wt% Ti-Ni@GR样品和原始MgH2在不同温度下的等温放氢曲线。该样品在275 ℃下,15 min内即可完成放氢,放氢量为6.2 wt%。当温度降低至225 ℃,样品放氢速度有所减慢,但在60 min内可仍放出3.8 wt%。作为对比,原始MgH2体系在275 ℃,在10 min内放氢量几乎可忽略。由此可知,Ti-Ni@GR复合催化剂明显改善了MgH2体系的放氢动力学。MgH2-9 wt% Ti-Ni@GR样品也表现出优异的等温吸氢性能。如图5(b)所示,在5 MPa氢压下,放氢后的MgH2-9 wt% Ti-Ni@GR样品在100 ℃,5 min即可快速吸氢至4.8 wt%,此外,保温时间延长至10 min可吸氢饱和,吸氢量达5.9 wt%。即使在75 ℃的低温下,样品也能在10 min内快速吸氢3.6 wt%。以上结果表明,Ti-Ni@GR的添加显著提高了MgH2体系的吸氢动力学性能。

图5 MgH2-9 wt% Ti-Ni@GR和原始MgH2体系的等温放氢曲线(a)和等温吸氢曲线(b)Fig. 5 Isothermal dehydrogenation curves (a) and isothermal hydrogenation curves (b) of the MgH2-9 wt% Ti-Ni@GR systems and as-milled MgH2
3.3 Ti-Ni@GR催化改性MgH2吸放氢性能的机理
采用Kissinger动力学方程计算MgH2-Ti-Ni@GR体系放氢反应的表观活化能ΔEa。图6(a)为原始MgH2和MgH2-Ti-Ni@GR在不同升温速率(1、2、4和8 K·min-1)下的TPD曲线。随着升温速率的提高,球磨后的MgH2和MgH2-Ti-Ni@GR的放氢峰值温度均会升高。图6(b)为相应的Kissinger动力学方程的直线拟合图,计算得到MgH2-9 wt% Ti-Ni@GR体系放氢反应的ΔEa为83.1 kJ·mol-1,相比无掺杂的MgH2降低约40%,说明了Ti-Ni@GR的加入有效降低了体系的放氢活化能,从而降低了放氢温度。图6(c)是原始MgH2和MgH2-9 wt% Ti-Ni@GR体系的放氢DSC曲线。由曲线的峰面积计算得到MgH2-9 wt% Ti-Ni@GR体系的放氢焓变值约74.4 kJ·mol-1H2,非常接近原始MgH2体系(约75.0 kJ·mol-1H2),表明添加Ti-Ni@GR对MgH2的放氢热力学基本没有影响。结合Kissinger计算结果,Ti-Ni@GR的添加显著改善了MgH2的动力学性能,但对其反应热力学没有明显影响。

图6 MgH2-9 wt% Ti-Ni@GR体系和原始MgH2在不同的加热速率(1、2、4和8 K·min-1)下的TPD曲线(a),相应的Kissinger线性拟合图(b)和放氢DSC曲线Fig. 6 TPD curves at different heating rates of 1, 2, 4and 8 K·min-1 (a), corresponding Kissinger’s plots (b) and DSC curves (c) of the MgH2with and without 9 wt% Ti-Ni@GR
通过XRD分析了MgH2-9 wt% Ti-Ni@GR体系在前两次吸放氢的产物,如图7(a)所示。体系球磨后产物的XRD图谱中主要出现的是β-MgH2的衍射峰,同时还探测到了γ-MgH2和少量杂质MgO。但未检测到含Ni与Ti元素物相的相关XRD衍射峰,主要是因为这些物相含量较低或尺寸小。首次放氢后,MgH2完全消失,XRD中出现Mg和少量Mg2Ni的衍射峰。首次吸氢后,单质Mg吸氢转变为MgH2,Mg2NiH4相也由Mg2Ni吸氢得到。样品的二次放氢产物的XRD图谱与首次放氢一致,证明在吸放氢循环的过程中,始终存在Mg与MgH2以及Mg2Ni与Mg2NiH4之间的互相转化。值得注意的是,在吸放氢产物中,未检测到任何含Ti物相的衍射峰,该现象可能是由于制备的非晶TiH2保持稳定存在,或是由于反应后的Ti基物质的颗粒尺寸过小或是结晶度低且含量少,导致无法检测到。为进一步确定体系中的活性催化组分,通过XRD分析了MgH2-9 wt% Ti@GR体系在不同循环阶段的产物,结果如图7(b)所示。由图可见,样品的球磨产物的XRD图谱仍未检测到关于Ti的衍射峰。但在首次放氢后,在40.2°出现一个衍射峰,对应为金属Ti的(101)晶面,表明在放氢后TiH2分解形成了结晶性较好的Ti单质。再吸氢以后,XRD图谱只能观察到MgH2和少量MgO,未出现新的Ti基相,原因可能是在40°左右Ti的衍射峰被MgH2的(211)晶面对应的衍射峰所遮掩,或是又生成了结晶性较差的TiH2。

图7 (a)MgH2-9 wt% Ti-Ni@GR和(b)MgH2-9 wt% Ti@GR体系不同循环阶段的XRD图谱Fig. 7 XRD patterns of MgH2-9 wt% Ti-Ni@GR (a) and MgH2-9 wt% Ti@GR (b) systems at different stages
为进一步表征Ni和Ti的存在形式,对体系吸放氢前后的产物进行XPS分析。图8(a)为MgH2-9 wt% Ti-Ni@GR体系球磨后,首次放氢与吸氢后Ni 2p轨道的XPS图谱。从球磨产物的XPS图谱可观察到一组2p3/2-2p1/2XPS谱峰,对应Ni单质(852.6/871.0 eV),说明球磨时,Ni表面的少量氧化层与MgH2发生反应被还原。首次放氢后,Ni 2p峰的位置偏移至852.7和871.1 eV,证实了放氢过程中Mg2Ni合金的生成[20]。首次吸氢产物的Ni 2p XPS图谱中,Mg2Ni的XPS峰完全消失,在结合能869.6和852.2 eV处出现了Mg2NiH4的自旋双重轨道峰,表明了Mg2Ni的氢化,这与XRD分析结果一致。MgH2-9 wt% Ti-Ni@GR样品球磨产物,放氢产物与吸氢产物的Ti 2p轨道XPS图谱如图8(b)所示。球磨样品的Ti 2p XPS峰图谱中除了TiH2(460.1/454.3 eV)外,图中还出现了对应于Ti的自旋双重轨道峰,分别位于460.1 eV(2p1/2)与453.6 eV(2p3/2)处,表明球磨过程中表面少量吸附氧的Ti被还原。首次放氢过程中,TiH2的XPS峰消失,取而代之的是Ti单质的XPS峰,表明此时催化剂中的TiH2已完全分解为Ti和H2。由首次吸氢样品的XPS图谱可知,Ti元素的结合能不变,表明其已稳定以单质形式存在于循环体系中。

图8 不同循环阶段MgH2-9 wt% Ti-Ni@GR体系的Ni 2p(a)和Ti 2p(b)的XPS图谱Fig. 8 XPS spectra of Ti 2p (a) and Ni 2p (b) of MgH2-9 wt% Ti-Ni@GR system at different stages
综上所述,Ti-Ni@GR催化剂在球磨过程中主要活性组分TiH2和Ni,未与MgH2发生反应。在放氢过程中,Ni与MgH2反应生成了Mg2Ni,而TiH2分解成为Ti和H2。在吸氢过程中,Mg2Ni转变为Mg2NiH4,而原位分解得到的Ti稳定不变。Mg2Ni与Mg2NiH4之间的可逆相变在MgH2充当“氢泵”的作用[18],能够降低氢原子在MgH2颗粒表面结合形成氢分子的势垒,有利于MgH2颗粒表面氢原子的扩散,进而提高MgH2-Ti-Ni@GR复合体系放氢动力学性能。比较电负性值可知,H(2.20)>Ti(1.54)>Mg(1.31),因此Ti元素的存在可降低Mg-H键的键能[21],此外,Ti丰富的3d空轨道有利于Ti捕获H给出的电子,降低了Mg-H之间的电子传递势垒,从而降低MgH2的吸放氢反应温度。这也是Ti-Ni@GR改善MgH2吸放氢性能的重要原因。
3.4 MgH2-Ti-Ni@GR体系的循环性能
图9(a)和(b)分别为MgH2-9 wt% Ti-Ni@GR体系的10个吸放氢循环的随温放氢和吸氢曲线。从图9(a)可见,第2次放氢的起始放氢温度与首次放氢的相比略有升高,为205 ℃。然而,二次放氢的结束温度与首次相比显著降低,为265 ℃。图9(b)所示的二次循环吸氢性能相比首次,在100 ℃以内的低温范围有明显提升。由图可知,后续循环的随温吸放氢曲线几乎不变。此外,MgH2-9 wt% Ti-Ni@GR体系首次放氢量为6.65 wt%,10次循环后的放氢量保持在6.55 wt%,对应的容量保持率为97%(图9(c))。吸放氢循环结果表明,MgH2-Ti-Ni@GR体系表现出较为稳定的循环性能,Ti-Ni@GR的添加在降低MgH2吸放氢温度的同时改善了MgH2的可逆性和循环稳定性。
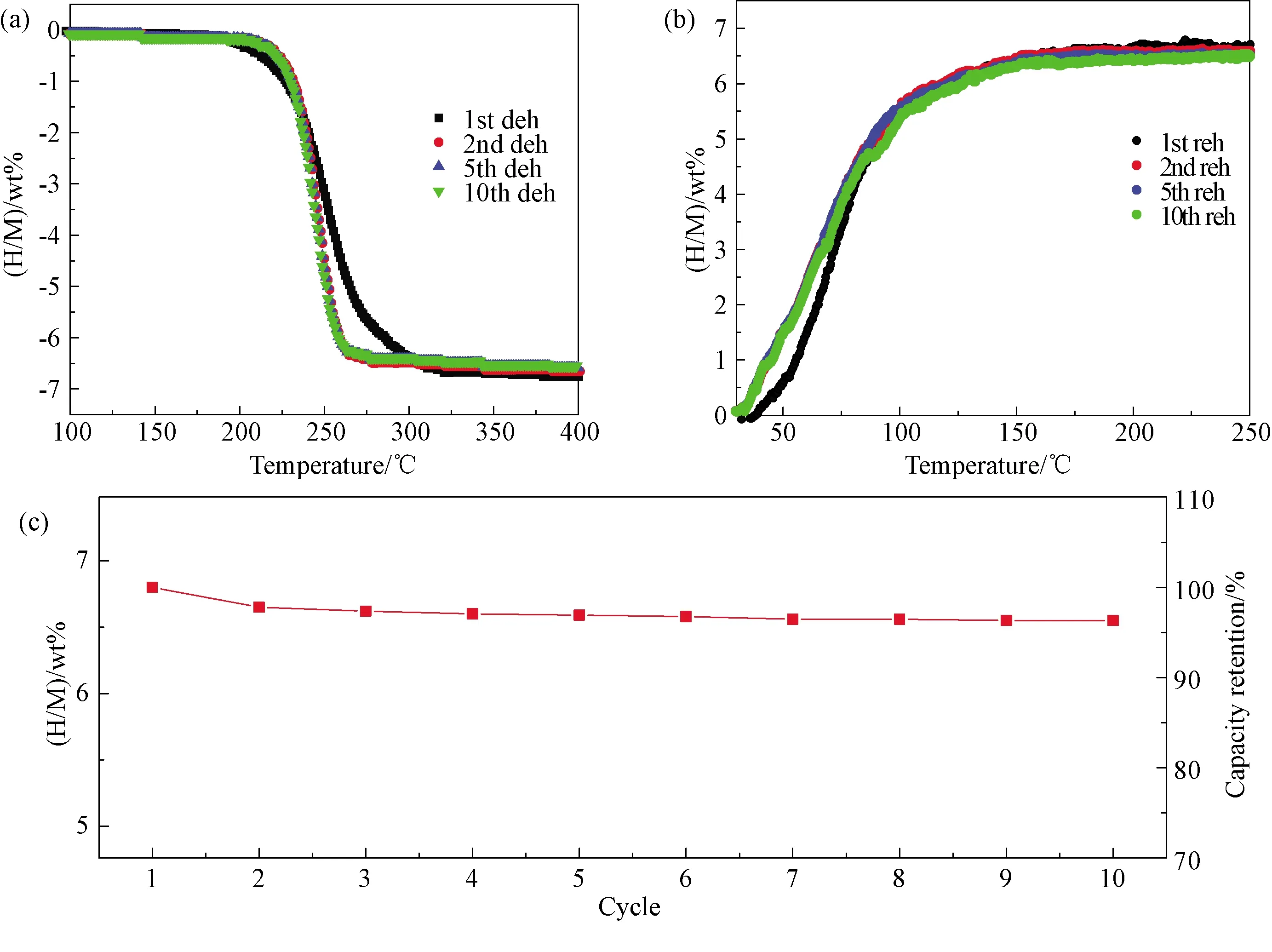
图9 MgH2-9 wt% Ti-Ni@GR体系的(a)循环放氢曲线和(b)循环吸氢曲线,选取展示了第1、2、5和10个循环;(c)循环放氢容量保持率Fig. 9 Volumetric dehydrogenation (a) and hydrogenation (b) curves of the 1st, 2nd, 5th and 10th cycle and capacity retention curves (c) of the MgH2-9 wt% Ti-Ni@GR system
图10分别为MgH2-9 wt% Ti-Ni@GR体系首次吸氢后的TEM形貌、高分辨TEM图像、HADDF图像及对应的EDS面扫描分布图。在TEM形貌图片中,可以观察整个MgH2颗粒尺寸约为500 nm,从EDS面扫描分布图可知,Ti元素和Ni元素在循环过程中呈现均匀分布和良好分散,这应该是Ti-Ni@GR 改性MgH2体系循环稳定性良好的主要原因。
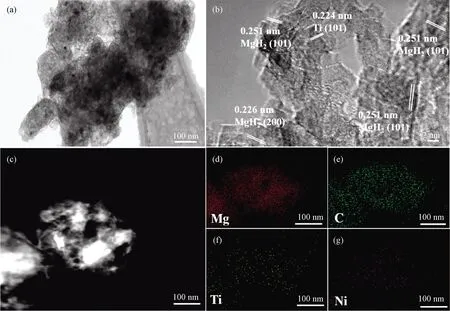
图10 一次循环后MgH2-9 wt% Ti-Ni@GR的TEM形貌(a),高分辨TEM图像(b),STEM-HAADF图像(c)和对应区域的Mg、C、Ti和Ni元素的EDS面扫描分布图(d~g)Fig. 10 TEM (a), HRTEM (b), and STEM-HAADF (c) images as well as the corresponding EDS mappings of Mg, C, Ti and Ni (d-g) of the MgH2-9 wt% Ti-Ni@GR after 1 cycle
4 结 论
本实验系统探索了Ti-Ni@GR催化剂的合成,并研究了其对MgH2可逆储氢性能的催化改性及机理。研究发现,Ti-Ni@GR催化剂的添加明显改善了MgH2的储氢性能,其中,MgH2-9 wt% Ti-Ni@GR样品的起始和峰值放氢温度分别较原始MgH2降低了115 ℃与86 ℃。在5 MPa H2下,升温至175 ℃即吸氢完全,可逆性能优异,10次循环后容量保持率高达97%。同时,该体系在二次放氢时的放氢温度区间明显缩短,结束放氢温度提前至265 ℃,低温吸氢性能也有所改善,在后续的循环中吸放氢性能基本保持不变。机理探究发现,Ti-Ni@GR在经过一次吸放氢循环后生成新的催化活性物质。Ni与MgH2反应形成Mg2Ni,TiH2自分解形成Ti。在吸放氢循环中,Mg2Ni和Mg2NiH4之间存在可逆相变,而Ti保持稳定存在。EDS分析发现Ti和Ni均匀分散,这是其循环稳定性较好的主要原因。
