微生物堵塞过程中生物膜生长特征对多孔介质渗流特征影响
2022-06-29王茜丹杨悦锁武宇辉裴子丞
王茜丹,路 莹,杨悦锁,武宇辉,徐 喆,裴子丞
微生物堵塞过程中生物膜生长特征对多孔介质渗流特征影响
王茜丹,路 莹*,杨悦锁,武宇辉,徐 喆,裴子丞
(吉林大学地下水资源与环境教育部重点实验室,吉林 长春 130021)
为研究回灌水刺激下生物膜在砂柱中的生长规律,并分析生物膜生长特征对堵塞介质典型渗流特征的影响,采用室内土柱实验方法,供给营养液刺激砂柱内生物膜生长,模拟入渗介质生物堵塞的过程,监测介质渗透系数的变化,并开展不同回灌时长下介质水分吸持实验和弥散试验,并对其内生物膜形态进行表征.结果显示,在0~5h时,渗透系数呈先下降后回升趋势;在回灌至18h前,渗透系数急剧衰减,水力弥散系数明显增大,水分吸持能力的变化并不明显;18h后渗透系数降低速率减缓,水分吸持能力明显升高,溶质运移过渡到以弥散作用为主导机制.综上,可将生物膜在介质内的生长分为三个阶段:菌适应期,接种菌体并未生长繁殖,单纯由于菌体的流入与流出引起渗透系数的变化;菌体大量生长繁殖期,大量生长繁殖的菌体占据了部分介质孔隙体积;胞外聚合物大量分泌期,逐渐形成具有透水性的生物膜,生物膜的生长与回灌水提供的养分形成动态平衡.
地下水人工回灌;生物堵塞;生物膜;渗透系数;弥散试验;水分特征曲线
为了应对地下水的过度开采,利用人工手段将选用的入渗水引渗或注入目标含水层中[1],以丰富地下水资源.通过这种人工手段,地下水资源得到了补给,由此引发的系列环境问题得到了有效的定期缓解,但是实践工程中在回灌水渗入回灌介质的渗流路径上有微生物群落存在[2],这些微生物在水体环境中能依靠自身特性与介质颗粒牢固粘附[3]并在适当的条件下迅速繁殖,微生物的生物体及其代谢物将粘附或积累在渗透介质上,降低了介质的渗透能力[5].人工回灌对地下水资源的管理、储存和恢复有重大影响,但这种堵塞问题严重影响着工程的回灌效率、维护成本以及使用寿命[7],在一定程度上限制了地下水的有效补给和工程的高效实施[7-8].
Baveye等[9]、姜桂华等[10]系统归结了微生物作用堵塞孔隙的物质,认为主要是因为微生物的生长、衰亡、吸附作用引起细菌及其新陈代谢物质在固体颗粒表面聚集,占据了介质内部孔隙通道导致堵塞.Bishop[11]、Flemming等[12]将这种吸附在固体颗粒表面的微生物菌体及其胞外聚合物(EPS)统称为生物膜,并认为大量的呈网状结构的EPS构成其骨架,微生物填充其中.对于生物膜的两种组分,Thullner等[13]观察到微生物发展成为生物堵塞是以分散的菌落形式存在,而Vandevivere等[14]实验发现胞外聚合物也可以使介质渗透性能显著下降.这说明生物膜的两种组分都会对介质的渗透性能产生影响,然而EPS是附着于细胞壁上的大分子有机物质[15],来源于细胞分泌、细胞溶解和吸附等[16],与菌体位置和性质存在显著差异.而生物膜在多孔介质中的行为模式会受其自身性质影响[17],因此当生物膜在介质孔隙内积聚后,其在不同阶段两种组分的生长变化会对介质的透水能力产生不同影响.
因此,本文采用渗流试验测定微生物生长阶段含水介质的渗透系数变化,并通过离心机法和弥散试验对不同堵塞程度下的水分吸持能力和弥散能力进行测定.通过比对这些渗流特征变化相对应的生物膜组分变化,进一步分析生物膜堵塞过程中生物膜生长特征引起的介质渗透能力的变化规律.在以往的研究中,多是关注渗流过程中各项渗透性能指标整体的变化,而本研究着重于将各个渗透性能指标的变化与生物膜的生长水平相对应,得到各项渗透性能在不同的生物膜生长水平影响下发生的阶段性变化特征,为实际生物堵塞的预测与控制提供科学理论支持.
1 材料与方法
1.1 装置与材料
本试验采用一维柱装置,包括层析柱、蠕动泵、测压管、供水装置和出水装置五个部分(如图1所示).层析柱由厚度2mm的玻璃制成,内径1cm,高度7cm,实际装柱高度5cm.注水口和流出口均设有400目的筛网,防止砂样流出.在进出水口处分别设置测压管监测渗透系数.
本试验选用粒径在0.125~0.25mm的细砂作为供试含水介质.为了避免物理和化学因素的影响,将细砂过筛后洗净烘干,每次试验前用浓度为37%的浓盐酸浸泡24h,并清洗至超纯水在清洗前后电导率接近一致,灭菌烘干后,冷却备用[18].选用地下水中优势菌属[19]铜绿假单胞菌为接种液,磷酸盐缓冲液稀释至目标浓度.回灌水的配比为葡萄糖1000mg/L、硝酸钾289.2mg/L[20].

图1 试验装置示意
1.2 实验过程
将预处理后的砂样分层装入层析柱中,侧面敲击令其自然沉淀,保证过程中水面始终没过介质一定高度,重复此过程装至砂柱顶部,确保砂柱完全饱和[21].用蠕动泵以0.25mL/min的恒定流速注入4mL菌液后以相同流速供入营养液.每隔2h监测渗流柱的渗透系数,并设置回灌时长分别为5h,18h,28h, 35.5h,44h,50.5h的对照组,利用扫描电子显微镜对不同回灌时长下的生物膜生长水平进行表征,并测定不同生物膜生长水平下的水分吸持能力和溶质弥散能力.
在试验运行期间,对不同堵塞程度下的各组进行示踪剂弥散试验,示踪剂选用NaCl溶液,浓度为100mg/L.以0.25mL/min的速度将示踪液泵入,收集层析柱的流出液,每个样品200μL.用水质分析仪检测流出液中Cl-的浓度.将砂柱放入聚丙烯离心管中,用台式高速冷冻离心机依次在500,1000,1500, 2000r/min的转速下进行离心,每种转速下,分别离心5,10,15,25min并取样.待离心后取出砂柱,用高精度电子天平称量土样质量.根据每次离心前后质量之差计算出土壤体积含水率并计算不同含水率下所对应的土壤水吸力,即可绘制水分特征曲线[22-23].
待每组实验运行结束,取出砂柱进水口和出水口处的样品并进行预处理,预处理方法为:使用浓度为2.5%的戊二醛溶液在4℃下制片固定.磷酸盐缓冲溶液冲洗后,用乙醇溶液进行梯度脱水处理[20].将样品在真空状态下冷冻干燥,标号留用.然后使用扫描电子显微镜观察附着在砂柱上的生物膜形态.
1.3 数据处理
1.3.1 渗透系数 利用达西公式计算初始渗透系数.

式中:为出水口流量,m³/d;D为出入水口压强差, m;D为柱高,m;为入渗砂柱横截面面积,m2.
采用相对渗透系数¢(实测渗透系数与初始渗透系数0之比)随时间的变化规律反映砂柱渗透能力的变化.
1.3.2 土壤水吸力 土壤水吸力和水分含量的变化曲线称为土壤水分特征曲线,是土壤水力参数中的一个重要参数.美国学者在1980年提出Van Genuchten方程(简称VG方程)[24],因其线型与实测数据曲线相似且参数含义明确而在众多描述方程中最为常用,其表达式为:

式中:为土壤含水率,cm3/cm3;θ为土壤残余含水率, cm3/cm3;θ为土壤饱和含水率,cm3/cm3;为土壤水吸力,cm;为土壤水分特征曲线形状因子,共有θ、θ、4个参数[25].因此,本实验选用VG模型与实测数据进行拟合,进一步求出相关土壤水力参数进行分析.
1.3.3 弥散系数 通过进行室内弥散试验,可以获得示踪剂溶液的浓度分布函数的观测数据,以砂柱孔隙体积PV为横坐标,以出水NaCl溶液浓度为纵坐标,绘制示踪液在多孔介质中的穿透曲线[26].
求解对应生物膜生长水平下的纵向弥散系数L和纵向弥散度L,可用Laplace变换得到该实验数学模型的解析解:

式中:为示踪剂溶液的浓度值,mg/L;0为流出液中示踪剂的浓度值,mg/L;为试验柱内液体实际流速,m/d;exp()为以e为底的指数函数,其中e=2.718; erfc()为余误差函数.
在关系曲线图中找到相对浓度/0=0.159和/0=0.841两个点,得到与其对应的横坐标PV0.159和PV0.841,其中,PV0.159和PV0.841分别指示踪剂溶液相对浓度达到0.159和0.841时所对应流经的孔隙体积;将PV0.159和PV0.841分别代入式(4)和式(5)中,且令上式相减并同开平方变换,可以得到多孔介质纵向弥散系数的计算公式:

同上,多孔介质纵向弥散度的计算公式如下:
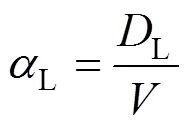
据此,可以求出纵向弥散系数L和纵向弥散度L.
2 结果与讨论
2.1 生物膜形态变化特征
生物膜的生命活动在扫描电子显微镜下的微观观察中变得更为直观.空白介质表面没有发现微生物存在的迹象(图2).接种回灌的砂柱样品中能明显观察到有异于未接种砂柱中杆状的铜绿假单胞菌菌体.
进出水端的介质颗粒表面裹覆的生物膜密度随回灌时间的延长而变高,微生物的生长繁殖迹象愈加明显.
在扫描电镜装置4300倍数下观察生物膜整体的生长趋势,并在更高的倍数下(×10000)观察到胞外聚合物的分泌情况(图3).


图3 生物膜形态扫描电镜
根据图3可将生物膜的发展分为三个时期,适应期:在5h时,菌体处于未进行大量生长繁殖的适应期,代谢活性微弱;菌体大量繁殖期:在18h前,大量菌体生长繁殖,没有观察到胞外聚合物迹象;胞外聚合物分泌期:在回灌到18h前开始分泌胞外聚合物,在28h状态下,胞外聚合物能够以丝状形态被观察到,亦称之为缠枝状.当回灌时间发展到35.5h时,胞外聚合物拉丝形态开始弱化,彼此之间形成带有孔隙的丝网状,在此期间菌体生长繁殖速度减缓.菌体和胞外聚合物以膜状形态厚厚裹覆在截止颗粒上.胞外聚合物随着渗流柱堵塞的进一步发展更加厚密.
2.2 多孔介质相对渗透系数变化特征
回灌模拟试验中,渗流柱的相对渗透系数发生如图4所示变化.在各组试验过程中,渗透系数大体上均呈衰减趋势,并可以根据相对渗透系数的衰减变化分为三个阶段.
在渗流试验初始阶段(0~10h),相对渗透系数会呈现下降至近60%后再回升至接近初始渗透系数的趋势.对应前面生物膜形态特征,此阶段,菌体刚刚脱离适应期,没有明显的生长繁殖代谢的迹象,因此单纯由菌体自身占据孔隙体积的变化影响多孔介质的渗透系数.接种菌体占据砂柱内部一定的有效孔隙空间,渗透介质的有效孔隙度随之降低,导致渗透系数降低.随着带有营养物质的回灌水代替菌液以恒定流速泵入,未附着的菌体流出含水介质,被占据的那部分有效孔隙通道重新恢复,渗透系数随着有效孔隙率增加而回升.
在中期阶段(10~26h)入渗介质的相对渗透系数均显著下降,降低到20%以下.比对相应阶段的生物膜生长变化发现,这一阶段中菌体与介质表面接触面积大而充分且营养物质充足,迅速繁殖,因此发生生物堵塞引起砂柱渗透性能急剧衰减,砂柱相对渗透系数快速下降.
在后期阶段(26~75h),相对渗透系数变化缓慢.此阶段菌体开始大量分泌胞外聚合物,菌体的生长繁殖速率下降,而胞外聚合物促进了菌体粘连聚集形成具有透水性的生物膜,但几乎没有更进一步的占据孔隙体积.因此这一阶段相对渗透系数变化缓慢,堵塞程度在衰减至3%以后趋于稳定.
Engesgaard等[27]认为生物堵塞后期介质渗透性趋于稳定是由于生物膜的生长与回灌水提供的养分形成动态平衡.本实验在介质渗透能力降低了97%以后渗透系数开始稳定,整个渗流过程中渗透性能衰减了3个数量级.Cunningham等[28]通过定水头渗流模拟试验发现,多孔介质由于生物堵塞,引起渗透性能衰减了92%~98%,与本实验结果相近.Taylor等[29]曾在室内进行定流量的生物堵塞渗流柱试验,发现不同的渗流速度和渗流条件下,堵塞发展的空间尺度有所不同.堵塞可以造成多孔介质水力传导系数下降3个数量级.Brough等[30]实验中发现,35个系列试验中生物堵塞引起的的介质渗透能力降低了28%~79%.大量的生物堵塞实验研究结果都符合Thullner[31]总结对比的生物堵塞对介质的渗透性变化影响一般在降低两到三个数量级的结论.这与本实验的实验结果相符,说明单纯由于生物堵塞引起的渗透性能衰减具有一定的极限性.

图4 相对渗透系数变化情况
2.3 介质水分吸持能力变化特征
根据离心实验实测所得数据绘制不同回灌时长下的水分特征曲线,见图5.在赋予砂柱57.647cmH2O的吸力时,由于吸力较低,介质内的小孔隙排水为主,处在不同堵塞程度下的砂柱离心出来的水量差异并不明显.在吸力提高到230.588cm H2O时,砂样含水量开始快速下降,不同砂柱离心所得水量出现差异,体积含水率在堵塞较严重的砂柱中明显大于堵塞程度轻的砂柱.在更高转速下离心时砂柱受到的吸力较高,主要是毛管孔隙中水分的变化,介质对水分的吸持能力作用明显,各砂柱的水分特征曲线差异趋于明显.
对比未注菌的空白砂柱会发现,在相同的吸力下,回灌时间越长,砂柱的体积含水率越高,即生物膜在介质中的生长会提高介质的吸持能力.生物膜的生长特征对介质水分吸持能力的影响可用土水特征参数刻画,利用Origin将实测数据与VG方程进行拟合求得参数,如表1.

图5 不同回灌时间节点的水分特征曲线
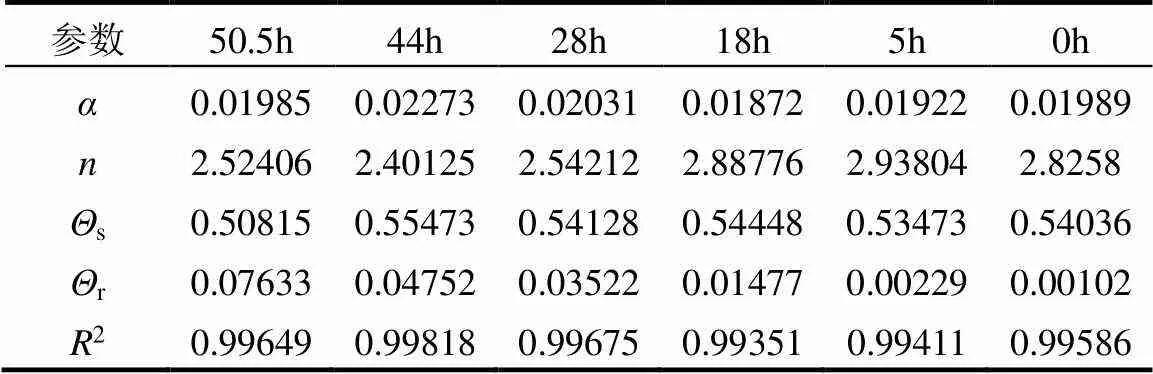
表1 VG方程参数
分析表1中求得的土水特征参数发现,土壤饱和含水率和形状因子的变化特征并不显著,而土壤残余含水率随着回灌时间的推移和生物膜生长繁殖不断升高,以残余含水率的变化表征水分吸持能力的变化.在5h、18h、28h、44h、50.5h时残余含水率分别为0.00229、0.01477、0.03522、0.04752、0.07633.与空白未注菌的砂柱残余含水率0.00102相比,在回灌初期残余含水率的升高幅度小,在18h以后,残余含水率提高了10倍以上.
残余含水率反映了介质中以薄膜形式或独立水环的形式存在的水量,与介质的结构和成分有关.水分吸持能力越强,紧紧吸附在介质颗粒表面的水量越多,残余含水率越高.而残余含水率与回灌时间存在明显相关关系,绘制残余含水率与回灌时间的关系如图6,并比对生物膜生长特征阶段,将水分吸持能力的变化分区.介质的水分吸持能力变化可以以胞外聚合物大量分泌为时间节点分为两个阶段.
在渗流试验的前18h,出现大量胞外聚合物节点前的阶段,菌体的附着和生长繁殖虽然引起渗透系数的急剧下降,但是残余含水率升高趋势并不明显.在28h的节点已经分泌大量胞外聚合物,相对于18h时残余含水率明显提高.胞外聚合物的大量分泌对于渗透系数衰减的影响微弱,但是对于介质持水能力的升高有明显的影响.

图6 残余含水率变化
介质的持水能力随附着菌体及其EPS产量的增多而愈强.堵塞越严重,介质所受生物膜生长的影响越显著,介质的水分吸持能力越强.而其中胞外聚合物的影响相较于菌体更加显著.
2.4 多孔介质溶质弥散能力变化特征
经过渗流试验初期渗透系数波动阶段后,分别在回灌时间为5h、18h、15h、24.5h的节点进行弥散试验.对试验数据进行拟合,如图7所示.在得到各个节点下弥散试验的实测数据后,用Origin软件进行拟合,进而分别求出各节点的纵向弥散系数及纵向弥散度.
初始时介质内溶质运移以对流作用为主导机制,对流作用对溶质运移的影响大于弥散作用.在回灌时间0~18h的情况下,菌体的附着与繁殖占据了介质内的孔隙通道,引起渗透系数的衰减和水力弥散系数的升高.对流作用开始减弱.Engesgaard等[27]发现含水介质渗透性将随着介质内堵塞的发展呈现明显的非均质性,水动力弥散等性能参数受到堵塞很大的影响,多孔介质内从均匀流为主导转变为向的流型发生从近均匀流模式向非均匀流模式转变.Seifert等[32]也发现由于进水端优先接受带有营养物质的回灌水补给,所以进水端附近附着于介质颗粒的生物膜更加有利于形成与发展,此时微生物菌落占据孔隙喉道,导致渗透系数显著下降,同时弥散度呈线性趋势增大.
在回灌至18h以后,胞外聚合物出现大量分泌趋势,主导机制转变为弥散作用,溶质弥散系数的变化开始稳定.

图7 不同回灌时间节点的穿透曲线
3 结论
3.1 生物膜在介质内的生长可以分为三个阶段.在0~5h时,介质内的接种菌处于接种后的适应期,没有生长繁殖和分泌胞外聚合物的迹象.在回灌至18h前,介质内生物膜的生长以菌体的生长繁殖为主.在18~28h间分泌缠枝状的胞外聚合物,逐渐与菌体共同发展成致密膜状厚厚裹覆在介质颗粒上.
3.2 介质的水分吸持能力在菌体大量生长繁殖阶段的前18h内改变并不明显;18h以后,菌体分泌大量胞外聚合物,介质的水分吸持能力显著增强,残余含水率提高10倍以上.
3.3 介质的弥散能力在菌体大量生长繁殖阶段的前18h内,由于菌体占据孔隙空间生长繁殖,水力弥散系数明显增大;18h后分泌大量胞外聚合物,溶质运移以弥散作用为主导机制,弥散系数逐渐稳定.
[1] Todd D K. Groundwater hydrology [M]. New York:Wiley, 1980.
[2] 北京市地质局水文地质工程地质大队,等.地下水人工补给[M].北京:地质出版社, 1982:170-171.
Beijing Bureau of Geology hydrogeology engineering Geology Brigade, et al.Artificial recharge of groundwater. Bei Jing: Geological Publishing House, 1982:170-171.
[3] 宋 伟,刘文虎.透析液生物污染的预防与控制[J]. 中国血液化, 2008,(2):113-115.
Song W, Liu W H. Prevention and control of biological contamination of dialysate [J].Chinese Journal of Blood Purification, 2008,(2):113- 115.
[4] Schwager A, Boller M. Transport phenomena in intermittent filters [J]. Water Science and Technology, 1997,35(6):13-20.
[5] Barrett M E, Taylor S. Retrofit of storm water treatment controls in a highway environment [C]//The Fifth International Conference of Sustainable Techniques and Strategies in Urban Water Management, 2004:243-250.
[6] Jeong HY, Jun S, Cheon J, Park M. A review on clogging mechanisms and managements in aquifer storage and recovery (ASR) applications [J]. Geosciences Journal, 2018,22(4):667-679.
[7] Barrett M E, Taylor S. Retrofit of storm water treatment controls in a highway environment [C]. The Fifth International Conference of Sustainable Techniques and Strategies in Urban Water Management, 2004:243-250.
[8] 王世林,龚延风,陈丽萍,等.地下水人工回灌过程中生物堵塞研究进展[J]. 科学技术与工程, 2019,19(34):25-31.
Wang S L, Gong Y F, Chen L P, et al. Advances in bioclogging during Artificial groundwater recharge [J]. Science Technology and Engineering, 2019,19(34):25-31.
[9] Baveye P, Vandevivere P, Hoyle B L, et al. Environmental impact and mechanisms of the biological clogging of saturated soils and aquifer materials [J]. Critical Reviews in Environmental Science and Technology, 1998,28(2):123.
[10] 姜桂华,廖资生,徐凌云,等.人工微生物脱氮过程中含水层堵塞问题的实验研究[J]. 长春科技大学学报, 1998,(2):3-5.
Jiang G H, Liao Z S, Xv L Y, Sun T. The experimental study on clogging of aquifer during the treatment of nitric pollution by synthetic microorganism [J]. Journal of Jilin University, 1998,(2):3-5.
[11] Bishop P. Biofilm structure and kinetics [J]. Wat. Sci. Tech., 1997, 36(1):287-294.
[12] Flemming H, Wingender J. The biofilm matrix [J]. Nature Reviews Microbiology, 2010,8(9): 623-633..
[13] Thullner M, Zeyer J, Kinzelbach W.Influence of microbial growth on hydraulic properties of pore networks [J]. Transport in Porous Media, 2002,49(1):99-122.
[14] Vandevivere P, Baveye P. Effect of bacterial extracellular polymers on the saturated hydraulic conductivity of sand columns [J]. Applied and environmental microbiology, 1992,58(5):1690-1698.
[15] 贺张伟.预处理方法对污泥厌氧耦合微生物电解及厌氧消化产能的影响[D]. 哈尔滨工程大学, 2014.
He Z W. Effects of pretreatment methods of excess sludge on energy yields by anaerobic coupled microbial electrolysis and anaerobic digestion [D] Harbin Engineering University, 2014.
[16] 陈园园,彭党聪.生物膜中EPS与微生物的分布及测定[J]. 中国给水排水, 2017,33(15):25-30,35.
Chen Y Y, Peng D C. Distribution and determination of EPS and microorganisms in biofilm [J]. China Water & Wastewater, 2017,33 (15):25-30,35.
[17] 张文静,秦运琦,刘 丹,等.微生物在多孔介质中环境行为研究 [J]. 中国环境科学, 2018,38(10):3975-3984.
Zhang W J, Qin Y Q, Liu D, et al. Transport behavior of microorganism in the porous media [J]. China Environmental Science, 2018,38(10):3975-3984.
[18] 徐国丹.再生水回灌下含水介质渗透性变化规律试验研究[D]. 西安:长安大学, 2018.
Xv G D. Experimental reaserch on the variation of permeability of aqueous media in the process of reclaimed water recharge [D].Xi’an: Chang’an University, 2018.
[19] 李 军,张翠云,蓝芙宁,等.区域地下水不同深度微生物群落结构特征[J]. 中国环境科学, 2019,39(6):2614-2623.
Li J, Zhang C Y, Lan F N, et al. Structure characteristics of microbial community at different depths of groundwater [J]. China Environmental Science, 2019,39(6):2614-2623.
[20] 沈 健,冯 晨,林允照,等.铜绿假单胞菌生物膜形成机制及耐药相关性[J]. 浙江预防医学, 2015,27(1):40-43.
Shen J, Feng C, Lin Y Z, et al. A study on the mechanism of biofilm formation of pseudomonas aeruginosa and its [J]. Preventive Medicine, 2015,27(1):40-43.
[21] 赵婧彤,冶雪艳,杜新强,等.不同浓度悬浮物颗粒在多孔介质中迁移特性研究[J]. 水利水电技术, 2019,50(10):25-31.
Zhao J T, Ye X Y, Du X Q, et al. Study on the migration characteristics of suspended particles inporous media during different concentration of suspension [J]. Water Resources and Hydropower Engineering, 2019,50(10):25-31.
[22] 李玉山.测定土壤水势的离心机法[J]. 土壤, 1981,(4):143-146.
Li Y S. Centrifuge method for determination of soil water potential [J]. Soils, 1981,(4):143-146.
[23] 邵明安.不同方法测定土壤基质势的差别及准确性的初步研究[J]. 土壤通报, 1985,(5):222-225.
Shao M A. A preliminary study on the difference and accuracy of different methods for measuring soil matrix potential [J]. Chinese Journal of Soil Science, 1985,(5):222-225.
[24] Van Genuchten M T. A closed-form equation for predicting the hydraulic conductivity of unsaturated soils [J]. Soil Sci Soc Am J, 1980,44(5):892-898.
[25] 郭向红,孙西欢,马娟娟.基于混合遗传算法估计van Genuchten方程参数[J]. 水科学进展, 2009,20(5):677-682.
Guo X H, Sun X H, Ma J J. Parametric estimation of the van Genuchten's equation based on hybrid genetic [J]. Advances in Water Science, 2009,20(5):677-682.
[26] 张亚娇,沈 超,李 韬,等.上海浅层粉性土弥散实验的室内研究[C]// 中国建筑学会工程勘察分会.第十五届全国工程物探与岩土工程测试学术大会论文集. 中国建筑学会工程勘察分会:中国建筑学会工程勘察分会, 2017:5.
Zhang Y J, Shen C, Li T, et al. Laboratory study on dispersion experiment of shallow silty soil in Shanghai [C]// Engineering Investigation Branch of Architectural Society of China. Proceedings of the 15th National Conference on Engineering Geophysical and Geotechnical Engineering Testing . Engineering Investigation Branch of Architectural Society of China: Engineering Investigation Branch of Architectural Society of China, 2017:5.
[27] Engesgaard P, Seifert D, Herrera P. Bioclogging in porous media: Tracer Studies [M]. Riverbank Filtration Hydrology. Netherlands: Springer, 2006.
[28] Cunningham A B, Characklis W G, Abedeen F, et al. Influence of biofilm accumulation on porous media hydrodynamics [J]. Environmental Science and Technology, 1991,25(7):1305–1311.
[29] Taylor S W, Jaffé P R. Jaffé. Biofilm growth and the related changes in the physical properties of a porous medium: 1. Experimental investigation [J]. Water Resources Research , 1990,26(9):2153-2159.
[30] Brough M J, Al-Tabbaa A, Martin R J.Active biofilm barriers for waste containment and bioremediation: laboratory assessment [J]. In Situ and On-site Bioremediation, 1997,4(4):233-238.
[31] Thullner M. Comparison of bioclogging effects in saturated porous media within one- and two-dimensional flow systems [J]. Ecological Engineering, 2008,36(2):176-196.
[32] Seifert D, Engesgaard P. Use of tracer tests to investigate changes in flow and transport properties due to bioclogging of porous media [J]. Journal of Contaminant Hydrology, 2007,93(1):58-71.
A study of microbial clogging on the variation of seepage characteristics with biofilm growth in porous medium.
WANG Qian-dan, LU Ying*, YANG Yue-suo, WU Yu-Hui, XU Zhe, PEI Zi-cheng
(Key Laboratory of Groundwater Resources and Environment, Ministry of Education, Jilin University, Changchun 130021, China)., 2022,42(6):2771~2778
The seepage characteristics of porous media varies with the inner biofilm growth irritated by recharge water during groundwater recharge. Indoor soil column experiments were conducted to stimulate the bio clogging process of porous media by continuous injection with nutrient solutions. Growth morphology biofilm and the corresponding seepage parameters of media (including permeability coefficient, water retention and dispersion coefficient) were measured over a series of time periods during experiments. The results showed that the permeability coefficient slightly decreased and rose in the first 5hours. In 5~18 hours, the permeability coefficient decreased sharply, and the hydraulic dispersion coefficient, and greatly increased, but the change of water holding capacity was not obvious. After 18hours, the decrease rate of the permeability coefficient slowed down, whist the water holding capacity began to increase rapidly, and the solute transport in the porous media transited be recharged by dominant mechanism of dispersion. To sum up, the clogging process by the growth of biofilm in the medium can be divided into three stages: (1) First stage is the adaptation period of bacteria, in which the inoculated bacteria did not dramatically grow and reproduce, and the permeability coefficient changed simply because of the retention and migration of bacteria cells; (2) Second stage is the period of mass growth and reproduction of bacteria, in which the increasing bacteria cells occupy more and more pore volume of medium, resulting the decrease in permeability and the increase in dispersion of the porous media; (3) Last stage is the period of extracellular polymer secretion, in which a permeable biofilm is gradually formed, and the growth and shedding of biofilm forms a dynamic balance with the nutrients provided by recharge water.
artificial groundwater recharge;bioclogging;biofilm;permeability coefficient;dispersion test;water characteristic curve
X172
A
1000-6923(2022)06-2771-08
王茜丹(1999-),女,吉林公主岭人,吉林大学硕士研究生,主要从事地下水回灌堵塞模拟研究
2021-11-18
吉林省自然科学基金项目(20210101092JC)
* 责任作者, 副教授, luying819@jlu.edu.cn
