己酸菌富集及其利用餐厨垃圾产己酸的研究
2022-06-29张艳艳白佳喆左剑恶
张艳艳,白佳喆,左剑恶,*
己酸菌富集及其利用餐厨垃圾产己酸的研究
张艳艳1,白佳喆2,左剑恶1,2*
(1.清华大学环境学院,环境模拟与污染控制国家重点联合实验室,北京 100084;2.清华大学深圳国际研究生院,广东 深圳 518055)
采用批式发酵的方式,考察3种不同电子供体(乙醇、乳酸、乙醇和乳酸)对己酸菌的富集情况,进而选取产己酸最优的混合菌,探究在不外加电子供体情况下,餐厨垃圾厌氧发酵产己酸的性能.结果表明:当以乙醇和乳酸共同作为电子供体时,己酸浓度可达(2303.06±499.56)mgCOD/L,产己酸效果最佳,并显著富集到了3种碳链延长菌:12(16.04%±0.16%),(28.78%±0.15%),(2.32%±0.03%);将产己酸最优的混合菌接种于餐厨垃圾进行厌氧发酵,己酸浓度最高可达(8657.36±996.21)mg COD/L,己酸产率为(230.05±26.47)mg COD/gVS,己酸选择度为27.74%±3.19%.以上结果验证了以乙醇和乳酸共同作为电子供体时对己酸菌具有明显的富集作用,富集到的混合菌可有效用于餐厨垃圾的产己酸发酵,为餐厨垃圾的资源化利用提供了理论支撑.
电子供体;己酸;餐厨垃圾;厌氧发酵
己酸是含有6个碳原子的饱和中链脂肪酸,是重要的工业原料和能源物质的前体物质[1].在工业领域,己酸可用于生产动物饲料[2]、食品香料[3]、医疗药物(如己酸孕酮)[4]等,是重要的生物基化学品.在能源领域,己酸可用于生产己烯和己烷等,用作汽车和飞机的燃料[5-6].目前,己酸的生产主要依赖于石油化工、天然动植物油脂提取,能耗大成本高[7].因此,探索一种经济环保的己酸生产方式拥有广阔的前景和现实意义.
近年来,一种利用碳链延长技术将有机废弃物转化为己酸的方式越来越受到研究者的关注.碳链延长技术的化学基础是逆β氧化反应,即通过特定的碳链延长微生物以特定的能源物质作为电子供体,以短链脂肪酸作为电子受体,在生物酶的催化下,将短链脂肪酸延长为中链脂肪酸(6~12个碳原子)的技术[8-10].每进行一次逆β氧化,短链脂肪酸会被增加两个碳原子.目前,可作为碳链延长反应的电子供体有很多,包括糖类、醇类、H2等,其中乙醇和乳酸是当前研究中最为成熟的两种电子供体,它们通过两步氧化生成乙酰辅酶A,作为逆β氧化反应中间体参与到碳链延长反应中去[11].另外,有研究表明,当乙醇和乳酸同时参与碳链延长反应时,可通过互相补充中间物、降低H2分压、减少碳流失等方式来提高己酸产量[12].目前应用于己酸生成的有机废弃物有很多,主要包括酿酒废水、乳清废水、木质纤维素、餐厨垃圾等[9].但是目前,大部分研究仍然依赖于外加电子供体来强化碳链延长反应的效果[13].
餐厨垃圾是一种极具资源化价值的有机废弃物,厌氧消化产甲烷是目前餐厨垃圾最主要的的资源回收方式[14-15].由于厌氧消化产甲烷技术存在体系稳定性差、产气率低、经济效益低等因素[16],越来越多的研究者致力于将餐厨垃圾通过碳链延长技术转化为比甲烷具有更高附加值的己酸的研究[17-18].选择合适的接种菌对于餐厨垃圾产己酸发酵具有关键作用,目前产己酸发酵的接种菌主要包括处理废水的剩余污泥、窖泥、酒曲、酒糟等[19].然而,目前关于如何富集己酸菌研究鲜有报道.另外,现有餐厨垃圾产己酸的研究大多数依赖于电子供体的添加,如Roghair等[13]将餐厨垃圾水解酸化液作为底物,添加乙醇进行碳链延长反应,获得了5.5g/ (L×d)的己酸产率.而在不外加电子供体条件下直接将餐厨垃圾转化为己酸的研究较为少见.
因此,本研究首先以批式发酵的方式,考察3种不同电子供体(乙醇、乳酸、乙醇和乳酸)对己酸菌的富集情况,并评估其产己酸性能;根据不同电子供体产己酸效能和微生物群落分析结果,以期获得产己酸效果最优的混合菌并用于后续餐厨垃圾的产己酸发酵,探究在不外加电子供体的情况下,餐厨垃圾厌氧发酵产己酸的性能.本研究从接种菌源、不依赖电子供体、效能评估3个方面探究餐厨垃圾厌氧产己酸可能性,为餐厨垃圾新的资源化方式提供理论支撑.
1 材料与方法
1.1 材料
餐厨垃圾取自山东省济南市某餐厨垃圾处理厂,主要组分为米饭、蔬菜、肉类、油脂等,经过分拣、破碎、除油、稀释等预处理后转运至实验室4℃保存.接种污泥取自该餐厨垃圾处理厂内长期用于厌氧消化产沼气的厌氧消化罐,转运至实验室4℃保存.实验过程中使用的配水为人工配置,其组份参考Leng等[20]的研究.餐厨垃圾和接种污泥的主要性质见表1.

表1 餐厨垃圾和接种污泥主要性质
1.2 实验方案和方法
1.2.1 己酸菌富集 采用批式发酵方式,共设置9个有效容积为500mL的厌氧瓶,每三个为一组平行,分别添加乙醇+乙酸、乳酸+乙酸、乙醇+乳酸+乙酸三种不同组合的底物,底物浓度参考Wu等[7]得出的最佳底物浓度的结果,并接种相同浓度的厌氧污泥,置于35℃的空气摇床中振荡(120r/min),运行35d.在发酵过程中,当底物不足时,及时补充.每隔3d取一次样品,用于后续发酵产物(挥发性脂肪酸(VFAs)、乳酸和乙醇)的检测,并调节pH值为5.5±0.1.其具体的实验设置和底物浓度见表2.

表2 实验设置
1.2.2 微生物群落分析 选取1.2.1中第35d的9个样品,对不同条件下富集的微生物群落进行分析,结合理化检测结果,筛选用于后续作为餐厨垃圾厌氧发酵的接种物.采用FastDNA®SPIN Kit for Soil试剂盒提取发酵样品DNA, 利用16S rRNA基因片段的通用引物(338F/806R)对16S rRNA片段的V3~V4区进行PCR扩增[20],通过上海美吉生物技术有限公司的Illumina MiSeq-PE250平台进行高通量测序.测序得到的原始数据经过质控、拼接、OTU聚类、数据库比对,获得每个样品的微生物群落组成结果,结合理化检测结果分析其相关性.其中,用于比对的数据库为Silva数据库(http://www.arb-silva.de).
1.2.3 餐厨垃圾厌氧发酵产己酸 选取1.2.1中产己酸效能最佳的一组厌氧混合菌作为接种物,用于餐厨垃圾厌氧发酵产己酸.采用批式发酵的方式,设置3个有效容积为500mL的厌氧瓶,以餐厨垃圾为底物(213mL, 18.82g VS),取LA_ET中第35d的混合菌离心(8000r/min, 10min)和清洗,称取6g,接种于餐厨垃圾,添加配水至500mL,置于35℃的空气摇床中振荡(120r/min),运行30d.每隔3d取一次样品(2mL),用于检测发酵产物(VFAs、乳酸和乙醇)的浓度,并调节pH值于5.5±0.1.
1.3 常规指标及检测方法
总固体含量(TS)、挥发性固体含量(VS)、总化学需氧量(TCOD)、溶解性化学需氧量(SCOD)、pH值的检测方法参照参照APHA[21].C、N等元素分析采用元素分析仪(SENSE EDX-1050)测定.7种挥发性脂肪酸(VFAs),包括乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸和正己酸,以及乙醇采用气相色谱仪(GC,岛津GC-2010)检测,检测条件为:DB-WAX色谱柱(30m×0.32mm×0.25mm),氢火焰检测器(FID),以高纯氮气为载气.乳酸采用高效液相色谱仪(HPLC,岛津,LC-20A)检测,检测条件为:HSS T3色谱柱(4.6mm×150mm,5 μm),浓度为20mmol/L KH2PO4的流动相,流速为0.5mL/min,柱温30℃.总蛋白质和总脂肪含量分别采用凯氏定氮法和索氏提取法进行测定[4-5],总碳水化合物采用苯酚-硫酸法测定[22].
1.4 数据处理
餐厨垃圾水解率(%)为发酵液中SCOD与最初投入餐厨垃圾的TCOD的比值;餐厨垃圾酸化率(%)为发酵液中累积的总挥发性脂肪酸(TVFAs)与发酵液中SCOD的比值,其中TVFAs浓度需要转化为以COD作为计量单位[23].
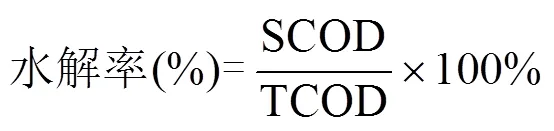
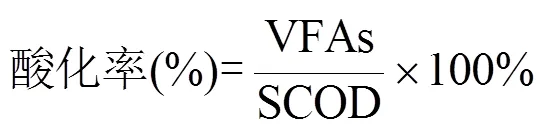
式中的SCOD为发酵液中溶解性COD量;TCOD为试验启动时投入的底物总COD量;TVFAs为发酵液种所有VFAs浓度的总和.
己酸产率(mg COD/gVS)为己酸产量(mg COD)与投入的餐厨垃圾VS(g)的比值.
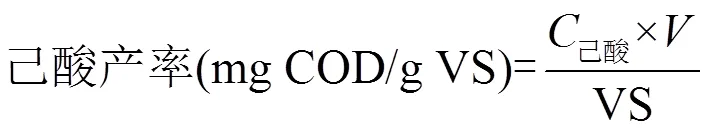
式中:己酸为发酵液中己酸浓度(mg COD/L)
己酸选择度(%)为发酵液中己酸所占的碳源与总VFAs的碳源的比值[24].

式中:己酸为发酵液中己酸的碳物质的量浓度(mol/ L);θ为发酵液中所检测到的VFAs(乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸、正己酸)的碳物质的量浓度(mol/L);=8.
2 结果与讨论
2.1 不同电子供体条件下厌氧发酵产物分析
以不同电子供体作为底物厌氧发酵的产物分布如表3所示.由结果可以看出,当以乙醇作为单一的电子供体时,仅在第10d检测到了少量的己酸产生,浓度为(94.36±24.72)mg COD/L,此后25d没有检测到己酸.整个发酵过程中,正丁酸为主要的发酵产物,在第32d时最高浓度达到了(3107.83±1111.36)mg COD/L.另外,发酵液中剩余了大量未被利用的乙醇和乙酸.本次批式试验中,未检测到丙酸和戊酸的产生.实验结果表明,接种的厌氧混合菌没有适应以乙醇作为底物的碳链延长反应,只有少量的乙醇参与逆β氧化反应转化为了丁酸.另外,乙酸含量呈现先降低后升高的趋势,第15d降至最低,浓度为(1843.542±321.03)mg COD/L,随后开始逐渐升高,第26d达到最高((3582.79±1042.58) mg COD/L),可推测,部分乙醇被氧化为乙酸,造成了乙酸的积累.该过程涉及的反应见反应式(5)~(7).反应器中的丁酸没有进一步延长为己酸的原因与醇酸比、底物浓度等有直接关系,同时乙醇浓度过高对微生物会产生毒性[25].
CH3CH2OH+H2O→CH3COO-+H++2H2(5)
6CH3CH2OH+4CH3COO-→5CH3(CH2)2COO-+
H++2H2+4H2O(6)
6CH3CH2OH+5CH3(CH2)2COO-→CH3COO-+
5CH3(CH2)4COO-+H++2H2+4H2O (7)
CH3CHOHCOO-+H2O→CH3COO-+2H2+CO2(8)
CH3CHOHCOO-+CH3COO-+H+→CH3(CH2)2COO-+
H2O + CO2(9)
CH3CHOHCOO-+CH3(CH2)4COO-+H+→
CH3(CH2)4COO-+ H2O + CO2(10)
4H2+2CO2→CH3COO-+H++2H2O(11)
2H2+CH3COO-+H+→CH3CH2OH+H2O(12)

表3 不同电子供体条件下发酵产物浓度变化
注:“–”表示该实验组不涉及此项内容.
当以乳酸作为单一的电子供体时,乳酸和乙酸消耗较快,第26d时乳酸浓度由最初的9630mg COD/L(100mM)降为0,乙酸浓度从3210mg COD/L (50mM)降至(1368.57±419.19)mg COD/L,为了实验的持续性,本实验组及时补充了乳酸和乙酸,浓度与实验初始浓度相同.从结果可以看出,正丁酸为主要发酵产物,最高浓度可达(9362.83±1083.13)mg COD/ L.整个发酵过程,仅在第10d、第26d、第29d检测到了少量己酸的存在,其浓度分别为(66.94±14.29), (62.67±13.95),(45.92±97.41)mg COD/L.本实验中,绝大部分乳酸作为电子供体生成了正丁酸,己酸产量很少,说明在以乳酸作为单一的电子供体进行碳链延长时,反应体系更倾向于产丁酸,而非己酸,这与部分研究结果比较一致[26-27].乳酸作为电子供体时,经两步氧化先转化为乙酰辅酶A,然后参与逆β氧化进行碳链延长[28].当乳酸逐渐被消耗,丁酸浓度趋于稳定后,乳酸提供不了足够的能量支持逆β氧化的进行,乙酰辅酶A与乙酸生成丁酸后不再继续碳链的延伸,造成了丁酸的积累.该过程涉及的反应过程见反应式(8)~(10).
当以乙醇和乳酸同时作为电子供体时,从第10d开始,检测到少量己酸生成,浓度为(102.36± 16.85)mg COD/L,随着发酵的进行,己酸含量逐渐增加,到第35d时己酸含量达到最高水平,浓度为(2303.06±499.56)mg COD/L.除了己酸,正丁酸也是主要的产物之一,最高浓度可达(5283.94±820.34)mg COD/L.其中,乳酸消耗较快,第26d时及时补充了乳酸.本研究结果表明,乙醇和乳酸同时作为电子供体时能够显著提高己酸的产量.已有研究报道,以乙醇作为电子供体的碳链延长微生物利用CO2为碳源合成细胞体,当乳酸被氧化为丙酮酸时生成的CO2为碳链延长微生物提供了必要的碳源;另外,乙醇代谢产生的H2可以与CO2产生乙酸,进而被还原为乙醇,参与碳链延长反应,乙醇和乳酸通过互相补充中间代谢物的方式提高了己酸的产量[29],该过程涉及的反应见反应式(5)~(12).
2.2 不同电子供体对己酸菌的富集结果分析
为了进一步揭示不同电子供体对己酸菌的富集情况,本研究对2.1中三种不同条件下的微生物群落进行分析.通过16S rRNA基因测序,共获得1022059条优化序列,利用OTU聚类分析(97%相似性)得到602个OTU.每组的多样性指数如表4所示.Coverage指数代表了测序过程中文库的覆盖率[30],本次测序的覆盖率均在99%以上,说明测序深度足够反映样品微生物群落的实际情况,测序结果可信.Chao1指数和ACE指数代表样品的微生物物种丰富度,Shannon指数和Simpson代表将微生物物种丰富度和均匀度考虑在内的物种多样性[31].从结果可以得知,当乙醇作为电子供体(ET)时富集的微生物群落多样性(OTU数量、Chao1指数和ACE指数)高于(<0.05)其他两种实验组(LA和LA_ET),但从Simpsom指数和Shannon指数来看,三者之间的差异并不显著,说明三种条件下富集到的微生物多样性差异较大,但其物种均匀度不存在显著差异.

表4 不同电子供体条件下微生物群落多样性指数
由图1(a)可见,9个样品共检测到了4种优势门类(³1%),分别为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、热孢菌门(Thermotogae)、拟杆菌门(Bacteroidetes).其中LA组和LA_ET组具有相似的门类菌组成,Firmicutes含量最高,丰度分别为(69.13±12.78)%和(70.95±5.07)%,而ET组中Firmicutes含量为(19.62±5.08)%,说明单独的乙醇作为电子供体厌氧发酵不利于Firmicutes的富集.根据已有研究报道,绝大多数的碳链延长微生物属于Firmicutes,只有少数属于Proteobacteria[8](本研究中未检测出).因此,Firmicutes的相对丰度与发酵体系的产己酸性能有着紧密的关系.Actinobacteria是ET组中丰度最高(32.84%±1.12%)的门类菌,在LA (15.16%±11.16%)和LA_ET(13.73%±1.53%)中仅次于Firmicutes.根据报道,Actinobacteria是厌氧发酵体系中常被检测到的水解酸化菌,它分泌的水解酶可以将大分子有机物分解为可溶性小分子物质[32].一些研究表明,部分属于Actinobacteria的微生物有助于四氢叶酸的产生,对己酸菌的生长有间接的促进作用[33].另外两种优势菌门Thermotogae和Bacteroidetes是常见的厌氧酸化菌,其中, Thermotogae可以将丁酸分解为乙酸和氢气,Bacteroidetes可以将碳水化物和蛋白质转化为短链脂肪酸(丙酸和乙酸)等[34-35].
图1(b)为属水平上相对丰度高于1%的微生物在三种发酵体系中的富集结果.本研究共检测到了10种优势属,其中有3类属于碳链延长菌:12,,,与己酸的产生有直接的关系.12和在很多研究中被报道能够以乙醇作为电子供体进行碳链延长反应,是较为常见的碳链延长微生物[29,36-38].是近年来发现的以乳酸作为电子供体的碳链延长菌[17],是本研究中发现的最主要的己酸菌.从结果可以看出,以乙醇和乳酸共同作为电子供体(LA_ET)时,富集的己酸菌最多,包括12(16.04%±0.16%),(28.78%±0.15%),(2.32%±0.03%).以乳酸作为电子供体(LA)时富集的己酸菌以12(33.52%±0.28%)为主,但在本研究中添加的乳酸不足以驱动两轮的碳链延长反应,最终产物以丁酸为主.在以乙醇作为电子供体(ET)时,己酸菌丰度(5.94%±3.15%)非常少,主要以12(4.80%±2.78%)为主,因此,ET反应器中己酸含量最少,只有少量正丁酸产生.另外,在ET中丰度最高的和是污泥中常被检测到的水解酸化菌,对发酵前期底物的降解具有重要作用[39-41].
基于OTU物种的Anosim分析如图1(c)所示,结果可以看出组间差异显著高于组内差异(<0.01),从统计学层面可以说明该分组是合理的,进一步说明不同的电子供体富集的微生物物种具有显著差异性.RDA(redundancy analysis)分析考察不同电子供体条件下微生物群落与理化性质的相关性,如图1(d)所示.结果显示,和12是对反应体系影响最大的两个因子(箭头越长,影响越大).主要在LA_ ET中富集,且与己酸正相关性最强,可以说明LA_ ET中主要的己酸菌为.根据2.1结果得知,LA中的主要发酵产物为正丁酸,从RDA分析结果可以看出,与正丁酸相关性最强的菌属为12,主要在LA中富集,说明12是最主要的产丁酸菌.对于ET分组,己酸菌富集较少,且在ET中富集的微生物与己酸相关性较弱甚至呈负相关.因此,根据不同电子供体条件下厌氧发酵结果可以得出,当以乙醇和乳酸共同作为电子供体(LA_ET)时,对己酸菌具有明显的富集作用.
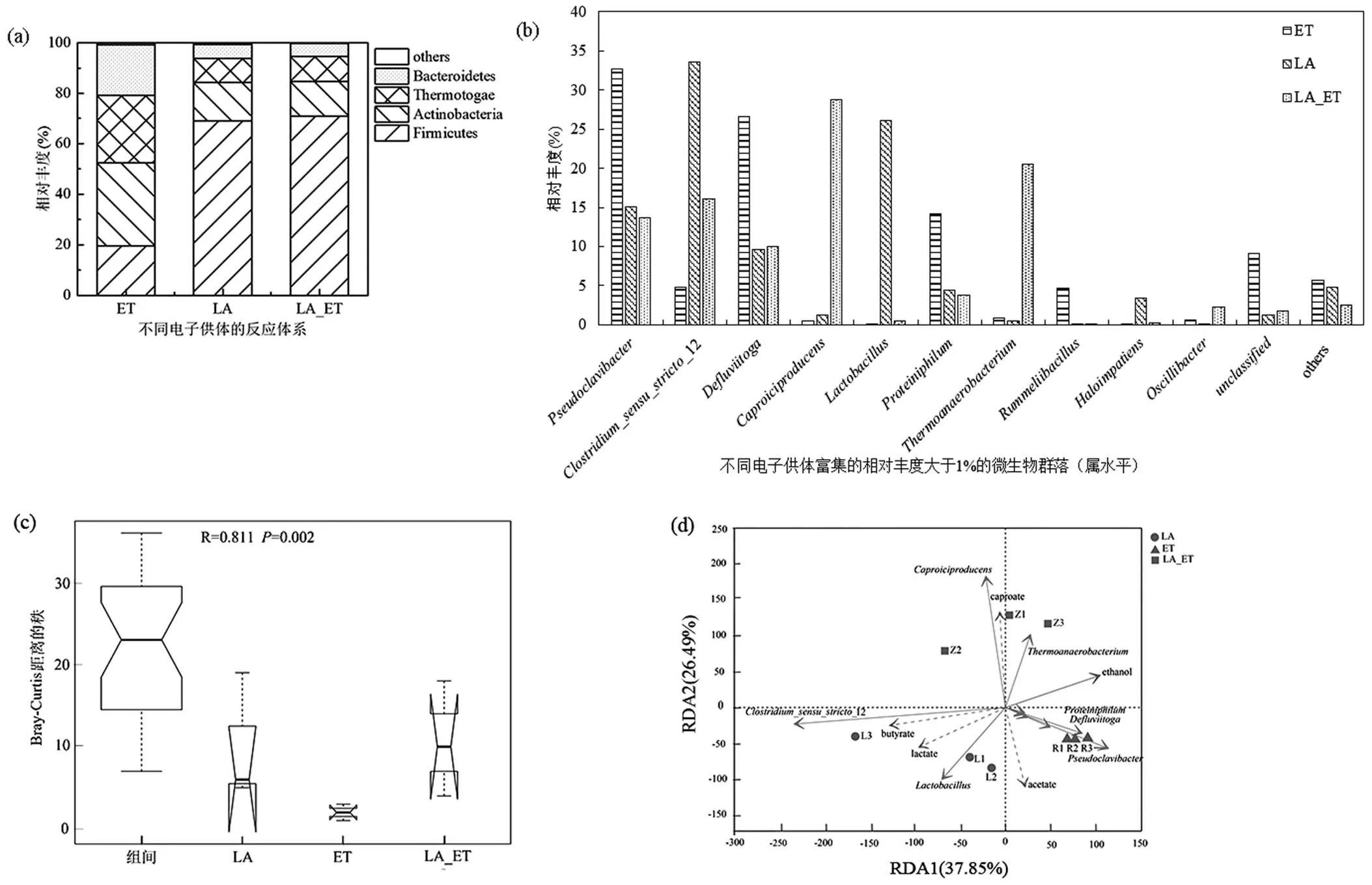
图1 不同电子供体条件下富集的微生物群落分析结果
(a)门水平优势菌(³1%)在不同反应体系中的分布;(b)属水平优势菌(³1%)在不同反应体系中的富集结果;(c)基于OTU分类水平的不同条件下微生物群落差异性Anosim分析结果;(d)基于优势菌属(³1%)的RDA分析结果(虚线箭头代表不同的理化性质,实线箭头代表优势菌属,不同形状的图形代表不同分组的样品,圆形代表LA,三角形代表ET,正方形代表LA_ET)
2.3 富集的混合菌在餐厨垃圾厌氧发酵中的应用
图2(a)是将2.1中LA_ET中的混合菌接种于餐厨垃圾进行厌氧发酵的结果.可以看出,发酵产物以正丁酸和己酸为主,其他VFAs产物含量较少.随着发酵的进行,己酸浓度逐渐增加,第27d时最高浓度可达(8657.36±996.21)mg COD/L.而正丁酸含量在第6d达到最高水平,浓度为(25874.05± 7757.83)mg COD/L,随后逐渐下降,在第21d和第24d有略微上升.从第24d开始直到发酵结束,正丁酸浓度逐渐下降至(17070.83±192.02)mg COD/L,此过程伴随着己酸浓度的上升,说明在发酵过程中部分正丁酸逐渐向己酸转化.另外,在本研究中检测到了乙醇和乳酸的产生.发酵第3d乙醇含量达到最高水平,浓度为(4168.84±636.13)mg COD/L,随着发酵的进行,乙醇浓度逐渐下降,第21d时完全消失,推测乙醇在发酵过程中作为电子供体逐渐被碳链延长菌消耗.与乙醇相比,乳酸的产生量较少,一直低于100mg COD/L.图2(b)为餐厨垃圾在发酵过程中的水解酸化结果,可以看出整个发酵过程水解酸化程度相对较为充分,从第3d开始水解率始终在80%以上,从第6d开始,酸化率在60%~90%范围之间波动.研究结果可以看出,在不外加电子供体的情况下,以餐厨垃圾为底物进行碳链延长反应时,虽然水解酸化较为充分,但却未能提供充足的电子供体(乙醇和乳酸),绝大部分底物以生成丁酸为主要产物,没有再进一步生成己酸.很多研究表明,当电子供体不足时,反应体系不能够提供足够的能量驱动碳链延长反应的持续进行,从而造成丁酸的积累[25,42-43].另外,正丁酸的存在同时意味着反应体系具有较大的产己酸潜力,通过碳链延长反应将积累的丁酸转化为己酸为进一步提高产己酸效率提供了一条新思路.目前,不外加电子供体情况下,将餐厨垃圾直接转化为己酸的研究较少,单纯依靠餐厨垃圾的水解酸化生成充足的电子供体和电子受体进行碳链延长反应,仍然是餐厨垃圾厌氧发酵产己酸面临的挑战[17-18,44].

图2 餐厨垃圾厌氧发酵产物浓度变化(a)和水解酸化程度(b)

图3 餐厨垃圾厌氧发酵过程中己酸产率(a)和己酸选择度(b)变化
由图3可以看出,在发酵过程中,己酸产率逐渐升高,在第27d时最高可达(230.05±26.47)mg COD/g VS.Isaac等[45]以餐厨垃圾进行以总VFAs为目标产物的发酵时,总VFAs产率为305mg COD/g VS,己酸所占的比例不足10%,低于本研究结果.当反应体系中VFAs过度积累,会对微生物的活性产生抑制作用,导致底物转化率降低[45].在发酵过程中,总VFAs中己酸所占的碳源比例用选择度来表示.从图3(b)可以看出,己酸选择度从第3d开始逐渐升高,最高达到27.74%±3.19%,且从第18d开始直到发酵结束,己酸选择度在较小的范围内(21.34%~27.74%)波动,说明己酸的产生从第18d开始保持在一个比较稳定的状态.Contreras-Davila等[17]利用餐厨垃圾厌氧发酵产己酸时,其己酸选择度最高可达38%,高于本研究结果.己酸选择度表明了己酸在发酵产物(VFAs)中碳源占比,反映了在底物水解酸化彻底后,碳链延长菌在反应系统中的活跃度,当碳链延长反应足够充分时,会有更多的短链脂肪酸向己酸转化,己酸选择度变大;当碳链延长反应不够充分时,会导致短链脂肪酸的累积,己酸选择度降低.
3 结论
3.1 当乙醇和乳酸共同作为电子供体时,产己酸效果最佳,对己酸菌具有明显的富集作用;当乙醇和乳酸分别作为单一电子供体时,产物以正丁酸为主,不利于己酸菌富集.
3.2 乙醇和乳酸共同作为电子供体时,可显著富集三种己酸菌:(28.78%±0.15%),12(16.04%±0.16%),(2.32%±0.03%),其中,与己酸相关性最强,是富集到的最主要的己酸菌.
3.3 经己酸菌富集的污泥可在不外加电子供体的情况下,有效用于餐厨垃圾产己酸发酵,己酸浓度最高达到(8657.36±996.21)mg COD/L,己酸产率和选择度可达(230.05±26.47)mg COD/g VS和(27.74± 3.19)%.
[1] De Groof V, Coma M, Arnot T, et al. Medium chain carboxylic acids from complex organic feedstocks by mixed culture fermentation [J]. Molecules, 2019,24(3),doi:10.3390/molecules24030398.
[2] Zentek J, Buchheit-Renko S, Ferrara F, et al. Nutritional and physiological role of medium-chain triglycerides and medium-chain fatty acids in piglets [J]. Animal Health Research Reviews, 2011, 12(1):83-93.
[3] Xu Y, Zhao J, Liu X, et al. Flavor mystery of Chinese traditional fermented baijiu: the great contribution of ester compounds [J]. Food Chemistry, 2021,369:doi:10.1016/j.foodchem.2021.130920.
[4] Jiang X, Tang F, Feng Y, et al. The adjustment of 17- hydroxyprogesterone cut-off values for congenital adrenal hyperplasia neonatal screening by GSP according to gestational age and age at sampling [J]. Journal of pediatric endocrinology & metabolism, 2019,32(11):1253-1258.
[5] Urban C, Xu J J, Strauber H, et al. Production of drop-in fuels from biomass at high selectivity by combined microbial and electrochemical conversion [J]. Energy & Environmental Science, 2017,10(10):2231- 2244.
[6] Harvey B G, Meylemans H A. 1-Hexene: a renewable C6platform for full-performance jet and diesel fuels [J]. Green Chemistry, 2014, 16(2):770-776.
[7] 吴清莲.乙醇和乳酸引导的碳链增长技术生产中链羧酸的研究[D]. 哈尔滨:哈尔滨工业大学, 2019.
Wu Q L. Study on medium chain carboxylic acid production from chain elongation technology induced by ethanol and lactate [D]. Harbin: Harbin Institute of Technology, 2019.
[8] Angenent L T, Richter H, Buckel W, et al. Chain elongation with reactor microbiomes: open-culture biotechnology to produce biochemicals [J]. Environmental Science & Technology, 2016,50(6): 2796-2810.
[9] Wu Q, Bao X, Guo W, et al. Medium chain carboxylic acids production from waste biomass: Current advances and perspectives [J]. Biotechnology Advances, 2019,37(5):599-615.
[10] Agler M T, Wrenn B A, Zinder S H, et al. Waste to bioproduct conversion with undefined mixed cultures: the carboxylate platform [J]. Trends in Biotechnology, 2011,29(2):70-78.
[11] Kumar A N, Omprakash S, Chandrasekhar K, et al. Upgrading the value of anaerobic fermentation via renewable chemicals production: A sustainable integration for circular bioeconomy [J]. Science of the Total Environment, 2022,806,doi:10.1016/j.scitotenv.2021.150312.
[12] Wu Q L, Guo W Q, Bao X, et al. Upgrading liquor-making wastewater into medium chain fatty acid: Insights into co-electron donors, key microflora, and energy harvest [J]. Water Research, 2018,145:650-659.
[13] Roghair M, Liu Y C, Strik D, et al. Development of an Effective Chain Elongation Process From Acidified Food Waste and Ethanol Into n-Caproate [J]. Frontiers in Bioengineering and Biotechnology, 2018, 6,doi:10.3389/fbioe.2018.00050.
[14] 王凯军,王婧瑶,左剑恶,等.我国餐厨垃圾厌氧处理技术现状分析及建议[J]. 环境工程学报, 2020,14(7):1735-1742.
Wang K J, Wang J Y, Zuo J E, et al. Analysis and suggestion ofcurrent food waste anaerobic digestion technology in China [J]. Chinese Journal of Environmental Engineering, 2020,14(7):1735-1742.
[15] 张靖雪,李盼盼,于 洋,等.基于固液分离预处理的餐厨垃圾厌氧发酵 [J]. 中国环境科学, 2022,42(3):1252-1258.
Zhang J X, Li P P, Yu Y, et al. Study on anaerobic digestion of kitchen waste based on solid-liquid separation pretreatment [J]. China Environmental Science, 2022,42(3):1252-1258.
[16] 石 川,刘 越,马金元,等.碳链延长技术在有机资源回收领域的研究进展[J]. 中国环境科学, 2020,40(10):4439-4448.
Shi C, Liu Y, Ma J Y, et al. Review on research progress of anaerobic microbial chain elongation in organic waste treatment [J]. China Environmental Science, 2020,40(10):4439-4448.
[17] Contreras-Davila C A, Carrion V J, Vonk V R, et al. Consecutive lactate formation and chain elongation to reduce exogenous chemicals input in repeated-batch food waste fermentation [J]. Water Research, 2020,169,doi:10.1016/j.watres.2019.115215.
[18] Nzeteu C O, Trego A C, Abram F, et al. Reproducible, high-yielding, biological caproate production from food waste using a single-phase anaerobic reactor system [J]. Biotechnology for Biofuels, 2018,11,doi: 10.1186/s13068-018-1101-4.
[19] 郭志超,徐先宝,徐婷婷,等.接种不同菌源的餐厨垃圾发酵代谢途径及产己酸效能分析 [J]. 环境工程, 2021,39(9):160-168.
Guo Z C, Xu X B, Xu T T, et al. Analysis on fermentation pathway and caproate production from food waste by different inoculum [J]. Environmental Engineering, 2021,39(9):160-168.
[20] Leng L, Yang P X, Mao Y P, et al. Thermodynamic and physiological study of caproate and 1,3-propanediol co-production through glycerol fermentation and fatty acids chain elongation [J]. Water Research, 2017,114:200-209.
[21] Xiao J, Huang J, Huang M, et al. Application of basalt fiber in vertical flow constructed wetland for different pollution loads wastewater: Performance, substrate enzyme activity and microorganism community [J]. Bioresource Technology, 2020,318,doi:10.1016/ j.biortech.2020.124229.
[22] APHA, Standard methods for the examination of water and wastewater [S].
[23] 李芸溪.餐厨垃圾资源化产短链/中链羧酸[D]. 哈尔滨:哈尔滨工业大学, 2020.
Li Y X. Short chain/medium chain carboxylic acid was produced from food waste [D]. Harbin: Harbin Institute of Technology, 2020.
[24] Wu Q L, Guo W Q, Zheng H S, et al. Enhancement of volatile fatty acid production by co-fermentation of food waste and excess sludge without pH control: The mechanism and microbial community analyses [J]. Bioresource Technology, 2016,216,653-660.
[25] Zagrodnik R, Duber A, Lezyk M, et al. Enrichment versus bioaugmentation-microbiological production of caproate from mixed carbon sources by mixed bacterial culture and clostridium kluyveri [J]. Environmental Science & Technology, 2020,54(9):5864-5873.
[26] Liu Y, Lü F, Shao L, et al. Alcohol-to-acid ratio and substrate concentration affect product structure in chain elongation reactions initiated by unacclimatized inoculum [J]. Bioresource Technology, 2016,218:1140-1150.
[27] 王 冰.餐厨垃圾厌氧发酵产中链脂肪酸的研究[D]. 哈尔滨:哈尔滨工业大学, 2019.
Wang B. Study on medium chain fatty acids production from food waste anaerobic fermentation [D]. Harbin: Harbin Institute of Technology, 2019.
[28] Zhang Y Y, Pan X R, Zuo J, et al. Production of n-caproate using food waste through thermophilic fermentation without addition of external electron donors [J]. Bioresource Technology, 2022,343,doi:10.1016/ j.biortech.2021.126144.
[29] Zhu X Y, Tao Y, Liang C, et al. The synthesis of n-caproate from lactate: a new efficient process for medium-chain carboxylates production [J]. Scientific Reports, 2015,5:doi:10.1038/srep14360.
[30] Wu Q L, Guo W Q, Bao X, et al. Upgrading liquor-making wastewater into medium chain fatty acid: Insights into co-electron donors, key microflora, and energy harvest [J]. Water Research, 2018,145:650-659.
[31] Rodriguez-R L M, Konstantinidis K T. Estimating coverage in metagenomic data sets and why it matters [J]. Isme Journal, 2014, 8:2349-2351.
[32] Sinclair L, Osman O A, Bertilsson S, et al. Microbial community composition and diversity via 16S rRNA gene amplicons: evaluating the illumina platform [J]. PloS one,2015,10(2),doi:10.1371/journal. pone.0116955.
[33] Chen Y, Jiang X, Xiao K, et al. Enhanced volatile fatty acids (VFAs) production in a thermophilic fermenter with stepwise pH increase – Investigation on dissolved organic matter transformation and microbial community shift [J]. Water Research, 2017,112:261-268.
[34] Yu J, Huang Z, Wu P, et al. Performance and microbial characterization of two-stage caproate fermentation from fruit and vegetable waste via anaerobic microbial consortia [J]. Bioresource Technology, 2019,284:398-405.
[35] Lykidis A, Chen C L, Tringe S G, et al. Multiple syntrophic interactions in a terephthalate-degrading methanogenic consortium [J]. ISME Journal, 2011,5(1):122-130.
[36] Liu Y, Li X, Kang X, et al. Short chain fatty acids accumulation and microbial community succession during ultrasonic-pretreated sludge anaerobic fermentation process: Effect of alkaline adjustment [J]. International Biodeterioration & Biodegradation, 2014,94:128-133.
[37] Candry P, Huang S, Carvajal-Arroyo J M, et al. Enrichment and characterisation of ethanol chain elongating communities from natural and engineered environments [J]. Scientific Reports, 2020,10(1):doi: 10.1038/s41598-020-60052-z.
[38] Wu S L, Luo G, Sun J, et al. Medium chain fatty acids production from anaerobic fermentation of waste activated sludge [J]. Journal of Cleaner Production, 2021,279,doi:10.1016/j.jclepro.2020.123482.
[39] Fu X D, Ye R, Jin X, et al. Effect of nano zero-valent iron addition on caproate fermentation in carboxylate chain elongation system [J]. Science of the Total Environment, 2020,743,doi:10.1016/j.scitotenv. 2020.140664
[40] Rocha-Arriaga C, Espinal-Centeno A, Martinez-Sanchez S, et al. Deep microbial community profiling along the fermentation process of pulque, a biocultural resource of Mexico [J]. Microbiological Research, 2020,241,doi:10.1016/j.micres.2020.126593.
[41] 鲁少文,魏翠翠,李泽华,等.新型己酸菌强化对人工窖泥培养过程中原核微生物群落结构及酸、酯含量的影响[J]. 应用与环境生物学报, 2020,26(1):144-151.
Lu S W, Wei C C, Li Z H, et al. Effects of a new caproic acid-producing bacteria on prokaryotic community structure and the content of acid and ester during the culture of artificial pit mud [J]. China Journal Applied Environmental Biology, 2020,26(1):144-151.
[42] Maus I, Koeck D E, Cibis K G, et al. Unraveling the microbiome of a thermophilic biogas plant by metagenome and metatranscriptome analysis complemented by characterization of bacterial and archaeal isolates [J]. Biotechnology for Biofuels, 2016,9,doi:10.1186/s13068- 016-0581-3.
[43] 余江南,刘春梅,黄振兴,等.果蔬废弃物两相厌氧发酵产己酸的效能研究[J]. 基因组学与应用生物学, 2020,39(1):232-240.
Yu J N, Liu C M, Huang Z X, et al. Two-phase caproate fermentation from fruit and vegetable waste [J]. Genomics and Applied Biology, 2020,39(1):232-240.
[44] Lonkar S, Fu Z H, Holtzapple M. Optimum alcohol concentration for chain elongation in mixed-culture fermentation of cellulosic substrate [J]. Biotechnology and Bioengineering, 2016,113(12):2597-2604.
[45] Crognale S, Braguglia C M, Gallipoli A, et al. Direct conversion of food waste extract into caproate: Metagenomics assessment of chain elongation process [J]. Microorganisms, 2021,9(2):doi:10.3390/ microorganisms9020327.
[46] Owusu-Agyeman I, Plaza E, Cetecioglu Z. Production of volatile fatty acids through co-digestion of sewage sludge and external organic waste: Effect of substrate proportions and long-term operation [J]. Waste Management, 2020,112:30-39.
致谢:本论文的英文摘要部分由深圳职业技术学院王丝可博士和清华大学博士生Sanjena Naray anasamydamodaran协助修改完成,在此表示感谢.
Enrichment of caproate bacteria and its application in caproic acid production from food waste.
ZHANG Yan-yan1, BAI Jia-zhe2, ZUO Jian-e1,2*
(1.State Key Joint Laboratory of Environmental Simulation and Pollution Control, School of Environment, Tsinghua University, Beijing 100084, China;2.Tsinghua Shenzhen International Graduate School, Shenzhen 518055, China)., 2022,42(6):2724~2733
This study investigated three different electron donor combinations to attain maximum enrichment of caproic acid bacteria and the ability of these enriched bacteria to further digest food waste without the addition of external electron donors. Three batch experiments were performed using ethanol, lactate, and ethanol plus lactate as electron donors. The results showed that the highest concentration of caproic acid ((2303.06±499.56) mg COD/L) was reached when ethanol and lactate were both used as electron donors which was justified by the significant increase in the microbial population of caproate bacterial genera such as12 (16.04%±0.16%),(28.78%±0.15%) and(2.32%±0.03%). When this enriched culture was inoculated to food waste, the maximum concentration of caproate reached (8657.36±996.21) mg COD/L, and the caproic acid yield and specificity were (230.05±26.47) mg COD/g VS and 27.74%±3.19% respectively. This study proved that caproic acid bacteria are significantly enriched in the presence of the electron donor combination of ethanol and lactate, and that the enriched inoculum can promote caproic acid production from food waste. These results provide theoretical support for the recovery of resources from food waste.
electron donors;caproic acid;food waste;anaerobic fermentation
X705
A
1000-6923(2022)06-2724-10
张艳艳(1991-),女,山东潍坊人,清华大学博士研究生,主要研究方向为餐厨垃圾厌氧发酵.发表论文1篇.
2021-12-01
国家重点研发计划项目(2017ZX07103-007)
* 责任作者, 教授, jiane.zuo@mail.tsinghua.edu.cn
