立体定向脑电图在磁共振成像阴性中央区药物难治性癫痫中的应用价值
2022-06-29王玉根张光明孟大伟陈建伟陈国强
王玉根,张光明,孟大伟,陈建伟,陈国强
在中央区药物难治性癫痫的手术治疗中,既要求最大限度地切除致痫灶,又需要减轻术后神经功能缺损,因此中央区药物难治性癫痫的手术治疗对神经外科医生极具挑战[1-2]。目前对于中央区药物难治性癫痫的术前评估,需要通过癫痫发作的症状和头皮脑电图(electroencephalography,EEG)、颅脑磁共振成像(magnetic resonance imaging,MRI)、脑磁图、正电子发射计算机断层扫描成像(positron emission tomography-computed tomography,PET-CT)等无创性检查综合定位致痫灶,但对于MRI阴性中央区药物难治性癫痫上述方法却无法精确定位致痫灶和功能区。近年来,立体定向脑电图(stereoelectroencephalography,SEEG)因其能够精准植入电极并精确定位致痫灶和功能区等优势,在药物难治性癫痫的术前评估中得到了广泛的应用,但其在MRI阴性中央区药物难治性癫痫中的应用尚未见报道。为此,本研究回顾性分析了采用SEEG对MRI阴性中央区药物难治性癫痫定位致痫灶并完成手术治疗患者的临床资料,以探讨SEEG在MRI阴性中央区药物难治性癫痫术前评估中的应用价值。
1 对象与方法
1.1 研究对象 回顾性选取2016年1月至2021年12月北京航空总医院神经外科收治的采用SEEG定位致痫灶并完成手术治疗的MRI阴性中央区药物难治性癫痫患者10例,其中男7例,女3例;年龄9~30岁,平均(19.0±7.9)岁;病程4~22年,平均(9.9±5.7)年;10例患者的颅脑MRI均表现为阴性,10例患者的临床资料见表1。本研究通过北京航空总医院伦理委员会审核批准(2016111581671076)。

表1 10例MRI阴性中央区药物难治性癫痫患者的临床资料Table 1 Clinical data of 10 patients with MRI-negative drug-resistant epilepsies in central region
1.2 Ⅰ期术前评估 根据患者临床资料,包括首发症状、症状学、发作起源、影像学资料(颅脑MRI或PET-CT检查结果)等,由多学科团队讨论进行Ⅰ期术前评估,10例患者Ⅰ期术前评估均不能精确定位致痫灶,需要植入颅内电极,根据Ⅰ期术前评估结果确定颅内电极的覆盖区域并设计电极植入方案。
1.3 大脑中央区初步定位 SEEG术前应用3.0T MRI(西门子)进行薄层扫描,扫描序列包括3D序列(1 mm3)、T1序列、三维液体衰减反转恢复序列(3D-fluid attenated inversion recovery,3D-FLAIR)、相位对比血管成像(phase contrast MRA,PC-MRA)。将MRI和PET-CT数据导入Neurotech手术计划系统(清华大学自主研发)。在颅脑MRI轴位图像上依靠特征性的Ω形状判断该部位为手的功能运动区[3-4],见图1,其后方为从内向外的脑沟,恒定的沟即为大脑中央沟,应用Neurotech手术计划系统在轴位不同层面将顺中央沟往外延续到硬膜下的位置连成一条线,3D重建后可以显示中央沟在脑表面的轨迹,以此描绘一侧中央沟的全程,见图2。
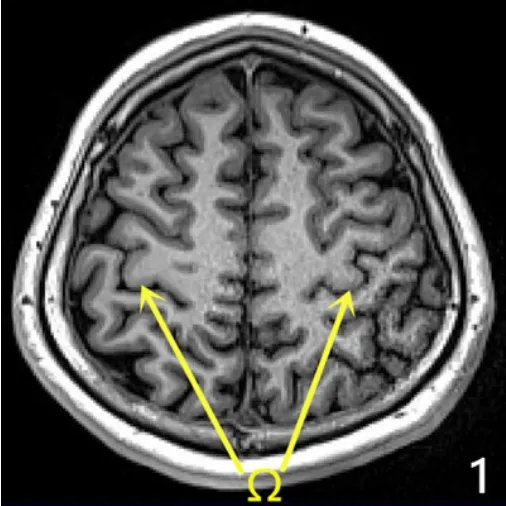
图1 患者颅脑MRI检查结果Figure 1 Brain MRI examination results of the patient

图2 应用Neurotech手术计划系统显示中央沟在脑表面的轨迹Figure 2 Trajectory of the central sulcus on the surface of the brain visualized by Neurotech surgery planning system
1.4 电极植入计划的制定 放置电极的数量并非固定不变的,有学者认为电极数量通常为7~14根。当电极数量少于6根时,应考虑有无行SEEG的必要。相反,当电极数量多于15根时,可以适当减少电极的数量[5]。也有学者认为,对于中央区癫痫患者,放置每根电极均要考虑血肿发生率及患者风险-收益比[6]。本研究放置电极位置优先考虑患者的首发症状,同时考虑患者的大脑体积及患者的经济因素等,根据患者发作期及发作间期EEG解释患者发作起源并确定致痫灶的大体位置,如PET-CT结果与该区域重合,则该区域为重点放置电极的区域,同时通过综合评估患者的风险-收益比调整放置电极的数量,以增加定位的准确性。
1.5 SEEG电极植入 局部麻醉下安装Leksell头架后,进行颅脑CT扫描(层厚0.75 mm),将扫描后的CT与术前的手术路径计划融合校准,得出每根电极的坐标参数(X、Y、Z、arc、Ring)。患者气管插管全身麻醉后,根据计算好的电极坐标,依次进行电极植入[2]。术后再次进行颅脑CT扫描,将CT图像传入Neurotech 手术计划系统,与术前图像进行融合,由此确认电极植入位置的准确性,明确有无电极弯曲或折断、颅内血肿等并发症,术后行长程视频脑电监测。
1.6 Ⅱ期术前评估及手术 10例患者行颅内电刺激验证致痫灶及明确功能区,每个触点分别给予50 Hz、1~8 mA电刺激,并记录患者的主观感受、有无诱发发作及有无后放电。多学科讨论确定发作起源,制定手术切除范围和切除计划。手术切除原则:在保留功能区的情况下,最大限度地将发作放电起始区、早期受累区、发作间期频繁放电区及电刺激后诱发惯常发作区的皮质切除。
1.7 术后随访 患者术后持续门诊及电话随访,评价术后癫痫控制效果和神经功能缺损情况。(1)癫痫控制效果:术后6个月采用Engel分级评定癫痫控制效果,达到EngelⅠ级和EngelⅡ级为治愈[7]。(2)神经功能缺损情况:术后第1天、第7天及术后3个月评价患者肌力,分为0~Ⅴ级;采用美国脊髓损伤协会(American Spinal Injury Association,ASIA)感觉指数评价患者感觉障碍情况。
2 结果
2.1 SEEG情况 10例患者植入电极数量为9~18根,共109根,平均植入电极数量为(10.9±2.9)根;触点总数为1 112个,其中涉及中央区电极97根,触点数为978个。SEEG时间为3~24 d,平均(10.9±6.1)d。电极植入及长程视频脑电监测过程中无颅内出血、电极脱落、颅内感染、脑脊液漏等并发症发生。
2.2 术后随访情况 10例患者均根据Ⅱ期评估结果进行了局部脑皮质切除术,术后随访6~19个月,平均(11.6±3.9)个月。癫痫控制效果:EngelⅠ级6例,EngelⅡ级2例,EngelⅢ级2例,治愈率为8/10。10例患者术后出现肢体及面部麻木7例,均于3个月后消失;术后出现对侧肢体瘫痪2例,其中1例患者术后3个月肌力恢复正常,另1例患者术后3个月下肢肌力恢复至4级、上肢肌力正常。10例患者的SEEG情况及术后随访结果见表2。

表2 10例MRI阴性中央区药物难治性癫痫患者的SEEG情况及术后随访结果Table 2 SEEG status and postoperative follow-up of the 10 patients with MRI-negative drug-resistant epilepsies in central region
3 讨论
中央区药物难治性癫痫一直是癫痫外科工作的难点,手术既要最大限度地切除致痫灶又要最小限度地损伤功能区,因此精确定位致痫灶和功能区是手术的关键,既往多应用术中电刺激或开颅埋藏皮质电极后电刺激来定位功能区,但是创伤较大[8-9],近年来随着对癫痫症状学认识的深入以及SEEG等先进技术的应用,使得微创下精确定位致痫灶和功能区成为可能。
中央区癫痫患者癫痫发作的症状学十分复杂,不同脑功能区发作起源会表现为相应区域所支配的功能异常,局灶性的运动发作常定位于中央前回相应皮质运动区,而局部感觉异常通常起源于中央后回及其附近,癫痫发作累及中央区岛盖部时则会有言语停顿、发声或言语困难,对侧面部运动、吞咽、舌蠕动感,舌不灵活或冷感等症状。中央区癫痫发作时常会继发全面性发作,发作后常伴有Todd麻痹。本研究10例患者中9例患者癫痫发作时首先出现了不同部位的感觉及运动异常,然后导致了全面的癫痫发作,这些患者考虑致痫灶位于功能区,但是凭借症状学及无创检查无法定位致痫灶,需要借助植入颅内电极来定位致痫灶及功能区。
研究表明,在颅脑MRI轴位图像上依靠特征性的Ω形状可以判断该部位为手的功能运动区[10-11],然后应用Neurotech手术计划系统初步描绘出大脑的中央沟,但大脑功能区的分布存在个体差异[12],简单通过解剖关系定位功能区的方法存在一定的误差。目前功能性MRI、弥散张量成像、脑磁图、PET-CT等功能影像学也能够对皮质功能区和皮质下传导束做无创定位,但目前其定位的可靠性及精确性欠佳[13],不能单纯以此为指导进行功能区的手术。目前认为大脑皮质电刺激是定位功能区的“金标准”[14],既往多通过植入皮质片状电极,然后通过皮质电刺激定位功能区,但是这类手术需要开颅埋藏颅内电极,手术创伤大,术后出血、感染发生率高[15]。也有研究应用术中电生理监测定位功能区,但术中监测必定会延长手术时间、增加出血及感染的发生率,另外电刺激会诱发癫痫,发作严重时会引起脑膨出、脑缺血、脑损伤等,进而增加手术风险[16-17]。本研究结果显示,密集的SEEG电极植入亦可以达到精确定位功能区的效果,本研究中1例患者在中央前后回植入了18根电极(见图3),分别对每个电极的每一个触点给予50 Hz、1~8 mA电刺激,当患者出现运动或感觉症状时不再增加电流强度,通过电刺激准确描绘出了肢体感觉及运动分布区在中央前后回的分布。SEEG术前利用Neurotech手术计划系统重建中央沟,粗略地明确功能区后,再次利用颅内电极电刺激的方法,更加精确地定位功能区。因此利用SEEG技术可以代替开颅埋藏皮质电极以及术中电刺激定位功能区,这样既缩短了手术时间,又避免了术中电刺激以及开颅带来的手术风险。

图3 患者植入电极情况Figure 3 Implanted electrodes of the patient
中央区癫痫致痫灶的精确定位是手术治疗癫痫成功与否的关键,EEG为癫痫的诊断手段之一,但研究表明,EEG受头皮、颅骨、肌电活动和运动等多种伪差的影响,其空间分辨率低,仅能采集到6 cm2范围以上的信号,不能精确定位中央区癫痫患者的致痫灶[18-19]。对于MRI阴性的中央区癫痫患者,致痫灶的定位更加困难。OSTERGARD等[20]对既往16篇文献(共包含了208例患者)分析发现,通过颅内电极定位并手术切除中央区致痫灶后,癫痫控制率达84.4%,67.8%的患者达到EngelⅠ/Ⅱ级,仅有23.1%的患者出现了远期神经功能障碍。本研究10例患者中8例达到EngelⅠ/Ⅱ级,且无严重神经功能障碍。既往研究多应用埋藏皮质电极的方法定位中央区致痫灶[21],本课题组既往研究发现,通过埋藏皮质电极与SEEG定位致痫灶的患者术后癫痫控制和并发症发生率比较差异无统计学意义,而埋藏皮质电极需要开颅放置电极,创伤较大,并发症发生率高,SEEG通过微创钻孔放置电极,降低了颅内血肿、颅内感染、术后脑组织肿胀发生率[22]。另外,SEEG不受空间限制,可以在局部脑区放置多根电极,且可以对皮质电极所不能达到的深部结构如脑沟底部、岛叶等部位进行监测。由此可见,SEEG对于中央区致痫灶的定位是值得肯定的。
综上所述,SEEG可以个体化、密集化地将颅内电极植入某个脑区,精确定位致痫灶,使得中央区癫痫手术切除更精细化,术后不遗留明显的神经功能障碍,适合MRI阴性中央区药物难治性癫痫患者的术前评估,在MRI阴性中央区药物难治性癫痫致痫灶及功能区的定位中发挥了重要作用。但本研究尚存在一些局限性,如由于技术原因,未进行功能性MRI检查。近年来,随着技术的发展,功能性MRI、术中MRI、术中导航系统等使手术切除更为准确,神经功能缺损发生率降低。此外,本研究样本量较小,今后应进行大规模的研究,以指导癫痫致痫灶及功能区的定位,制定更精细化的手术切除策略。
作者贡献:张光明、陈国强进行文章的构思与设计,研究的实施与可行性分析;王玉根、孟大伟、陈建伟进行资料收集;王玉根进行资料整理,论文撰写,统计学处理;王玉根、孟大伟、陈建伟进行论文的修订;陈国强负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
