人参叶多酚GLP-8调控AhR/NLRP3信号通路抑制BaP诱导的气道上皮细胞炎症因子过表达
2022-06-29罗丹黄云罗敏罗强刘杰李玉英
罗丹,黄云,罗敏,罗强,刘杰,李玉英
(1.西南医科大学附属医院呼吸科,四川泸州 646000)
(2.深圳大学医学部过敏反应与免疫学研究所,广东深圳 518000)
研究显示,哮喘发病率及死亡率在全球范围内呈明显升高趋势,预计未来10年,因哮喘导致的死亡率会增加20%,而哮喘患者病情不能得到有效控制是重要的诱因之一[1]。在诱发哮喘的诸因素中,大气污染物不仅能诱发、加重哮喘、过敏性鼻炎和急性支气管炎,对肺功能也会造成严重的损伤[2,3]。苯并芘(Benzo (a) pyrene,BaP)是多环芳烃化合物,是一种典型的环境污染物。BaP来源广泛,包括香烟烟雾、熏烤油炸食品、工业废水以及受污染的大气等[4]。随着工业化进程的推进,城市大气污染状况的加重与呼吸道疾病,尤其是哮喘的发病率有着直接的关系[5]。
中药应用于哮喘的临床治疗,具有改善哮喘症状、提高哮喘患者肺功能以及减轻呼吸道炎症的作用。人参(Panax ginsengC.A.Mey)是五加科、多年生草本植物,具有改善心功能及提高免疫力的功效[6,7]。目前,关于人参的研究多集中于生物活性较佳的人参皂苷及人参多糖[8]。其中,人参皂苷的主要药理作用为改善微循环[9]、提高组织抗缺氧能力、抑制血小板聚集[10]、Ca2+拮抗作用、影响前列腺素(PGs)代谢[11]、抗肿瘤[12]、抗衰老等[13]。在实际应用过程中人参叶多是被丢弃部分,但作为人参植物的一部分,研究发现人参叶中也含有多种生物活性成分,并具有抗疲劳、抗高血糖、抗肥胖、抗衰老等作用[14]。但人参叶中的酚类成分的抗炎作用却鲜有报道。因此,本文将对人参叶中的多酚类活性成分进行分离、鉴定,并对其抗BaP诱导的气道上皮细胞损伤活性进行研究。本研究对人参叶有效利用及其中含有的生物活性成分应用于哮喘的临床治疗具有重要的指导意义。
1 材料和方法
1.1 材料与仪器
新鲜人参叶购于广州市石牌区二天堂大药房,由暨南大学药学院陈河如教授鉴定;文中使用的检测试剂盒、RIPA缓冲液和RNase购于碧云天生物科技有限公司(上海);16HBE细胞购于中国科学院细胞库(上海);抗体购于Cell Signaling(CST,USA);其它化学品均购于Sigma或Adamas。
KQ-250B超声波提取器,昆山市超声波仪器有限公司;Hei-VAP Core ML G3 XL旋转蒸发仪,购于德国海道夫公司;Agilent 1100半制备型高效液相色谱仪购于美国安捷伦公司。
1.2 人参叶有效成分提取和分析
人参叶酚类成分的提取按照前述方法[15]进行,即通过超声提取法对新鲜人参叶(1.92 kg)酚类活性成分进行提取,以水/二氯甲烷(1:1)为提取剂,料液比1:20(m/V,g/mL)萃取,并通过旋转蒸发仪对提取药液浓缩,得人参叶提取物浸膏(87 g)。将二氯甲烷组分(8.25 g)硅胶柱层析,用乙酸乙酯-甲醇梯度体系(100:1、10:1、1:1、0:1)洗脱,得到4个组分。基于BaP暴露诱导的16HBE细胞损伤模型,评价以上4个组分的保护活性,活性最佳部分用于后续分离。将组分1(1.24 g)置于硅胶柱上,用二氯甲烷/甲醇溶剂体系(100:5、20:1、1:1、0:1)梯度洗脱,得5个亚组分。基于BaP暴露诱导的16HBE细胞损伤模型,评价以上5个组分的保护活性,活性最佳部分用于后续分离。组分2(0.71 g)采用半制备型高效液相色谱法(甲醇-水,40:60;流速:3 mL/min),得到GLP-1(tR 5.2 min)、GLP-4(tR 7.8 min)和GLP-11(tR 11.3 min);组分4(0.88 g)采用半制备型高效液相色谱法(甲醇-水,30:70;流速:3 mL/min),得到GLP-2(tR 12.2 min)、GLP-5(tR 15.5 min)和GLP-9(tR 19.4 min);组分5(0.95 g)采用半制备型高效液相色谱法(甲醇-水,50:50;流速:3 mL/min),得到GLP-3(tR 7.8 min)、GLP-6(tR 11.3 min)、GLP-7(tR 17.3 min)、GLP-8(tR 22.5 min)和GLP-10(tR 29.0 min);进一步的GLP-1~11的结构通过1H-NMR、13C-NMR和ESI-MS进行分析鉴定。
本项目分析仪器使用ACQUITY UPLC系统联合和Q Exactive HF混合四极杆Orbitrap,并带有ESI离子源和Orbitrap质量分析仪。质谱仪以35000质量分辨率(200m/z)运行,配备C18色谱柱(UPLC BEH C18,2.1×100 mm,1.7 mm;Waters)结合使用。梯度洗脱所用的流动溶液为水和甲醇,其中含有0.05%的全氟戊酸(PFPA)和0.1%的FA。柱温为40 ℃,进样量5 μL,检测波长254 nm,流速0.4 mL/min。质谱扫描范围设置为70~1000m/z。在正离子和负离子模式下,MS毛细管温度均为350 ℃。
1.3 细胞培养及细胞活性检测
按参考文献[16]所述方法进行细胞培养,即将人支气管上皮(16HBE)细胞培养于10%胎牛血清(FBS)、100 U/mL青霉素、100 μg/mL链霉素、2 mmol/L谷氨酰胺等配置的Dulbecco's Modified Eagle Medium(DMEM)培养基中(37°C,5% CO2)。
GLPs对16HBE细胞的保护活性采用CCK8试剂盒测定:16HBE细胞(1×104cells/孔)接种到含有200 μL培养基的96孔培养板中,过夜。细胞经BaP(1.00 μmol/L)暴露2.0 h后,冷磷酸盐缓冲液(PBS)清洗2遍,再加入含有5 μg/mL GLPs的培养基培养12 h,CCK8试剂盒检测细胞活力。
1.4 细胞内活性氧(ROS)和炎症细胞因子检测
ROS和炎症细胞因子(IL-33、IL-25、IL-1β及IL-6)检测分别按照相应检测试剂盒说明书进行:16HBE细胞(5×105cells/孔)接种于6孔板,过夜;BaP(1 μm)暴露2 h,冷PBS清洗2遍,再加入含有GLP-8(5 μg/mL、25 μg/mL)的培养基培养12 h。据检测试剂盒要求,测量细胞内ROS和炎症细胞因子含量。
1.5 线粒体跨膜电位(ΔΨm)及细胞凋亡检测
按照参考文献进行线粒体跨膜电位检测,即16HBE细胞(5×105cells/孔)接种于6孔板,过夜;然后BaP(1 μmol/L)暴露2 h,冷PBS清洗2遍,加入含有GLP-8(5 μg/mL、25 μg/mL)的培养基培养12 h,收集细胞,冷PBS洗涤。室温,加入含有1 μg/mL JC-1染液孵育30 min。弃上清液,使用流式细胞仪检测[18]。
按照参考文献进行细胞凋亡检测,即16HBE细胞(5×105cells/孔)接种于6孔板,过夜;然后BaP(1 μmol/L)暴露2 h,冷PBS清洗2遍,加入含有GLP-8(5 μg/mL、25 μg/mL)的培养基培养12 h,收集细胞Annexin V-FITC/PI孵育,流式细胞仪检测细胞状态[17]。
1.6 Western blotting实验
16HBE细胞(3×106cells/皿)接种于10 cm培养皿中培养过夜;BaP(1 μmol/L)暴露2 h,冷PBS清洗2遍,加入含有GLP-8(5 μg/mL、25 μg/mL)的培养基培养12 h,收集细胞,采集总蛋白,用Bradford蛋白测定法测定蛋白质含量。参考文献进行Western blotting蛋白分析[18]。利用Image J软件对蛋白密度进行分析。
1.7 统计分析
用Graphpad Prism 5(San Diego,USA)进行数据分析;通过Student'st-检验进行对照和治疗之间的统计学比较。所有实验至少进行3次;数据表示为平均值(mean)±平均值的标准误差(SD);p<0.05被认为具有统计学意义。
2 结果与讨论
2.1 人参叶酚类化合物的分离及鉴定
经活性追踪及多种色谱分离方法共分离鉴定出11个人参叶酚类化合物(图1)分别为GLP-1(Oligophculatin A)、GLP-2(Oligophculatin B)、GLP-3(Oligophculatin C)、GLP-4(Oligophculatin D)、GLP-5(Oligophculatin E)、GLP-6(Oligophculatin F)、GLP-7(Albaspidin AP)、GLP-8(Albaspidin AA)、GLP-9(Albaspidin AB)、GLP-10 (Methylene-bis-phlorobutyrophenone)、GLP-11(1-[3-[(3-acetyl-2,4,6-trihydroxyphenyl)methyl]-2,4,6-t rihydroxyphenyl] butanone)。其中,GLP-1~11均为首次从人参叶中分离获得。
参考相关文献[19],通过高效液相色谱仪测得GLP-1~11的纯度>98.0%。

?

?
2.2 人参叶酚类化合物保护活性评价
用不同浓度的GLPs最终化合物的纯品(0.01~5.00 mg/mL)处理16HBE细胞24 h,并通过CCK8测定细胞活力以测定GLPs自身细胞毒性。实验结果表明,与空白对照组相比,GLPs在低于3.60 mg/mL时,16HBE细胞活力均无显著性差异。
与空白对照组(细胞存活率设为100%)相比,BaP暴露使16HBE细胞活力降低19.70%,由此说明BaP暴露对细胞造成了一定的损伤,进而使其细胞活力降低。而与BaP组相比,经GLPs处理后16HBE细胞活力升高。其中,GLP-8组16HBE细胞活力提升最为显著;与BaP组相比,16HBE细胞活力提升13.90%(表3)。由此得出,GLPs可减轻BaP暴露导致的16HBE细胞损伤,进而发挥保护活性。基于GLP-8具有最佳抗BaP暴露诱导的损伤活性,进而以GLP-8为代表,研究其潜在的分子作用机制。
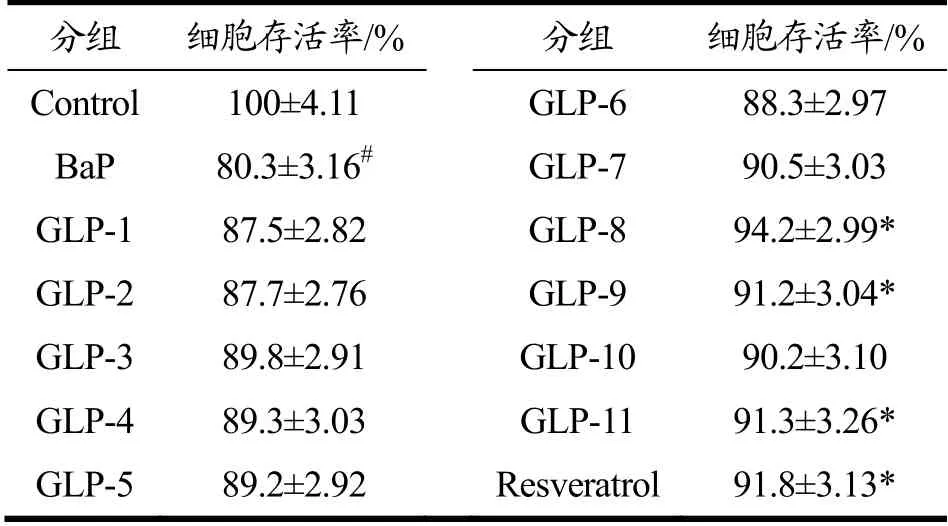
表3 GLP-1~11增强人气道上皮细胞(16HBE)抗Bap暴露导致的损伤活性 Table 3 GLP-1~11 enhance protective activity of 16HBE cells against Bap-exposure induced cell viability decline
2.3 GLP-8抑制BaP暴露导致的16HBE细胞氧化应激
自由基活性氧(Reactive oxygen species,ROS)产生过剩或抗氧化能力下降会诱发DNA损伤和DNA损伤修复反应及细胞凋亡[20]。研究报道,BaP能够作用于人支气管上皮细胞、肺泡组织使谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)、超氧化物歧化酶(Superoxide dismutase,SOD)活性降低,诱发ROS及MDA含量升高,进而导致氧化应激,损伤人支气管上皮细胞及肺泡组织[21]。因此,减少ROS的生成是减轻氧化损伤的一种重要策略。如图2a所示,BaP暴露显著诱导了16HBE细胞ROS的生成,与空白对照组相比,BaP组ROS含量升高247%。GLP-8处理后,BaP诱导的ROS含量升高被显著抑制,ROS含量分别降低19.30%(5 μg/mL)和41.30%(25 μg/mL)。基于此可推测人参叶多酚类化合物可能是通过抑制BaP暴露导致的细胞内ROS过量产生,抑制氧化应激发挥保护活性的。
细胞凋亡线粒体途径在细胞氧化应激过程中起着重要作用[22]。为研究GLP-8减轻BaP诱导的细胞氧化损伤的潜在机制,进一步检测了16HBE细胞ΔΨm的变化情况。如图2b所示,与空白对照组相比(4.46%),BaP暴露使16HBE细胞ΔΨm显著下降13.33%。而经GLP-8共培养后,ΔΨm下降被显著抑制,BaP暴露诱导的ΔΨm分别下降7.87%(5 μg/mL)和4.46%(5 μg/mL)。GLP-8能够减少BaP暴露导致的16HBE细胞内ROS积累并抑制BaP暴露导致的16HBE细胞ΔΨm下降。实验结果进一步证实,GLP-8可能通过抑制BaP暴露导致的氧化应激发挥保护16HBE细胞作用。
线粒体通透性转变孔(Mitochondrial Permeability Transition Pore,MPTP)是位于线粒体内外膜之间由多个蛋白质组成的复合通道。其中,Bcl-2家族相关蛋白能够调控MPTP。其次细胞内Ca2+,ROS等也可能直接或间接参与MPTP的调控[23]。MPTP开放导致线粒体基质内的高渗透压可能使基质肿胀导致外膜破裂,释放出细胞色素C(Cytochrome C,Cyt c)。而Cyt c从线粒体释放到细胞浆会降低细胞抗氧化能力,进而诱发细胞凋亡[24]。本实验中,BaP暴露显著诱导了Cyt c从线粒体释放到胞质中(图2c)。而GLP-8显著抑制了BaP暴露导致的Cyt c从线粒体到胞质的释放。Bcl-2家族蛋白对细胞凋亡的调控至关重要,其中抗凋亡蛋白(Bcl-2)和促凋亡蛋白(Bax)的比例是调控MPTP,决定细胞凋亡进程的关键调控因素[23]。因此,本文检测了GLP-8对BaP暴露导致的Bcl-2家族蛋白(Bcl-2和Bax)表达变化的影响。如图2c所示,BaP暴露导致的Bcl-2下调及Bax表达上调,Bcl-2/Bax比例降低。而GLP-8处理后,BaP暴露导致的Bcl-2/Bax比例降低被显著扭转,这些结果表明GLP-8可通过线粒体信号途径减轻BaP暴露导致的16HBE细胞氧化应激。
2.4 GLP-8抑制BaP暴露诱导的16HBE细胞炎症因子分泌
研究报道,BaP暴露能够促进Der f 1诱导的上皮细胞因子释放,进而加重对气道上皮细胞的损伤[16]。接下来,本文研究了BaP暴露是否能诱导上皮细胞因子的产生,以及GLP-8是否能抑制这种反应。16HBE细胞BaP暴露后,ELISA检测发现,IL-33、IL-25、IL-1β及IL-6含量显著升高(图3);与空白对照组相比,BaP暴露使IL-33、IL-25、IL-1β及IL-6含量分别升高247%、67.90%、62.70%及103.20%。相反的,GLP-8抑制了BaP暴露诱导的16HBE细胞上皮细胞因子IL-33、IL-25、IL-1β及IL-6的过表达。与BaP暴露组相比,GLP-8(25 μg/mL)使IL-33、IL-25、IL-1β及IL-6的分泌减少60.10%、28.90%、33.50%及41.90%。以上实验结果说明,GLP-8可能是通过抑制BaP暴露导致的炎症细胞因子发挥保护功能的。
2.5 GLP-8抑制BaP暴露诱导的16HBE细胞凋亡
细胞凋亡是一种程序性细胞死亡形式,在细胞凋亡过程中细胞形态会发生显著的变化,如细胞收缩、核碎裂和染色质凝聚等[25]。本实验中,与空白对照组(细胞总凋亡率为7.80%)相比,BaP暴露使细胞凋亡显著增加(BaP组,细胞总凋亡率为24.50%)。而与BaP暴露组相比,GLP-8治疗组细胞凋亡率分别降低5.80%和9.30%(图4)。细胞凋亡实验为GLP-8抑制BaP暴露诱导的16HBE细胞损伤提供了进一步的证据。
2.6 GLP-8抑制BaP诱导的芳基烃受体(AhR)活化及核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体激活
研究报道,芳基烃受体(AhR)活化在BaP加重尘螨诱发的过敏性哮喘患者炎症细胞因子IL-33、IL-25和胸腺基质淋巴细胞生成素(Thymic Stromal Lymphopoietin,TSLP)的过表达中具有十分重要的作用[17]。为了检测GLP-8能否抑制BaP暴露诱导的AhR活化,本文检测了AhR及其下游主要蛋白细胞色素P450亚酶1A1(CYP1A1)的表达情况。结果如图5a、5b显示,BaP暴露使AhR及CYP1A1的表达显著增加,而GLP-8抑制了BaP暴露诱发的AhR信号激活。研究报道,BaP暴露会诱导呼吸道上皮细胞ROS产生,激活AhR信号通路并进一步诱发上皮细胞因子过表达。本文的实验结果显示,GLP-8能够抑制BaP暴露诱导的16HBE细胞ROS过量产生,GLP-8处理后,ROS含量分别降低19.30%(5 μg/mL)和41.30%(25 μg/mL);GLP-8也能够抑制BaP暴露诱导的16HBE细胞AhR信号通路激活,与空白对照组(AhR表达设为100%)相比,BaP暴露使AhR的表达增加89.10%,CYP1A1的表达增加49.32%,经GLP-8处理后,BaP暴露使AhR的表达降低了40.00%,CYP1A1的表达降低了65.50%。
NLRP3炎症小体是由NOD样受体(NOD-like receptor,NLR)家族成员NLRP3蛋白与ASC接头蛋白及胱冬肽酶-1(Caspase-1)胱冬肽酶形成的一个多蛋白复合物,其活化后能促进IL-1β、IL-18和IL-33等多种炎症细胞因子的剪切,成熟与分泌,因而在炎症发生过程中起关键作用。NLRP3炎症小体作为固有免疫的重要组分在机体免疫反应和疾病发生过程中具有重要作用[26]。因此,本实验中进一步检测了BaP暴露及GLP-8对NLRP3炎症小体NLRP3、ASC及Caspase-1蛋白表达的影响。结果如图5c、5d所示,BaP暴露显著诱导了NLRP3炎症小体NLRP3、ASC及Caspase-1蛋白的表达,分别增加69.80%、92.60%、151.20%;而GLP-8抑制了BaP暴露诱发的NLRP3炎症小体激活,GLP-8处理后的NLRP3、ASC及Caspase-1蛋白表达量增加显著降低,分别为19.40%(5 μg/mL)、18.58%(5 μg/mL)、67.40%(5 μg/mL)。
3 结论
本研究发现环境污染物BaP暴露会诱发气道上皮细胞ROS过量产生并诱发氧化应激,激活AhR信号通路;进一步的,BaP暴露会诱发气道上皮细胞炎症因子分泌并激活NLRP3炎症小体,最终导致细胞凋亡。本文分离的人参叶多酚类化合物具有抗BaP诱导的氧化损伤及炎症损伤的活性。其中,GLP-8能够抑制BaP暴露诱导的ROS过量产生及炎症细胞因子(IL-33、IL-25、IL-1β及IL-6)等过表达。进一步研究发现,GLP-8可能是基于抑制NLRP3炎症小体及AhR信号通路相关蛋白的表达进而发挥抗炎及抗氧化活性的。同时,本研究为人参叶有效活性成分的提取及其应用于哮喘的临床治疗方面提供了一定的理论借鉴依据。
