人PKCα蛋白结构和功能的生物信息学分析
2022-06-29龙鼎新
江 岚, 邓 强, 龙鼎新
(1.湖南环境生物职业技术学院,湖南省衡阳市421001; 2.南华大学衡阳医学院公共卫生学院,湖南省衡阳市421001)
蛋白激酶C(protein kinase C,PKC)属于丝氨酸/苏氨酸蛋白激酶,主要依赖于Ca2+和磷脂激活,Ca2+作为第二信使广泛存在于细胞内,Ca2+信号的释放会引起细胞死亡机制触发,下游表型体现,进而参与调节增殖分化、胞内分子分泌、自噬和凋亡等各种细胞生理过程[1],通过磷酸化来介导其他蛋白的功能[2]。已知PKC共有10个亚型,其可分为3组:常规PKC(cPKC)包括α、βI、βII和γ亚型;新型PKC(nPKC)包括δ、ε、η和θ亚型;非典型PKC(aPKC)包括ι(也称为小鼠λ)和ζ亚型[3]。PKCα广泛存在于哺乳动物的肌肉、脑、肺、皮肤、心等组织中[4]。PKCα含有C1和C2结构域,其可以通过二酰基甘油(DAG)和Ca2+在磷脂酰丝氨酸的存在下被激活,并参与多种生物学功能,包括细胞周期进程、肿瘤发生、迁移和自噬[4]。例如PKCα使滋养层细胞表面抗原2(Trop-2)磷酸化,增强了细胞运动能力[5];敲低PKCα可以降低LC3-II和自噬通量的水平[6]。PKCα还与多种疾病的发生发展相关,如PKCα在糖尿病妊娠中通过miR-129-2抑制自噬并诱导神经管缺陷[7];在炎性关节炎疼痛模型中,PKCα上调伤害性背根神经节神经元的钠通道Nav1.9[8];苹果树酚类提取物可通过调节PKCα信号通路并减轻铅(II)暴露小鼠的内质网应激来维持肝肾功能[9];PKCα通过刺激自噬通量调节肾纤维化和成纤维细胞活化[10]。
细胞内含有非常多样的与PKCα直接相互作用的蛋白分子,可以很好地调节其活性,在很多信号通路中,PKCα都发挥着重要的作用,在细胞信号转导中处于中枢地位,是多种信号途径的整合者。本文基于生物信息学方法,对人PKCα蛋白结构和功能进行分析,为PKCα的机制研究等提供参考依据。
1 材料和方法
1.1 人PKCα蛋白序列的获得
通过NCBI数据库http://www.ncbi.nlm.nih.gov/protein/检索人PKCα序列,下载人PKCα蛋白的氨基酸序列。
1.2 蛋白跨膜结构分析
采用CBS中的TMHMM Serverv.2.0(http://www.cbs.dtu.dk/services/TMHMM/),通过在线的方式针对人PKCα蛋白跨膜结构进行预测。
1.3 亚细胞定位分析
对人PKCα蛋白进行亚细胞定位,使用ProtComp 9.0(http://linux1.softberry.com/berry.phtml?group=programs&subgroup=proloc&topic=protcompan)分析,以获得蛋白定位结果。
1.4 蛋白质理化性质分析
对人PKCα蛋白的理化性质进行预测,主要通过ProtParam[10]程序来实现,囊括了氨基酸数量、相对分子质量、理论等电点、不稳定系数以及总平均亲水性;利用Protscale[11]程序(http://web.expasy.org/protscale)对人PKCα蛋白进行亲疏水性测定;主要采用SignalP-4.0[12]测定人PKCα蛋白有无信号肽及切割位点。
1.5 磷酸化位点分析
使用NetPhos 2.0 Server(http://www.cbs.dtu.dk/services/NetP hos/)针对人PKCα蛋白磷酸化位点通过在线的方式来进行预测。
1.6 蛋白质二级结构和三级结构分析
采用PHD(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_seccons.html)在线预测人IP3R蛋白二级结构。采用SWISS-MODL对PKCα三级结构进行预测。
1.7 蛋白信息和相互作用蛋白预测
利用PredictProtein(https://www.predictprotein.org/)分析跨膜螺旋区域、二硫桥以及结合位点等性质。使用STRING数据库(https://string-db.org/)在线预测人PKCα蛋白相互作用网络。
2 结 果
2.1 人PKCα蛋白序列的查找
登陆美国国家生物技术信息中心数据库,下载获得人PKCα蛋白氨基酸序列,其NCBI序列号为BAU98542.1。
2.2 人PKCα蛋白跨膜结构预测
蛋白质跨膜区域作为跨越细胞膜的区域,其主要存在于蛋白质序列中,通常情况下采用TMHMM在线软件来进行跨膜结构的分析,预测结果如图1所示,人PKCα蛋白无跨膜结构。

图1 人PKCα蛋白跨膜结构分析
2.3 人PKCα蛋白亚细胞定位
运用ProtComp 9.0对人PKCα蛋白进行亚细胞定位。PKCα蛋白定位在质膜上的可能性为71.4%,而定位于其他细胞器或胞外的概率并不大。
2.4 人PKCα蛋白理化性质分析
选择采用ProtParam在线分析显示人PKCα蛋白为亲水性蛋白,不稳定系数38.12%,表明该蛋白属于不稳定蛋白。针对人PKCα蛋白,依托于Protscale来分析其疏水性和亲水性,其中亲水性最强的是326位的谷氨酰胺(Q),而位于451位的亮氨酸(L)亲水性最弱(图2)。对上述PKCα的疏水性和亲水性值进行统计,PKCα的亲水性氨基酸残基总和为-456.897,而疏水性氨基酸残基总和为116.053。PKCα经过上述分析后确定为亲水性蛋白。

图2 人PKCα蛋白疏水性和亲水性预测
2.5 人PKCα蛋白磷酸化位点预测
对人PKCα蛋白的磷酸化位点预测,粉色线条以上表示阈值超过0.5,不同颜色柱状表示不同氨基酸Ser、Thr、Tyr。结果显示,人PKCα蛋白含23个Ser,19个Thr,9个Tyr,可能作为蛋白激酶磷酸化位点存在(图3)。
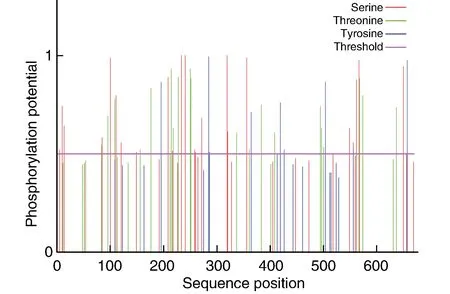
图3 人PKCα蛋白的磷酸化位点
2.6 人PKCα蛋白信号肽切割位点结果
对人PKCα蛋白信号肽及切割位点进行预测。结果显示并不存在信号肽位点,因此可以将其判定为非分泌性蛋白(图4)。

图4 人PKCα蛋白信号肽预测
2.7 人PKCα蛋白质二级结构预测
PKCα蛋白质含有大量无规则卷曲,约占52.68%,推测无规则卷曲为PKCα最大量的二级结构原件,余下依次为α-螺旋约占23.36%和延伸链约占23.96%(图5)。

图5 人PKCα蛋白的二级结构分析
2.8 人PKCα蛋白信息预测
以PredictProtein对人PKCα蛋白的蛋白质序列及结构进行有效预测,获得跨膜螺旋等信息。PredictProtein预测结果为PKCα有15个蛋白结合位点,无跨膜螺旋区域在预测结果方面等同于TMHMM,并不存在任何的二硫键(图6)。
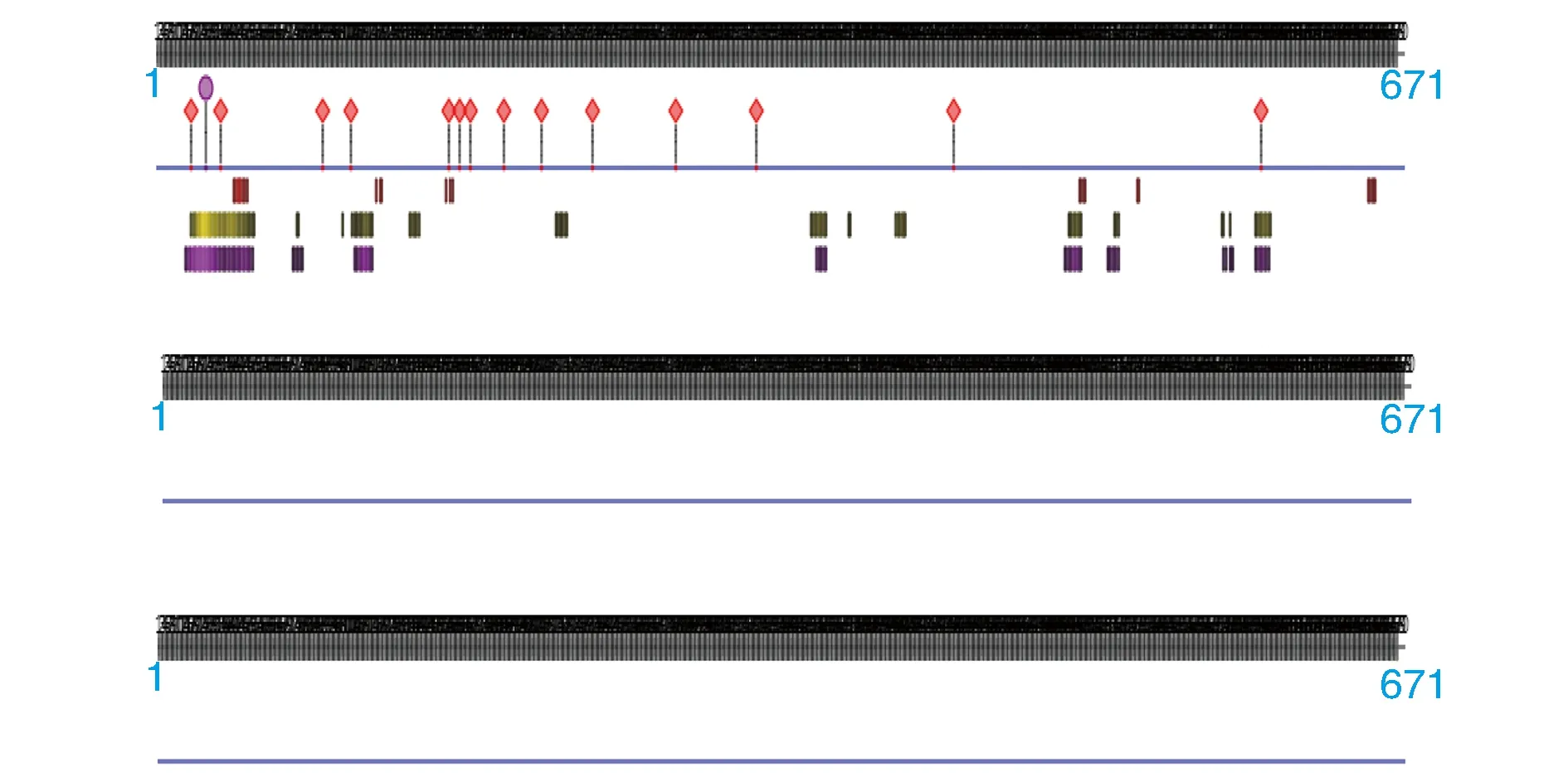
图6 PKCα结合位点、跨膜螺旋区域、二硫键预测
2.9 人PKCα蛋白互作网络及功能预测
人PKCα蛋白主要与PICK1、SDC4、BRAF、AKAP150和PLD1等蛋白质相互作用。对人PKCα蛋白互作蛋白进行GO分析,PKCα分子功能本体论结果表明:该蛋白具有蛋白丝氨酸/苏氨酸激酶活性、转移酶活性、激酶活性、磷酸转移酶活性、转移酶活性、杂环化合物的结合、核苷磷酸结合和小分子结合等的可靠性较高(表1);PKCα生化过程本体论结果表明:该蛋白参与细胞代谢过程、高分子改性、蛋白质磷酸化、细胞蛋白修饰过程、细胞蛋白质代谢过程、细胞大分子代谢过程、初级代谢过程等的可靠性较高(表2);PKCα细胞成分本体论结果表明:该蛋白参与细胞内的部分、细胞质、胞内膜结合细胞器、细胞内的细胞器、膜结合细胞器、核等的可靠性较高(表3)。

表1 PKCα分子功能本体论

表2 PKCα生化过程本体论
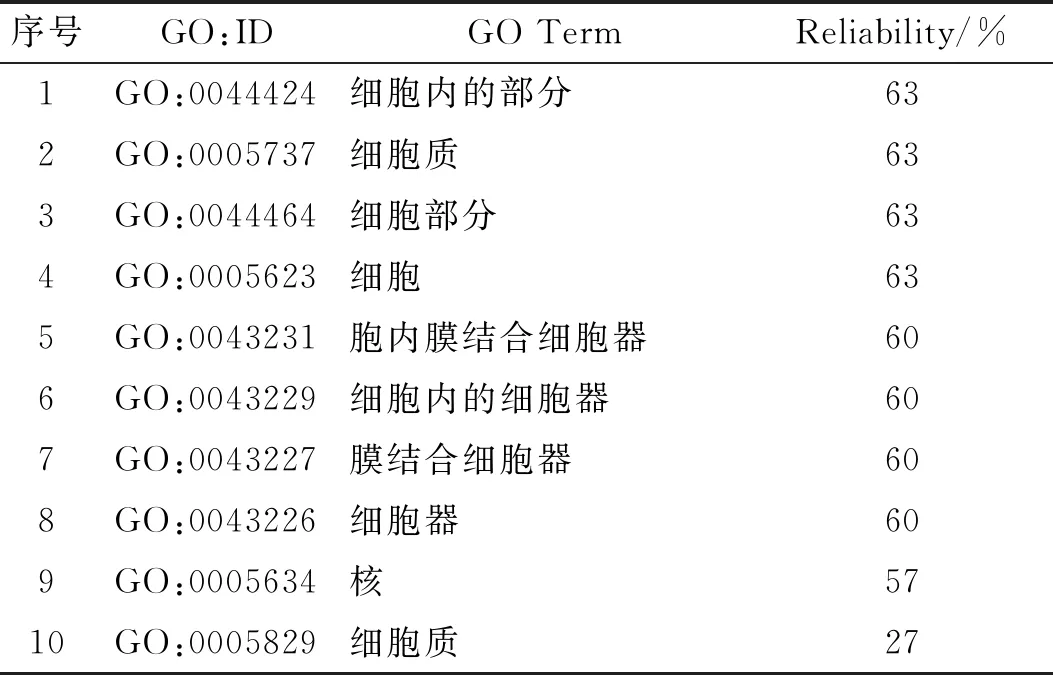
表3 PKCα细胞成分本体论
2.10 人PKCα蛋白三级结构分析
采用SWISS-MODL对人PKCα蛋白三级结构进行预测,GMQE在此处具体为0.73,QMEAN在此处具体为-2.64,序列与3pfq.1.A模板序列具有非常高的相似度,达到了79.85%,这意味着该模型具有相对合理的结构。该蛋白质扭曲非常多,拥有着丰富的结构,此类结构对生物学功能的发挥有重要作用(图7)。

图7 人PKCα蛋白三级结构预测
3 讨 论
生物信息学是一门以计算机为手段,综合运用生物学、信息科学、数学等多学科方法的交叉学科。其主要是对大量的生物信息进行获取、处理、储存、分析和解释,进而发现新的信息和规律[13]。
PKCα在机体中扮演着极其重要的角色,PKCα研究快速推进,本课题第一次对PKCα蛋白的跨膜结构、理化性质和二级结构等进行分析。结果显示PKCα蛋白定位于胞膜和无跨膜结构,预测其为亲水性蛋白。有研究报导,PKCα能被第二信使Ca2+和二酰基甘油(DAG)激活,从无活性的胞质状态转变为活性的膜相关状态,这种构象转变用以调节多种细胞过程,如基因表达[14]、迁移[15]、增殖[16]和细胞凋亡[17]。而PKCα蛋白C末端区域的保守基序的疏水性区域在调节其活性中起着双重作用:通过对细胞内Ca2+的敏化而激活,通过与C2结构域的保守带正电区域相互作用而自动抑制[18]。后续蛋白信息预测PKCα蛋白具有丝氨酸/苏氨酸激酶活性、激酶活性等,与前人结果一致。蛋白二级结构结果显示无规则卷曲以及α-螺旋作为PKCα核心二级结构原件。在细胞内,磷酸化以及去磷酸化作为重要传导途径,因此必须要分析磷酸化位点。结果显示,PKCα蛋白所拥有的磷酸化位点主要包括了Ser、Thr和Tyr,其中最多的就是Ser位点,判断Ser蛋白激酶在蛋白磷酸化中可能扮演着极其重要的角色。最近几年,研究结果与软件预测结果一致,滋养层细胞表面抗原2(Trop-2)在Ser-322处被PKCα磷酸化,并且这种磷酸化增强了细胞运动,并降低了claudin-7定位于细胞边界[5]。其无二硫键,其表现出钙释放通道活性等。研究表明钙通过与钙传感器PKCα和钙调蛋白结合而刺激内吞作用,这对于维持突触传递和神经元网络活动至关重要[19]。蛋白质间相互作用也很关键,深入分析蛋白互作网络,可实现对这种相互作用系统了解,最终发现人PKCα蛋白主要与PICK1、SDC4、BRAF、AKAP150和PLD1等蛋白质相互作用。最新研究结果显示:PICK1是一种支架蛋白,可通过蛋白激酶PKCα(PRKCA)促进其蛋白伴侣的磷酸化调节转录活性[20];在携带BRAF突变的黑色素瘤患者中,PKCα过表达使患者死亡风险增加11倍[21];SDC4可以直接与绒毛外滋养细胞(EVT)中活化的PKCα结合,而抑制PKCα可以降低EVT的入侵和迁移[22];L型Ca2+通道功能的局部控制受AKAP150靶向的PKCα信号传导调节,该信号传导在生理条件下控制持续的Ca2+内流、血管紧张度和血压,并且是血管紧张素II依赖性高血压的基础[23];弓形虫靶向GRA7的ASC和PLD1通过PKCα促进抗菌宿主防御[24]。
本文针对人PKCα蛋白序列展开了生物信息学分。此阶段必然需要用到生物学软件和平台固定模式,软件参数设置存在着差异,导致有不同的结果,因此这一分析方法具有局限性。可以尝试采用多软件多平台综合分析,保证更为精准的预测。进而研究蛋白重要功能区域,此后通过实验对预测结果进行验证。
